响应面法优化藏红花素碱水解制备反式藏红花酸工艺
2021-12-16王吉宇李成文徐彦靖刘东春
王吉宇,李成文,徐彦靖,于 青,刘 楠,刘东春,
(1.沈阳药科大学中药学院, 辽宁沈阳 110016;2.沈阳药科大学药学院,辽宁沈阳 110016)
藏红花素是类胡萝卜素类二萜类化合物,为藏红花酸与β-D-葡萄糖或龙胆二糖形成的糖苷,是藏红花中的重要活性成分[1−2]。藏红花素和藏红花酸在抗氧化[1]、抗肿瘤[2]、增强记忆、抗抑郁[3]、改善视力[4]等方面均显示出较好的药效。药代动力学研究发现,藏红花素口服几乎不能直接吸收进入血液循环[5],只有被肠道微生物水解为藏红花酸后才能被吸收进入血液循环[6−7],个体的肠道菌群差异会导致藏红花素的药效不稳定。并且相对于藏红花素,藏红花酸在体内与白蛋白结合较弱,可较迅速分布于各组织中,透过血脑屏障能力也有所提高,疗效增加[8−9]。其中反式藏红花酸在治疗抑郁[10]、帕金森症和阿尔兹海默症[11−12]等神经疾病方面显示出明显疗效。因此大量制备高纯度的反式藏红花酸将为其新药的研究与开发奠定基础。
藏红花素是藏红花酸与糖的端羟基形成的酯(图1),既有酯键又有糖苷键的特征[13],所以可以采用碱水解、酸水解和酶解的方法水解藏红花素制备藏红花酸。Tashakori等[14]采用的酸水解法存在藏红花素的水解不充分的问题,Chai等[15]采用的酶解法不仅仅对于酶的种类、用量要求高而且步骤繁琐。而Esposito等[16]采用碱水解法,可便捷地完成藏红花素的水解,是制备反式藏红花酸有效的方法。但是反式藏红花酸容易被氧化并且会发生构象的转变转化为顺式藏红花酸导致反式藏红花酸的含量降低,进而降低疗效[17]。碱的浓度、温度、反应时间等因素均可能影响产物的产率和纯度,因此有必要对方法进行优化。

图1 西红花苷Ⅰ(A)、西红花苷Ⅱ(B)与反式藏红花酸(C)、顺式藏红花酸(D)的结构Fig.1 The structure of crocinⅠ(A), crocinⅡ(B), cis-crocetin(C), and trans-crocetin(D)
本研究首先采用单因素考察碱的浓度、温度、水解反应时间三个因素对产物反式藏红花酸的产率的影响,进一步采用响应面法优化制备参数,反式藏红花酸粗品经过重结晶工艺进一步制取高纯度的全反式藏红花酸,旨在为藏红花酸的进一步开发和综合利用提供科学依据。
1 材料与方法
1.1 材料与仪器
藏红花素(纯度25%,w/w) 实验室自制;反式藏红花酸标准品(≥98.0 %)、西红花苷-I标准品(≥98.0 %) 上海阿拉丁生化科技有限公司;甲醇 色谱纯,天津大茂化学试剂公司;N,N-二甲基甲酰胺(DMF)、甲醇 分析纯,天津市富宇精细化工有限公司。
2695-2487 UV高效液相色谱系统美国 Waters公司;ESJ182-4精密天平 沈阳龙腾电子有限公司;HH-2数显恒温水浴锅 金坛市江南仪器厂;SB-3200DTDN超声波清洗机 宁波新芝生物科技股份有限公司;MX-S混匀仪 美国SCILOGEX公司;CT14RD高速台式冷冻离心机 上海精科天美有限公司;DZF-6050真空干燥箱 上海慧泰仪器制造有限公司;Ni-u 正置显微镜 日本尼康株式会社。
1.2 实验方法
1.2.1 水解工艺 将实验室自制的藏红花素配制成10.0 mg/mL的溶液,加入适量的氢氧化钠(浓度为0.1 mol/L)溶液,在水浴中按规定温度和时间进行水解反应,反应结束后放冷至室温,加入0.1 mol/L盐酸调整pH至2~3,使藏红花酸沉淀析出,8000 r/min离心10 min,沉淀用适量纯水洗至中性,收集沉淀,减压冷冻干燥即得藏红花酸粗品[18]。
1.2.2 极端反应条件对反式和顺式藏红花酸产率的影响 精密量取10.0 mg/mL藏红花素溶液20.0 mL,加入0.7 mL氢氧化钠溶液(1.0 mol/L)使碱浓度为1.4 mg/mL,平均分成4份平行样品,在80 ℃水解1、3、5和7 h后,取1 mL水解样品按照1.2.1方法处理,得到反式藏红花酸粗品并经HPLC检测,观察产物中顺式、反式藏红花酸产率的变化。
1.2.3 单因素实验 取10 mg/mL的藏红花素溶液1 mL,按照1.2.1中的方法进行水解,反式藏红花酸的产率作为评价指标。固定氢氧化钠浓度1.4 mg/mL、反应温度70 ℃或反应时间1 h,分别考察氢氧化钠浓度(1.0、1.2、1.4、1.6、1.8 mg/mL)、反应时间(15、30、60、90、120 min)、反应温度(50、60、70、80和90 ℃)的影响,每组实验重复3次。
1.2.4 响应面试验 在单因素实验结果的基础上,选取反应时间(A)、温度(B)和氢氧化钠浓度(C)为考察因素,以反式藏红花酸的产率(Y)作为响应值,采用实验设计与统计软件JMP 14进行Box-Behnken响应面试验设计,响应面试验因素与水平设计见表1[19−20]。
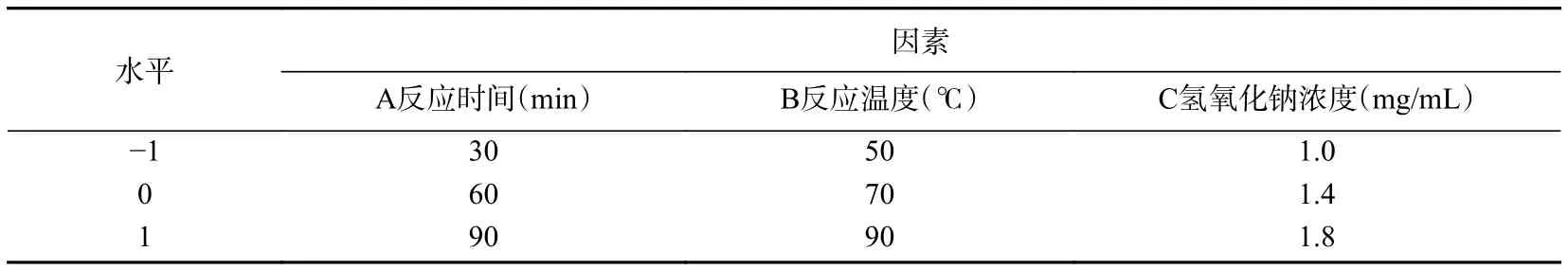
表1 响应面试验因素与水平设计Table 1 Factors and levels of response surface design
1.2.5 藏红花酸产率的计算
1.2.5.1 高效液相色谱条件 根据参考文献[21]并作适当调整,色谱柱:Inertsil ODS-3液相色谱柱(250 mm×4.6 mm, 5 μm);流动相:A 为甲醇(含有0.5%乙酸),B为水(含有0.5%乙酸);梯度洗脱程序:0~6 min,55%A→55%A;6~12 min,55%A→90%A;12~25 min,90%A→90%A;流速:1.0 mL/min;柱温:40 ℃;进样量:10 μL;检测波长:423 nm。
1.2.5.2 反式藏红花酸的含量测定及产率的计算精密吸取溶剂DMF1.00 mL溶解全部水解产物,再精密移取上述溶液100 μL置于10 mL容量瓶中,色谱甲醇定容至刻度,经0.45 μm滤膜过滤后用于HPLC分析。使用反式藏红花酸标准品配制成为2.5、5.0、10.0、15.0、20.0、25.0和 50.0 μg/mL 的溶液,在浓度2.5~50.0 μg/mL范围内色谱峰面积(A)与藏红花酸的浓度(C)的线性关系良好,标准曲线为A=7.448×104C-1.035×104(r=0.9991)。
产率计算方法如公式1所示:
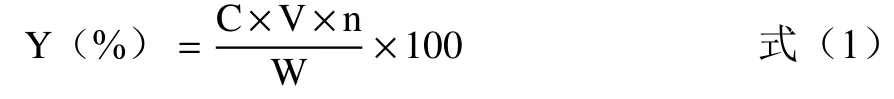
式中:Y(%)表示反式藏红花酸的产率;C表示稀释后的反式藏红花酸的浓度,mg/mL;W表示理论上藏红花酸的量(藏红花素含量以25%计,HPLC法),mg;V表示进样体积,mL;n表示藏红花酸的稀释倍数。
1.2.5.3 顺式藏红花酸相对含量的计算 由于顺式藏红花酸与反式藏红花酸吸光度相近,因此本研究(参照1.2.5.2项下)采用反式藏红花酸的标准曲线计算顺式藏红花酸产率,结果不影响实验参数的优化[22]。
1.2.6 反式藏红花酸的纯化 将反式藏红花酸粗品用0.003 mol/L NaOH溶液溶解,过滤,用0.001 mol/L HCl将溶液pH调节至7~8[23],静置于避光、干燥、阴凉处,将得到的沉淀进一步用氢氧化钠溶液溶解,然后用HCl溶液调节pH至2~3,待反式藏红花酸结晶析出后过滤,纯水洗涤2次,减压干燥得到反式藏红花酸结晶。
1.2.7 反式藏红花酸结晶的形态学观察 用解剖针挑取纯化后的反式藏红花酸晶体微量置于载玻片上,滴加液体石蜡适量,盖上盖玻片后置于光学显微镜下观察并拍照。
1.2.8 反式藏红花酸的结构鉴定 将纯化后的冷冻干燥样品溶于 DMSO-d6(浓度 8.0 mg/mL),采用Bruker AVANCE Ⅲ HD核磁共振波谱仪测定(1H为 600 MHz,13C为 151 MHz),溶剂信号为(DMSO-d6, 2.50 ppm,1H; 39.52 ppm,13C)[24]。使用MestReNova(V14)软件进行图谱处理。
1.3 数据处理
采用 Excel 2016 和GraphPadprism 6软件对数据进行处理及绘图;响应面试验运用JMP 14.0软件进行分析和设计。所有实验平行测定3次,取平均值。
2 结果与分析
2.1 高效液相色谱结果
高效液相色谱图如图2所示,藏红花素原料中的藏红花素水溶性良好,因此在5.74 min时出峰,并且由于藏红花素中连接着不同的糖,因此在后面存在一些其他藏红花素峰。藏红花素水解后,藏红花酸极性小,保留时间变长,反式藏红花酸和顺式藏红花酸分别于17.01 min和18.92 min出峰,这与Chilakala等[22]的研究结果相似。
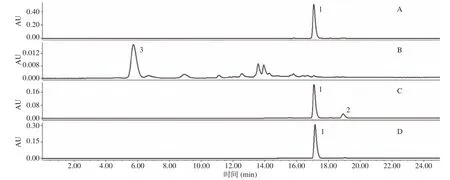
图2 各样品HPLC图谱Fig.2 Representative HPLC chromatograms of samples
2.2 极端反应条件对藏红花酸顺式和反式产率的影响
在长时间高温水解制备过程中,反式和顺式藏红花酸的产率变化如图3所示。1~7 h内随着水解时间的增加,反式藏红花酸的产率有下降趋势,从85.19%逐步减至74.50%。长时间的高温下,反式藏红花酸会受热氧化降解,生成4-羟基-2,6,6-三甲基-1-环己烯-1-甲醛和 4,5,6,7-四氢-7,7-二甲基-5-氧代-3 H-异苯并呋喃酮[25]。顺式藏红花酸产量略有提高,从15.31%增至16.28%,是因为反式藏红花酸会发生构象转变生成顺式藏红花酸[26−27]。
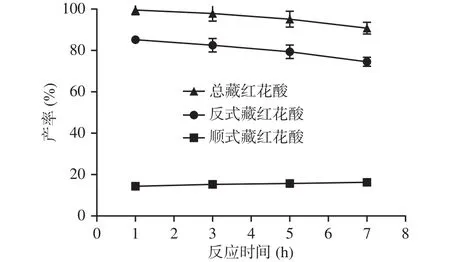
图3 藏红花素碱水解中顺式和反式藏红花酸产率随时间的变化Fig.3 Production of cis-crocetin and trans-crocetin in crocetin alkali hydrolysis
2.3 单因素实验
2.3.1 氢氧化钠浓度的影响 由图4可看出,反式藏红花酸的产率随着氢氧化钠浓度的增加先上升后维持一定水平稍有下降。在1.4~1.6 mg/mL氢氧化钠浓度范围内,反式藏红花酸的产率达到最高值78.41%~78.42%。然而碱浓度过高,反式藏红花酸中存在的长链共轭双键对pH比较敏感,强碱性下会发生降解及构象转变,会导致产率降低[26−27],因此选择1.4 mg/mL氢氧化钠浓度作为碱浓度的中间值进行响应面法考察优化。
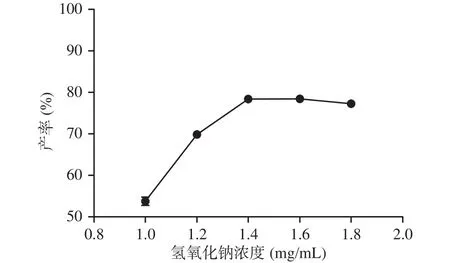
图4 氢氧化钠浓度对藏红花酸产率的影响Fig.4 Effect of sodium hydroxide concentration on the yield of crocetin
2.3.2 反应时间的影响 由图5可知,在15~60 min时产率随反应时间增加,60 min时反式藏红花酸的产率达到最大值79.14%,随后在60~120 min,随着反应时间的增加产率反而有小幅度降低。这个现象与前面2.2结果类似,长时间的水解会引起藏红花酸的氧化降解,从而导致产率降低[25]。因此选择60 min作为时间参数的中间值进行响应面法考察优化。
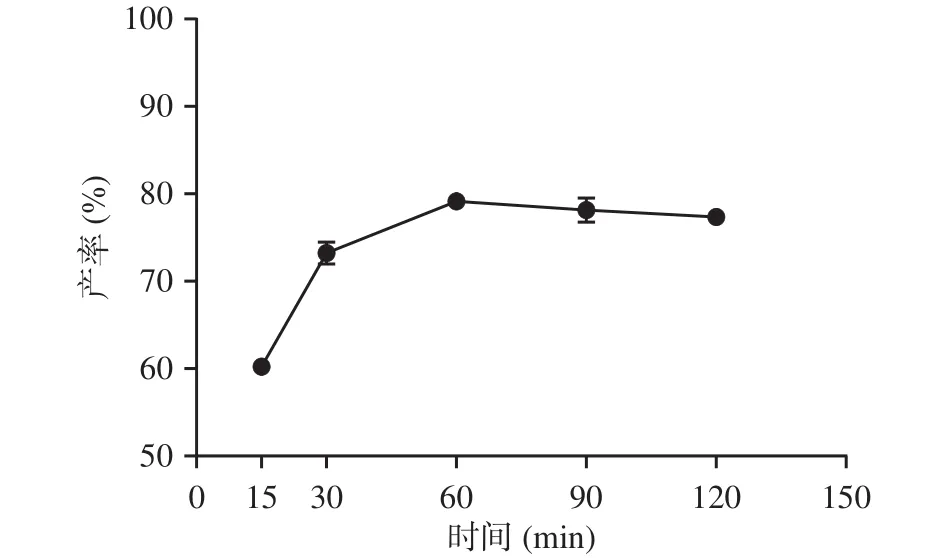
图5 反应时间对藏红花酸产率的影响Fig.5 Effect of time on the yield of crocetin
2.3.3 反应温度的影响 由图6可知,50~80 ℃的范围内,随着温度升高反式藏红花酸产率逐渐升高到80.24%,90℃时,产率出现了明显的下降。高温虽然可以加快藏红花素的水解速度,但反式藏红花酸中存在大量共轭双键,高温下容易受热降解,产率降低[25,27−28]。因此选择70 ℃作为温度参数的中间值进修响应面法考察优化。
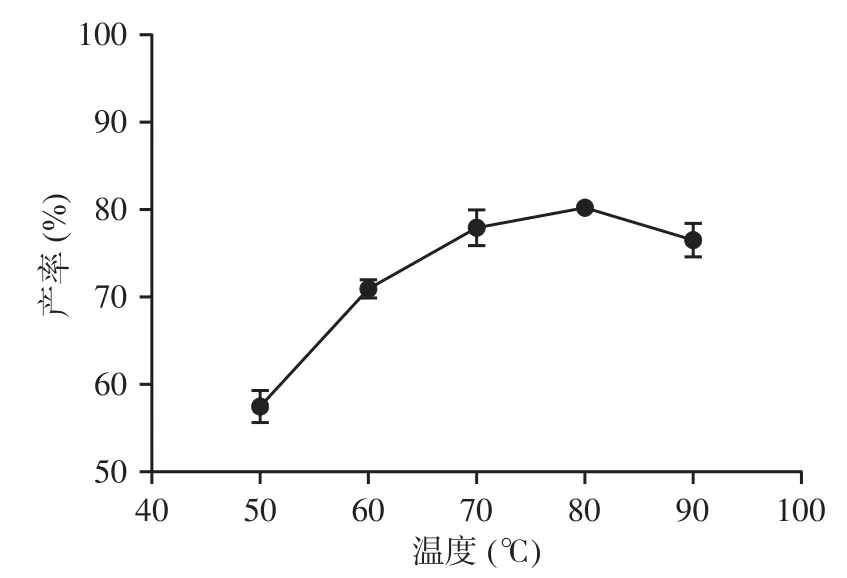
图6 反应温度对藏红花酸产率的影响Fig.6 Effect of temperature on the yield of crocetin
2.4 响应面试验结果
2.4.1 建立回归模型及方差分析 根据单因素结果,选择反应时间(A)、反应温度(B)和氢氧化钠浓度(C)这三个参数的中间值及上下限见表1,采用Box-Behnken试验设计进行响应面试验(表2),回归方程拟合结果见表3。
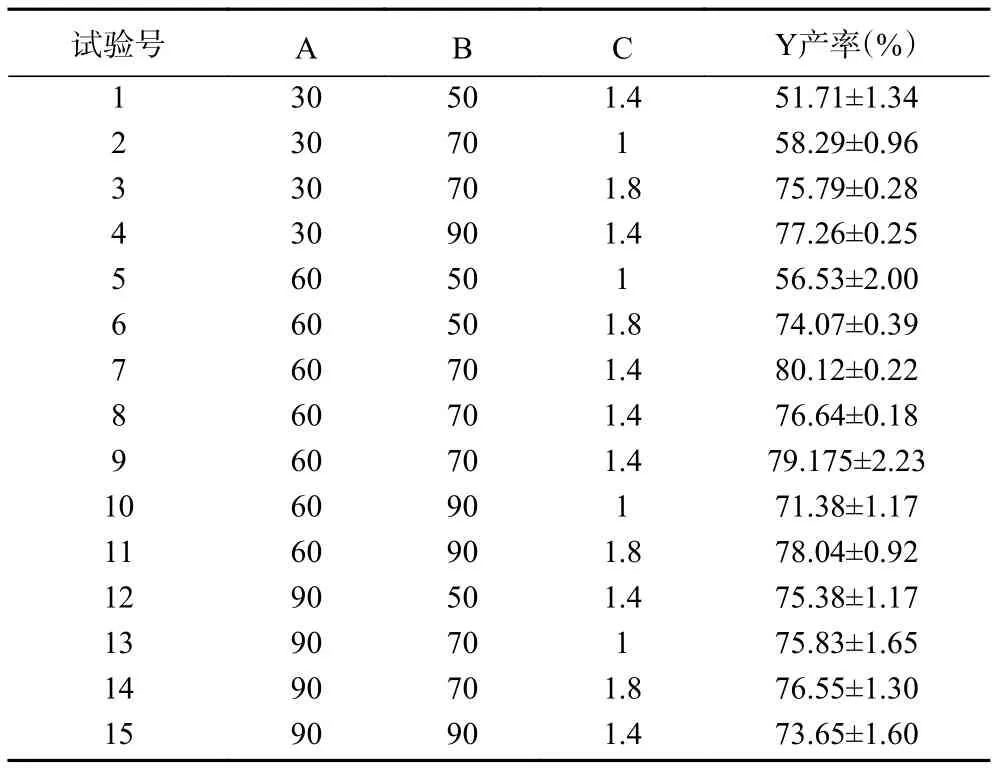
表2 Box-Behnken试验设计和结果Table 2 Box-Behnken design with experimental results

表3 回归方程显著性检验结果Table 3 Results of variance analysis of regression equation
使用软件JMP14对实验结果进行多元回归拟合,结果见表3。
反应时间、反应温度、氢氧化钠浓度与反式藏红花酸产率(Y)的二次多元回归方程为:

方差分析显示模型显著(P<0.05),失拟项不显著(P>0.05),因此模型能够预测水解工艺。由表3可知,反应时间、反应温度、氢氧化钠浓度一次项及其交互项对反式藏红花酸的产率均有显著的影响;由F值可得出对产率的影响顺序为反应温度>氢氧化钠浓度>反应时间。
2.4.2 响应面交互作用分析及最优条件的验证 反应温度、反应时间、氢氧化钠浓度对于产率的交互作用响应面图见图7。
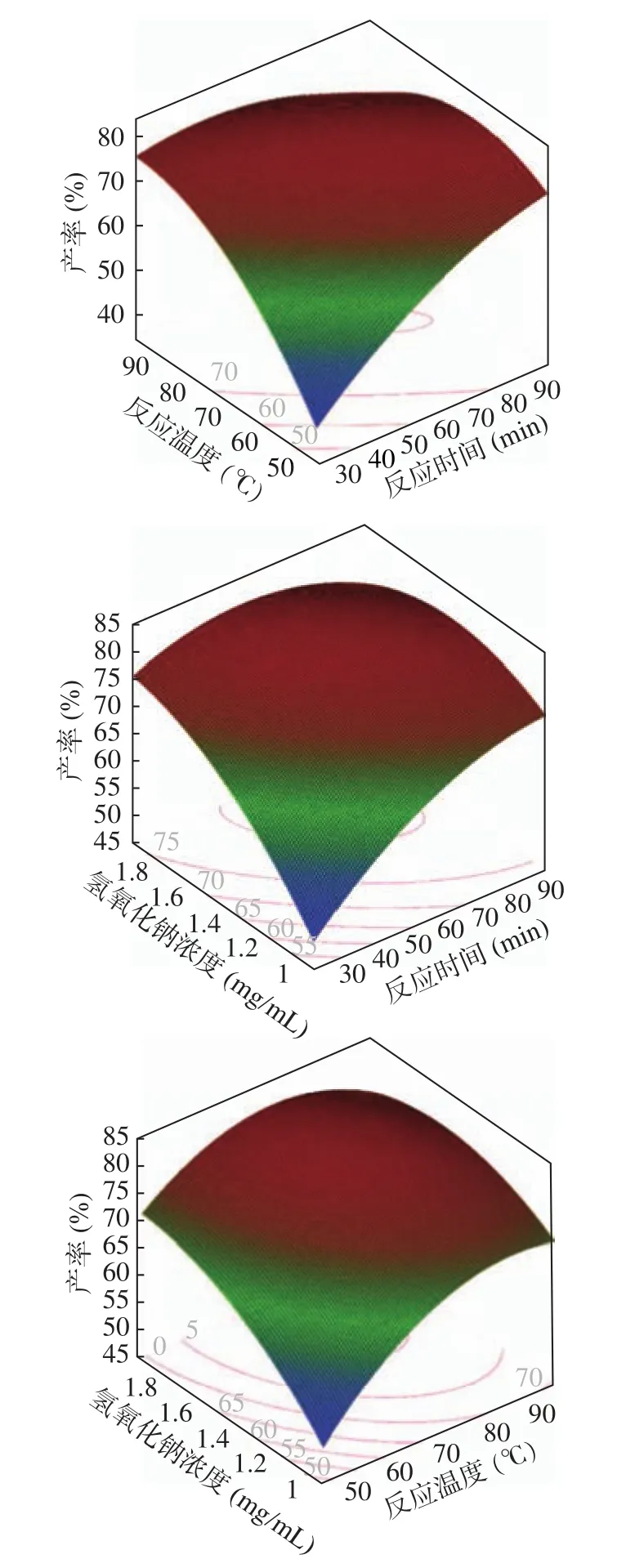
图7 各因素交互作用对藏红花酸产率的影响Fig.7 Response surface plots for the effects of various variables on yield of crocetin
各因素的交互作用在图中表现为,交互作用越大,曲面的陡峭程度和等高线的密度越高并且更加椭圆[29]。从图7可以看出,反应时间和反应温度的交互作用对于反式藏红花酸的产率影响最为显著(P<0.01),曲面陡峭并且等高线很密集呈扁平的椭圆形;其次是反应时间和氢氧化钠浓度的交互作用对于产率的影响极显著(P<0.01),曲面陡峭且等高线密集呈椭圆形状;反应温度和氢氧化钠浓度的交互作用对于反式藏红花酸的产率影响显著(P<0.05),曲面坡度变化相比前两种交互作用较为平缓,等高线稀密集呈椭圆形状。
利用JMP (v14.0)软件对响应面试验结果进行分析,理论计算得到最大产率为81.32%,此时反应时间为55.68 min,反应温度为77.99 ℃,氢氧化钠浓度为1.69 mg/mL。为方便实验操作,选择最佳反应时间为60.0 min,反应温度为80.0 ℃,氢氧化钠浓度为1.70 mg/mL。使用上述最优条件进行三次平行实验,得到反式藏红花酸的实际平均产率为80.09%±0.09%,与预测值80.18%无显著性差异(P>0.05),参数优化后粗品中反式藏红花酸纯度为86%。
2.5 反式藏红花酸的纯化及结构鉴定
通过重结晶的方法精制纯化得到反式藏红花酸晶体(图8),经HPLC采用归一化法验证纯度为99.3%。精制纯化后的反式藏红花酸的1H NMR和13C NMR鉴定光谱数据如图9、表4所示,与文献报道基本一致[30]。

图8 纯化后的反式藏红花酸晶体Fig.8 Crystals of trans-crocetin after purification

表4 制备的反式藏红花酸的核磁共振氢谱(600 MHz,)、碳谱 (151Hz)数据(DMSO-d6)Table 4 1H and 13C-NMR (600 and 151 MHz) data of purified trans-crocetin(DMSO-d6)
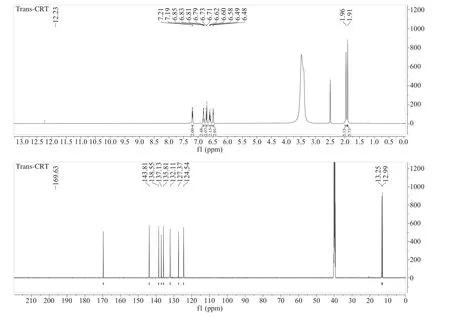
图9 制备的反式藏红花酸的氢谱、碳谱谱图(DMSO-d6)Fig.9 1H and 13C-NMR (600 and 151 MHz) spectrogram of purified trans-crocetin(DMSO-d6)
3 结论
由于藏红花酸含有多个共轭双键,所以水解工艺中的反应温度、反应时间和氢氧化钠浓度对反式藏红花酸产率的影响最为显著。本研究先采用响应面法及星点设计对藏红花素碱水解制备反式藏红花酸的工艺进行了优化分析,并从二元回归模型方差分析对影响反式藏红花酸产率的因素之间的相互作用进行了探讨。结果得出最佳工艺参数为:反应时间为 60.0 min,温度为 80.0 ℃,氢氧化钠浓度为1.70 mg/mL,此条件下反式藏红花酸的产率为80.09%±0.09%。利用pH=7~8时反式藏红花酸比顺式藏红花酸溶解度低的特点,经过重结晶工艺得到了纯度99.3%的反式藏红花酸,为反式藏红花酸的进一步开发利用奠定了工作基础。
