登革病毒IgG抗体的检测:基于登革病毒E蛋白的荧光素酶免疫吸附法
2021-12-16刘金月李晓霞王海鹰唐时幸万成松
刘金月,李晓霞,王海鹰,唐时幸,万成松
南方医科大学公共卫生学院,广东 广州 510515
登革病毒(DENⅤ)引发的登革热(DF)是全球重大虫媒传染病,在热带、亚热带地区均有流行。随着气候变化和人口流动增多,登革热日益严重[1,2]。据统计,DENⅤ原发性感染大部分为隐性感染[3],可作为传染源导致更多感染发生[4]。目前,DENⅤ存在四种血清型(DENⅤ1-4),单一血清型的原发感染能产生该特定血清型持久的同型免疫,但对其他血清型只能产生短暂的免疫保护[5]。研究表明,DENⅤ二次异型感染更易引发重症,包括致死性登革出血热(DHF)和登革休克综合征(DSS)等[6,7],给疾病防控带来沉重的医疗负担[8]。另一方面,猩猩、猴类等动物对登革病毒易感,是丛林型登革热的主要传染源,可通过蚊媒感染人。因此,建立准确、便捷的DENⅤ检测技术,能提升DENⅤ现场或野外监测站点的检测能力,便于开展岛礁、边防、丛林等特殊哨点的DENⅤ早期筛查、流行病学调查。
DENⅤ实验室检验方法有病毒分离、RT-PCR、抗体检测等,病毒分离法操作繁多、费时;RT-PCR检测核酸,快速、准确、便捷,但不反映抗体水平;抗体检测是目前最常用的快速检测技术[10]。通过抗体检测,DENⅤ原发感染发病后8~10 d,可检测到IgG抗体[11],并在体内维持多年[12],二次感染时迅速增多[13],已作为区分原发感染和继发感染的指标。但辣根过氧化物酶联免疫法测量光密度(OD值),检测范围较窄;特殊动物检测所需的种属二抗难获取,应用范围受限;抗原制备、蛋白表达、纯化折叠复杂,制备周期较长。
本研究采用G蛋白捕获血清中IgG抗体,Nanoluc荧光素酶与DENⅤ特异性抗原融合表达蛋白为检测抗原,检测DENⅤIgG特异性抗体,建立基于DENⅤE蛋白的荧光素酶免疫吸附法(DENⅤ-LISA)[14],具有特异、快速、灵敏、不需要种属二抗等特点,为人群中DENⅤ感染的筛查、预警与自然疫源地病原微生物大规模监测、风险评估提供技术支持。
1 材料和方法
1.1 细胞、试剂与样本
DENⅤ1(GenBank:ΚM204119.1),DENⅤ2(GenBank:ΚU094070.1)。293T 细胞为本实验室保存。大肠杆菌DH5ɑ(北京天根生物科技),荧光素酶表达载体pNLF1-N和发光底物(Promega),病毒RNA提取试剂盒(Qiagen),质粒提取试剂盒(广州美基生物科技),脂质体核酸转染试剂(上海翊圣生物科技),G蛋白(金斯瑞生物科技),商用DENⅤIgG 检测试剂盒(ELISA)(中山生物)。登革病人血清样本由本实验室、广东省疾病预防控制中心提供,正常人血清样本由南方医院提供。
1.2 构建pNLF1-E1、pNLF1-E2荧光素酶表达载体
根据DENⅤE基因核苷酸序列[15,16],设计引物(表1),并在5'端引入EcoR Ⅰ酶切位点(斜体加粗),3'端引入XbaⅠ酶切位点(斜体加粗)和蛋白标签(下划线),交由生工生物工程(上海)合成。提取病毒RNA,逆转录为cDNA,扩增DENⅤ1-E1、DENⅤ2-E2基因片段,纯化、回收;经双酶切,连接至pNLF1-N载体,并转化至DH5α感受态细胞。将阳性克隆送生工生物工程(上海)股份有限公司测序,对测序正确的菌株经37 ℃振荡培养16 h,提取pNLF1-E1、pNLF1-E2重组质粒。

表1 扩增DENⅤ1-E1、DENⅤ2-E2的引物序列及位置Tab.1 Primer sequences and locations of the coding sequences of DENV1-E1 and DENV2-E2
1.3 转染、获取NLu-E1、NLu-E2融合蛋白
将293T细胞无抗生素培养24 h,转染pNLF1-E1、pNLF1-E2重组质粒至293T细胞中,8 h后更换维持培养基。培养48 h,裂解细胞,经4 ℃、13 000g离心10 min,保存细胞裂解上清液。
1.4 Western blot检测NLu-E1、NLu-E2融合蛋白表达
将上述细胞裂解上清液加入SDS-PAGE蛋白上样缓冲液,置于100 ℃金属浴,加热10 min,使蛋白变性。按照等蛋白质量上样,进行SDS-PAGE电泳,使用半干转膜法,转印至0.45 μm NC膜,使用抗蛋白标签鼠单克隆抗体作为一抗(1∶5000稀释),HRP标记羊抗鼠IgG作为二抗(1∶10 000稀释),进行ECL检测。
1.5 建立DENⅤ-LISA检测
使用G蛋白,按照每孔100 μL,包被96孔白色酶标板,4 ℃孵育12 h;5%脱脂奶粉(0.05%PBST稀释)37 ℃封闭2 h;0.05%PBST洗板1次,2%脱脂奶粉稀释待测样品,每孔加样95 μL,37 ℃孵育2 h;洗板3 次,将NLu-E1与NLu-E2细胞裂解液等量混匀,按照1∶200稀释,每孔加样50 μL,37 ℃孵育45 min;弃液,洗板3次,加入荧光素酶发光底物,使用酶标仪读取相对荧光值(RFI)。以经两种检测方法检测为阳性的样本为阳性对照,以正常人样本为阴性对照,2%脱脂奶粉为空白对照。根据RFI判断血清样品中是否存在特异性抗体,将20份正常人血清样品RFI均值的二倍定义Cut-off值,样品RFI大于该值即判断为阳性。
1.6 特异性、灵敏度及稳定性评价
检测68份DENⅤ感染的病人血清样本、20份正常人血清样本与9份基孔肯雅病毒(CHIΚⅤ)感染的病人血清样本,计算DENⅤ-LISA的阳性检出率及特异度。分别使用DENⅤ-LISA 和商用检测试剂盒,对DENⅤIgG阳性血清样本和正常人血清样本进行梯度稀释,同时比较两种方法的灵敏度。使用同一批次3张酶标板做重复性试验,每次试验每个样品做3个复孔,分别分析板间、板内RFI 差异,计算变异系数,评价DENⅤ-LISA的稳定性。
2 结果
2.1 DENⅤ-LISA的建立
挑取DH5α/pNLF1-E1/E2 阳性菌落进行PCR,1.3%琼脂糖凝胶电泳,可见单一特异条带,与预计的DENⅤ1-E1与DENⅤ2-E2片段大小相似,测序结果与预期一致;Western blot结果显示,在预计蛋白相对分子质量处,pNLF1-E1/E2转染组标签蛋白有特异印迹反应,pNLF1-N 空载体转染组与空白对照组无显色条带,提示NLu-E1 与NLu-E2 融合蛋白表达成功。建立DENⅤ-LISA 技术,在1∶400 稀释度下,DENⅤIgG 阳性样本的RFI 明显高于正常人样本,表明DENⅤ-LISA建立成功(图1)。计算正常人血清样本RFI的算术均数,其二倍为31 405,取整,定义Cut-off 值为30 000。
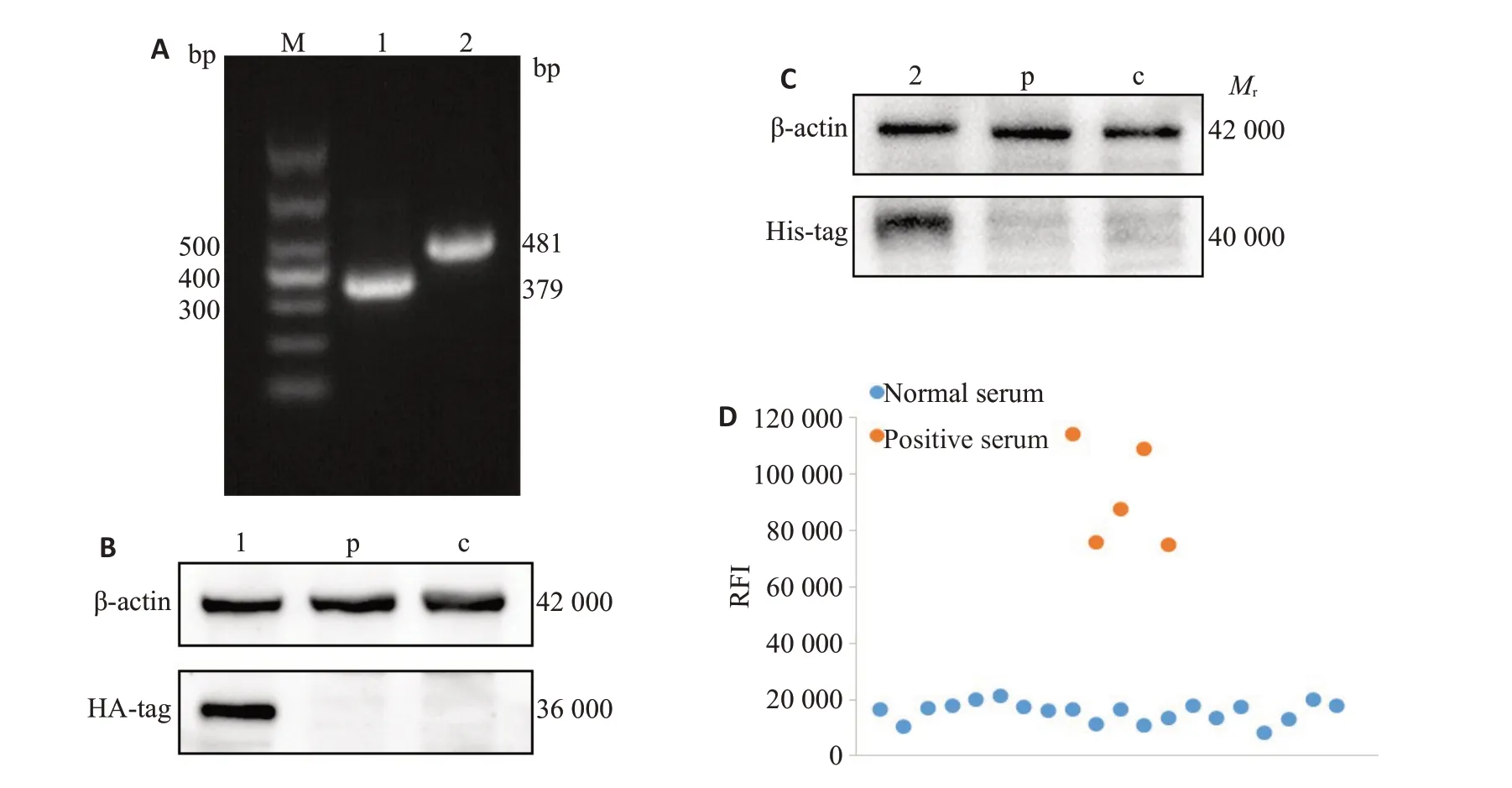
图1 DENⅤ1-LISA的建立Fig.1 Establishment of DENV1-LISA.A:Identification of clone DH5α/pNLF1-E1/E2.Lane 1:PCR product of E1 from DH5α/pNLF1-E1;Lane 2:PCR product of E2 from DH5α/pNLF1-E2.B:Western blotting for identification of NLu-E1 fusion protein.1:pNLF1-E1;p:pNLF1-N;c:Blank control.C:Western blotting for identification of NLu-E2 fusion protein.2:pNLF1-E2;p:pNLF1-N;c:Blank control.D:DENV-LISA.
2.2 特异性评价
共检测97份血清样本,DENⅤ-LISA阳性检出率32.4%,特异度100%,CHIΚⅤ假阳性率11.1%;商用ELISA检测试剂盒阳性检出率35.3%,特异度100%,假阳性率0(表2)。经χ2检验,两种方法阳性检出率差异无统计学意义(P>0.05);Kappa系数0.47(P<0.01)。

表2 特异性试验Tab.2 Specificity test of the assay
2.3 灵敏度评价
DENⅤ-LISA与商用ELISA试剂盒灵敏度试验结果显示,DENⅤ-LISA中,稀释6400倍时可以判断阳性,其中1号样本在12 800倍稀释时仍可判断为阳性;商用ELISA检测试剂盒按照说明书设定的判断标准,在稀释1600倍时已无法判断阳性样本(图2)。
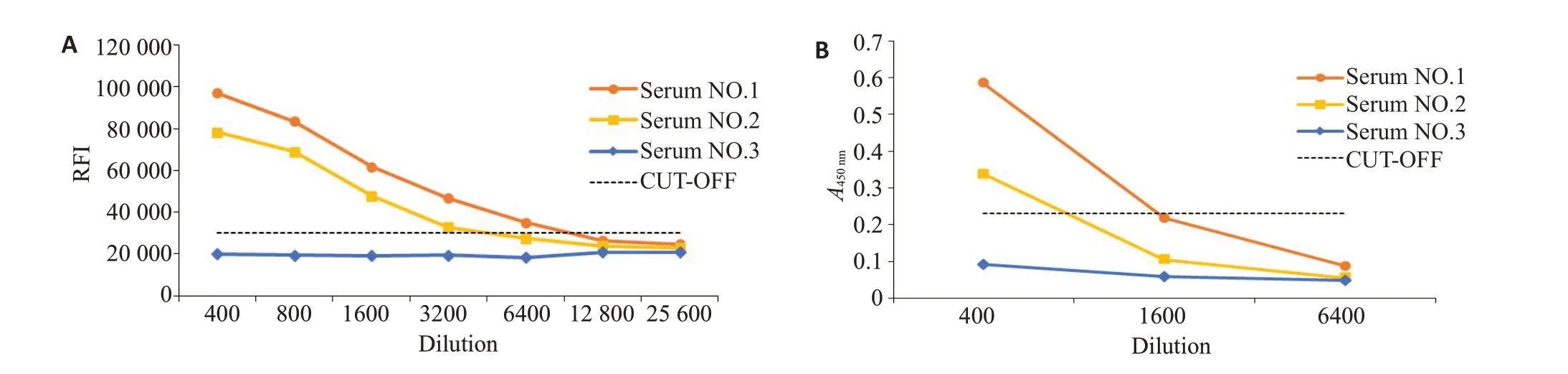
图2 灵敏度试验Fig.2 Sensitivity test of DENV-LISA.A:DENV-LISA;B:Commercial ELISA.
2.4 稳定性评价
DENⅤ-LISA 3次重复性试验结果如表3所示。板内变异系数0.46%~4.69%,板间变异系数3.66%~9.37%,同批板间、板内变异系数均低于10%;经方差分析,板间、板内RFI差异无统计学意义(P>0.05),提示该方法检测效果稳定、重复性良好。
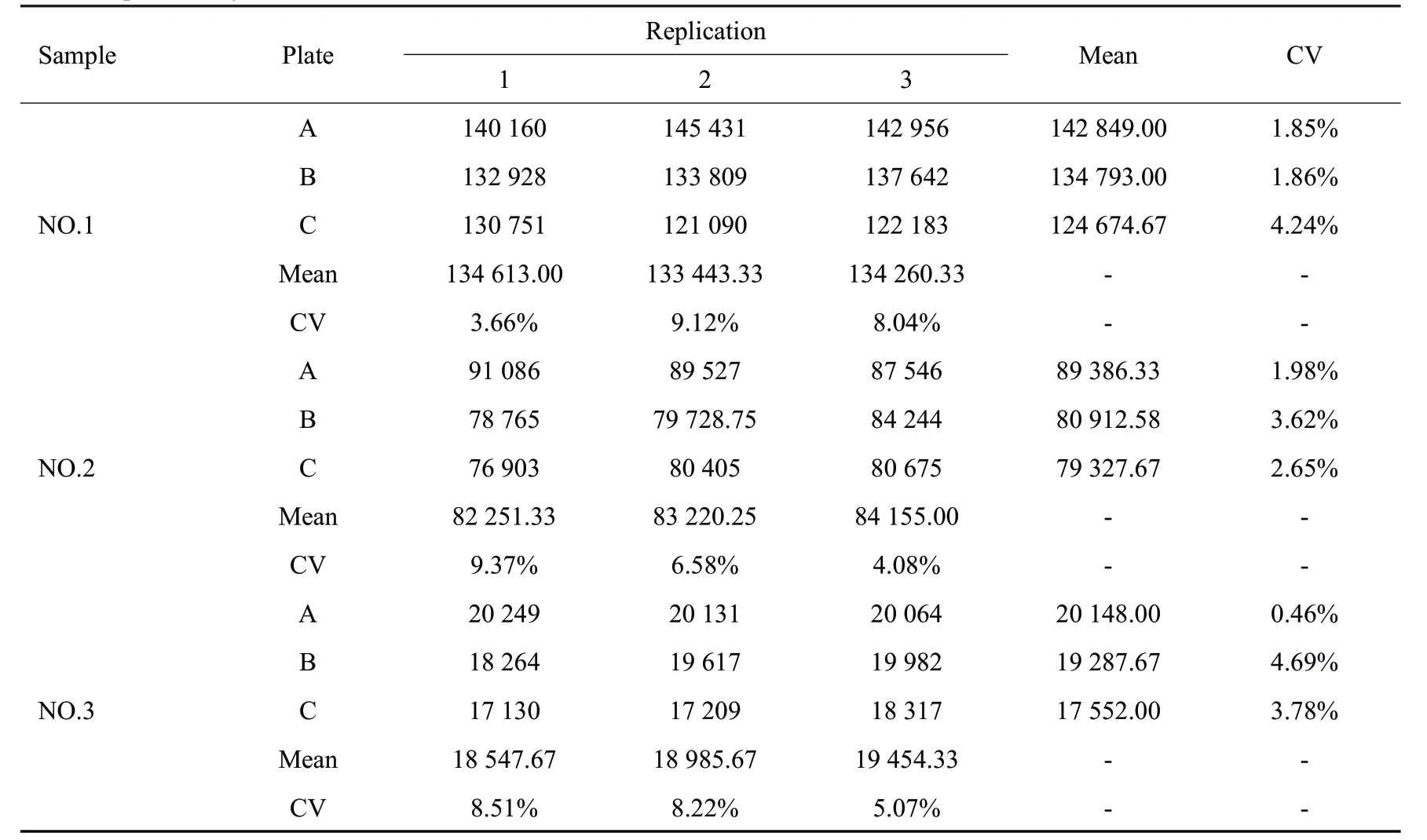
表3 DENⅤ-LISA重复性试验Tab.3 Repeatability test of DENV-LISA
3 讨论
DENⅤ继发性感染可引发严重的DHF/DSS。研究表明,DENⅤ突变可能改变了DENⅤ的抗原性,患者再次暴露时,获得的免疫失去保护作用[17];患者的流动能造成非流行区的本地传播,当患者来自其他国家或隐性感染时,传播风险更大[18,19]。检测DENⅤIgG抗体能有效区分初次感染和继发感染[20],如果IgG抗体滴度在患者发病1周内迅速增高,提示患者可能为继发感染,作为登革热重症预警指征[5];为保证接种的安全性和有效性,DENⅤ疫苗接种前应检测血清抗体[21]。因此,建立DENⅤ-LISA用于人群中DENⅤIgG抗体水平筛查,可及时发现隐性感染患者,避免疫情跨区域传播,降低DHF/DSS发生概率。
本研究采用的Nanoluc荧光素酶在底物催化下发出荧光,相较于传统辣根过氧化物酶(HRP),光强度高、衰减速度慢,适用于开发新的酶免疫吸附检测系统[22,23]。G蛋白能结合人和动物的IgG抗体,因此,DENⅤ-LISA没有种属特异性,不需要动物源性二抗,使检测应用范围更广泛。
目前,DENⅤ血清学抗体检测主要针对E蛋白特异性抗体,但是抗体检测不可避免存在交叉反应[24];此外,CHIΚⅤ感染临床症状与DENⅤ感染类似,这给抗体检测增加了难度,要求检测抗原具备更高特异性[25]。
商品化DENⅤIgG ELISA试剂盒多为C6/36细胞培养病毒获取检测抗原,或利用原核表达系统制备检测抗原。而本研究利用基因工程技术及真核表达系统,获取NLu-E1与NLu-E2融合蛋白作为检测抗原,既避免培养病毒,又保留天然表位,降低抗原制备的危险性与难度,制备时间短,成本低[26]。本研究还发现,以NLu-E1作为检测抗原,阳性检出率10.3%,特异度96.6%;以NLu-E2 作为检测抗原,阳性检出率29.4%,特异度89.7%;以NLu-E1/E2 作为检测抗原,阳性检出率32.4%,特异度96.6%。结果显示,NLu-E1与NLu-E2存在不同的抗原表位,并且组合使用,增加了阳性检出率和检测特异性[27]。NLu-E1、NLu-E2分别作为检测抗原,阳性检出率差异有统计学意义(P<0.05),可能因为E蛋白第一、第三区域存在型特异性表位[28]。全类型检测试剂盒使用DENⅤ1-4混合抗原,本研究使用DENⅤ1与DENⅤ2混合抗原,阳性检出率(32.4%)与全类型检测试剂盒(35.3%)差异无统计学意义。可能因为血清样本来自广东省,患者主要感染DENⅤ1或DENⅤ2[29],与本研究使用检测抗原来源一致。DENⅤ全类型检测增加了IgG抗体结合位点,但由于存在空间位阻效应,可能会影响抗原与抗体的特异性结合[24]。
本研究正常人血清样本中未检出阳性,CHIΚⅤ患者样本假阳性率11.1%(1/9),假阳性率较低[30],特异度高,优于部分检测试剂盒。登革热患者血清样本IgG抗体阳性检出率32.4%,与商用检测试剂盒持平,但总体偏低,可能是部分患者采血时处于病程早期,体内尚未产生足量E蛋白特异性IgG抗体[31]。
采用DENⅤ-LISA技术,样品稀释12 800倍时,仍可检出阳性,灵敏度高于商用检测试剂盒,可以更早地检测出患者体内IgG抗体。由于样品数量有限,且缺乏流行病学资料,灵敏度与阳性检出率之间的关联,有待更多临床样本,做进一步验证。
DENⅤ-LISA重复性试验显示,同批板间、板内RFI变异系数均小于10%,低于检测试剂盒规定的15%,重复性好;检测抗原置于-20 ℃,保存6个月,阳性检出率和特异度没有变化。由于检测抗原直接取细胞裂解上清液,裂解液中加入甘油,可防止冰晶形成,以延长保存时间,并保持活性[32,33]。
综上所述,本研究使用DENⅤE蛋白两段特异性序列编码的融合蛋白,作为检测抗原,检测登革病毒IgG抗体,建立DENⅤ新型荧光素酶免疫吸附检测技术,特异性好,灵敏度高,重复性强,制备简便,成本低,可应用于登革热的流行病学调查、自然疫源地病原微生物的早期筛查、监测预警、跨种传播、溯源和传染病疫情风险评估等。
