基于磁共振脂肪定量技术IDEAL-IQ的列线图模型在预测早期骨量丢失中的价值
2021-12-16成东亮冯红梅刘健萍洪居陆高明勇
成东亮,冯红梅,文 戈,刘健萍,洪居陆,高明勇
1佛山市第一人民医院影像科,广东 佛山 528000;2南方医科大学南方医院影像中心,广东 广州 510515
骨质疏松症是一种以骨量减少、骨密度减低,导致骨脆性增加、易发生骨折为特点的全身性疾病[1]。一项以双能X 线吸收测量法(DXA)测量骨密度(BMD)的大样本流行病调查显示我国50 岁以上人群中,男性和女性骨质疏松症患病率达6.46%和29.13%[2],即目前我国现有男性骨质疏松症患者超过1000 万,女性超过4000万。骨质疏松性骨折是骨质疏松最严重的后果,好发于脊柱、髋部等,具有很高的致残率和致死率。
骨密度和骨质量则是反映骨强度的两个重要因素。骨密度由骨内矿物质含量决定,DXA测定骨密度是评估骨强度、也是诊断骨质疏松的金标准[1]。但其测量的是面积密度,而非体积密度,并且受腰椎骨质增生、椎小关节退变及主动脉钙化的影响[3]。研究表明BMD只能反映60%~80%的骨强度变化情况,仅10%~44%的骨折发生在BMD达到骨质疏松症标准的人群[4],单用骨密度测定并不能综合评估骨强度的变化,从而使许多处于骨折高风险的患者失去早期干预的机会。骨质量包括骨的微观组织结构及分子水平变化,随着研究的深入,骨质量对于骨强度的影响越来越受到重视[5],如何定量评估骨质量是当前研究的热点。人体红骨髓和黄骨髓含量的动态变化与骨骼的重塑能力密切相关,随着年龄的增加,红骨髓逐渐萎缩,骨髓的脂肪化会干扰骨髓的微环境,抑制成骨细胞的生成,使得骨小梁变薄,残留的空间由大量的脂肪组织填充,从而导致骨骼的强度降低,这种骨髓脂肪的变化往往早于骨量的变化[6,7],并且可被MRI更早的显现出来。
骨质疏松性骨折常用的预测方法多种多样[8-10],大多依据临床常见的危险因素进行,如WHO推荐使用骨折风险预测工具(FRAX)预测个体未来10年内的骨折风险[8]。其纳入了患者的性别、年龄、身高、体质量及WHO推荐的7个骨折风险因子,鉴于实际运用的可操作性,可选择是否加入BMD。影像学检查能够更为客观的提供骨质疏松依据,而骨髓脂肪含量(FF)作为骨质量的新指标,可以弥补单纯BMD评估骨强度的不足,是目前骨质疏松诊断研究的热门话题[11,12],但目前尚未见将骨髓脂肪含量等反应骨强度的指标纳入的骨质疏松风险预测模型。因此,本研究拟结合MRI迭代最小二乘法水脂分离定量技术(IDEAL-IQ)以及患者的临床指标如年龄、性别、身高、体质量、体重指数(BMI)等,以期建立联合影像和临床资料、更为全面的骨质疏松风险评估工具。
1 资料和方法
1.1 基本临床资料
收集本院2019 年1 月~2020 年6 月同时行腰椎DXA 及MRI IDEAL-IQ 序列检查的志愿者和患者共59例;均行DXA腰椎骨质密度BMD测量,根据最新WHO标准及骨质疏松症诊疗指南分为2组:BMD低于同性别、同种族正常成人的骨峰值<1.0个标准差为骨质骨量正常组,共36例;BMD降低1.0~2.5个标准差为低骨量组,共23例。排除既往腰椎骨折、有内分泌疾病、代谢性疾病及恶性肿瘤患者,长期卧床史,常年服用激素或其他各种影响骨代谢药物者;本研究经医院伦理委员会批准,患者均签署知情同意书。
1.2 检查方法
采用GE Discovery 750 w 3.0 T MRI 扫描仪,8 通道相控阵线圈,行腰椎矢状面T1WI、T2WI 和IDEALIQ 扫描,矢状面以L3椎体为中心。矢状面IDEAL-IQ扫描参数:翻转角3°,重复时间6.5 ms,回波时间3.0 ms,层厚7 mm,扫描视野35 cm×35 cm,矩阵160×160,激励次数为3,扫描时间121s。DXA扫描采用腰椎正位影像平直位于报告中央,范围自T12 椎体下缘至L5 椎体上缘,各椎体ROI的标记线均与椎体骨结构边缘相一致,测量L1~4 各椎体对应的T 值。
1.3 图像分析及测量
经IDEAL IQ扫描后,将获得腰椎FF 图、R2*弛豫率图、水像、脂肪像4 组图像,由于FF图最能代表脂肪含量,在GE ADW 4.6 工作站上分别选择IDEAL-IQ的FF 图,在Functool软件的Ⅴiewer模块正中矢状位图上勾画长方形感兴趣区,并避开骨皮质,测量L1~4椎体的FF,测量3次并取平均值。
1.4 统计学方法
采用SPSS22.0软件及R软件进行数据分析。计量资料以均数±标准差表示,计数资料以例数表示,计数资料比较采用两样本t检验,计量资料的比较采用卡方检验,P<0.05为差异有统计学意义;应用受试者工作特征曲线(ROC)分析确定FF值鉴别低骨量组和骨量正常组的最佳阈值及其对应的敏感度、特异度和曲线下面积(AUC)。将FF值与年龄、性别、身高、体质量及BMI指数纳入多因素logistics回归分析,筛选出独立预测因素并构建回归模型,使用R语言中“rms”包构建早期骨量丢失预测风险的列线图,通过ROC曲线和校正曲线来评估模型的预测效能、模型预测与实际预测情况的一致性。决策曲线分析(DCA)比较不同模型的获益情况。
2 结果
骨量正常组及低骨量组年龄分别为35.17±12.95岁、51.96±10.13岁,差异有统计学意义(P<0.001);2组椎体FF值分别为(38.84±6.75)%、(51.96±7.65)%,组间比较差异有统计学意义(P<0.01);经ROC分析,椎体FF值鉴别骨量正常组和低骨量组的AUC为0.797(图1、2),以46.85%为阈值,敏感度、特异度分别为73.91%、80.56%。经多因素logistics回归分析两组间FF值、年龄以及BMI指数是预测骨量丢失的独立因素(表1)。建立的联合预测模型为logit(p)=0.2576×FF+0.144×年龄-0.4076×BMI-10.8082,通过列线图将模型进行可视化(图3),线上给出相应的分数,将每个变量的分数相加计算总分,然后将总分投影到总分风险标度轴上来预测骨量丢失的可能性,此诊断模型的ROC 曲线(图4),AUC为0.954(95%CI:0.806~0.957)。校正曲线显示预测概率与实际概率关系的校准图(图5),预测的可靠性高。列线图模型经Boostrap法行1 000次内部抽样验证后,得到模型的预测值与实际观察值趋近于45°斜线,说明该模型的校准度较好。DCA分析(图6)结果表明列线图模型相较于单一的FF值,能够取得更大的净获益。
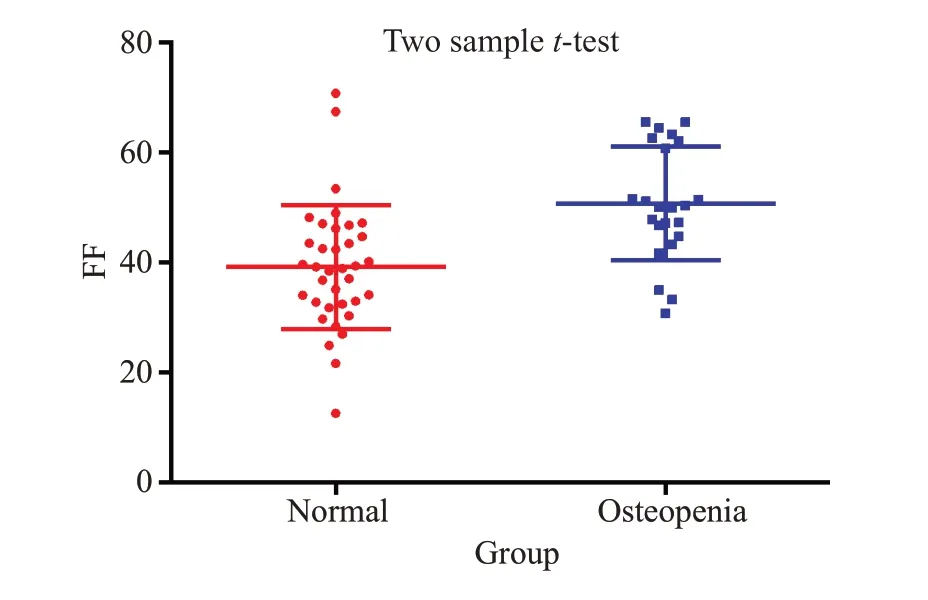
图1 骨量正常组、低骨量组间的FF 值比较,差异有统计学意义Fig.1 Comparison of FF values between normal bone mass group and osteopenia group(P<0.01).
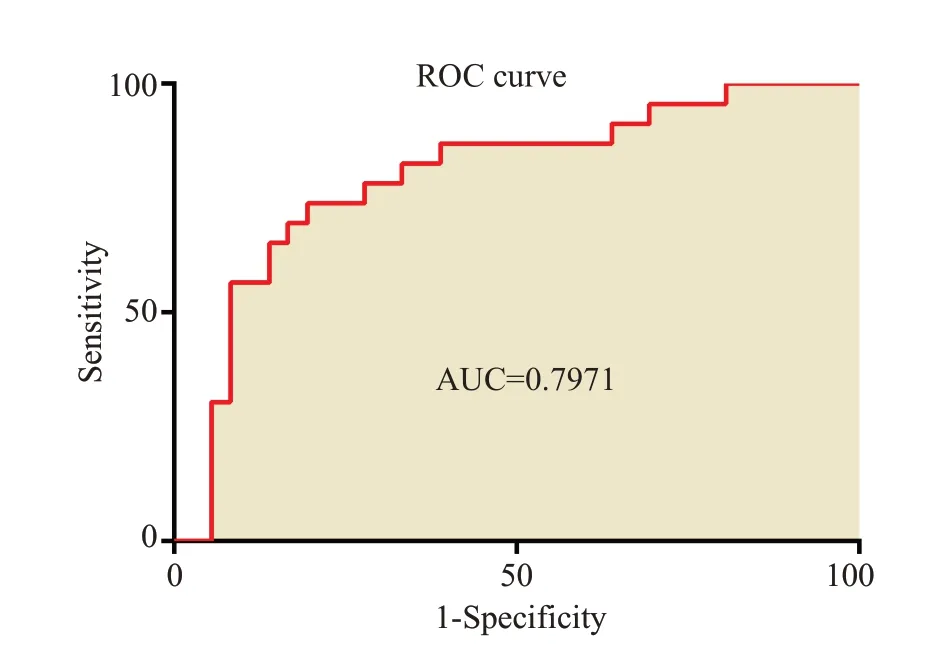
图2 FF值诊断低骨量的ROC曲线Fig.2 ROC curve for FF value-based diagnosis of low bone mass(theAUC is 0.7971).
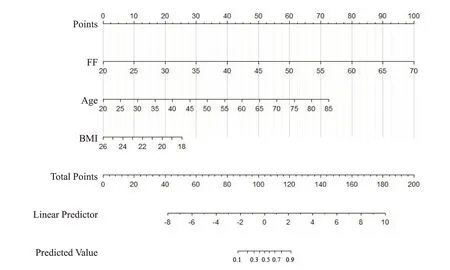
图3 联合IDEAL IQ以及年龄、BMI构建的列线图模型Fig.3 A nomogram model combining the FF value,age and BMI.

图4 列线图模型的受试者操作特征曲线Fig.4 ROC curve analysis shows that the AUC of the nomogram model is 0.958.

图5 列线图预测模型内部验证的校准曲线Fig.5 Calibration curve of the nomogram model verified by internal validation.
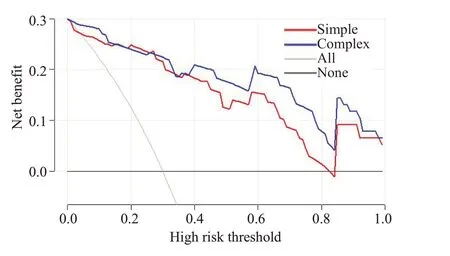
图6 DCA曲线示联合FF、年龄及BMI的列线图模型相较于仅根据FF值的单一模型能获得更大的净受益率Fig.6 Decision curve analysis shows that the nomogram prediction model can achieve more net benefits than the FF value alone.

表1 多因素Logistic回归分析结果Tab.1 Result of multivariate logistic regression analysis
3 讨论
骨质疏松性骨折是骨质疏松最严重的结局,研究表明一旦发生髋部骨折,患者死亡风险增加两倍以上,而且在未来一年中的死亡率达到8.4~36%[13,14]。而影响骨折风险的因素很多,早期识别骨折风险、早期干预是骨质疏松防治的重要手段,可以减少未来1~2年内三分之一的骨折发生[15]。
骨质疏松症发病隐匿,后果严重,仅依靠骨密度已不能满足临床及筛查需求,而且单纯根据骨密度来预测骨折风险并不准确。越来越多的研究发现[16,17]骨微观组织结构及分子水平的变化与骨强度密切相关,Schwartz等[18]研究表明老年人中脊柱骨髓脂肪较高与脊柱骨折明显相关,骨髓中脂肪含量的增加削弱了骨质强度,增加了骨质疏松性骨折的风险。而Justesen 等[19]通过对人体髂骨进行病理活检,发现年龄大者及骨质疏松患者的骨髓脂肪含量明显增高。磁共振波谱成像作为目前公认的测定活体内某一特定组织化学成分的唯一的无创技术,也证实了这一点[20]。但MRS由于其体素太小无法覆盖大面积范围以及采集时间长,后处理复杂等原因限制了其使用。
IDEAL IQ技术是在Dixon 基础之上改良的新的序列,一次扫描覆盖多个椎体可得到水像、脂像、脂肪百分数图像和R2*弛豫图像、正相位以及反相位等六幅图像,能实现对人体多个部位脂肪含量快速、准确、可重复测量。本课题组[21]前期通过IDEAL-IQ技术研究发现随着年龄增加,BMD逐渐减少,椎体FF逐渐增加,并且不同椎体间BMD、FF值以及R2*不存在统计学差异,与Martin及Justesen等[19,22]研究结果一致,表明脂肪含量的增加会影响骨强度。本研究结果显示椎体FF值在骨量正常组、低骨量组中差异显著,考虑可能脂肪含量的增加会抑制成骨细胞的活动,从而导致骨质量的变化;国内王开香等[23]研究结果显示骨量减少组与骨量正常组之间的差异没有统计学意义,考虑可能与其研究中病例数较少且患者年龄总体偏大有关。经ROC 曲线分析,选取46.85%作为区分骨量正常组、低骨量组的阈值,可以获得较高的灵敏度和特异性,表明IDEAL-IQ有助于评价腰椎椎体脂肪含量,FF值对预测骨质疏松具有一定价值,有助于临床医生提早干预,控制骨质疏松程度。
骨质疏松的影响因素众多,国外使用BMD及常见的骨折危险因素开发了许多预测模型[8-10,24]。但适用条件不同以及模型的复杂程度不一,模型各有利弊,部分模型评估工具有将影像学检查如骨小梁评分、定量CT等纳入,也有无需借助影像学的。FRAX模型是WHO以及国内原发性骨质疏松症诊疗指南[25]推荐用于评估骨质疏松的诊断和治疗的工具。其需要患者的性别、年龄、身高、体质量及WHO 推荐的7 个骨折风险因子,最后根据情况可选择是否加入股骨颈BMD值。尽管其提供了在不引入BMD的情况,但Fraser以及Gadam等研究[26,27]均表明,在不引入BMD的情况下,FRAX值会低估骨质疏松风险,FRAX联合BMD能更好识别出高骨质疏松群体,从而进行早期干预。影像学检查能够更为客观的提供骨质疏松依据,为脆性骨折的预防、减少骨折发生提供参考。而磁共振IDEAL-IQ技术能够定量反映椎体脂肪含量,从骨质量层面反映骨强度,为预测骨质疏松性椎体骨折提供了一种新的方法,本课题组前期结果也表明FF与身高、体质量、BMI呈负相关,表明矮瘦体型、低体重指数是骨质疏松的危险因素,与既往研究一致[8,28]。
列线图广泛应用于疾病的鉴别诊断和预后评估,包括骨质疏松的预测中,其可预测临床结局或者某类事件发生的概率,并且其能够将统计预测模型简化为针对单个病例单个事件的概率估计,并将其结果可视化,可帮助临床医生根据模型预测的结果制定临床决策[27,29]。尽管骨髓的脂肪含量在一定程度上反映骨强度,但目前WHO以及临床推荐使用的骨质疏松预测工具均仅考虑BMD,尚未见将椎体脂肪含量等反映骨强度的指标纳入的临床模型。本研究结果联合IDEAL IQ、年龄以及BMI 三个独立危险因素构建联合的列线图模型,经ROC曲线分析,AUC值达0.954,并且经内部验证结果显示模型具有良好的预测准确性和区分度,并且联合模型较单纯IDEAL IQ模型具有更高的预测效能,表明IDEAL IQ联合模型在预测早期骨量丢失中具有良好的应用前景。
本研究不足之处:研究纳入的病例偏少,并且年龄跨度大,存在选择偏差;骨质疏松危险因素很多,生活习惯、药物及使用和生化指标等[27,30]对于骨质疏松的评估均有一定的价值,本研究模型评估中仅仅针对FF值以及年龄、BMI构建模型,更为严谨、贴切临床的风险预测工具仍需要更大样本、更为全面的研究数据;IDEAL IQ属于临床新项目,在骨关节系统目前仅用于科研,病例数有限,模型没有进行外部验证。
综上所述,IDEAL IQ能够反映骨髓的脂肪化程度,可从骨质量上评价骨强度,能有效补充单独使用BMD的不足,是一种可行性强、无创性评估骨质疏松程度的影像学检查方法。本研究联合IDEALIQ以及年龄、BMI建立了联合影像与临床风险指标的骨质疏松风险评估模型,可直观地量化发生骨量丢失的风险,并且具备良好的预测能力。临床上可根据列线图个体化的预测个体骨质疏松的发生概率,筛查高风险人群,提前制定针对性的预防措施,对于预防骨质疏松具有重要的临床价值。
