高甘油三酯-葡萄糖乘积指数是慢性肾脏病发生的独立危险因素:基于3439例40~75岁人群的前瞻性队列研究
2021-12-16许晓双汤旭磊车红霞关聪会傅松波刘丽娟郭梦然甄东户
许晓双,汤旭磊,车红霞,关聪会,赵 楠,傅松波,刘丽娟,叶 月,郭梦然,闵 行,甄东户
兰州大学1第一临床医学院,2第一医院内分泌科,甘肃 兰州 730099;3甘肃省第三人民医院内分泌科,甘肃 兰州 730000
慢性肾脏病(CΚD)是全世界范围内日益严重的公共卫生问题,指各种原因引起的肾脏结构或功能异常≥3个月[1]。CΚD的进展常会导致严重的不良预后,包括发展为终末期肾脏病,增加罹患心血管疾病和其他相关并发症的风险等[2-5],因此,CΚD的早期诊断和干预对于降低与CΚD相关的心血管事件、肾衰竭及死亡的风险至关重要[6]。
胰岛素抵抗(IR)不仅会增加2型糖尿病、代谢综合征、心血管疾病的患病风险[7],也与CΚD的发生风险增加相关,是CΚD的独立危险因素[8]。高胰岛素-正葡萄糖钳夹技术是评价IR的金标准,但由于程序复杂、费用昂贵,该技术的临床适用性相当有限[9]。因此,临床上提出了一些经济简便的IR替代指标,包括甘油三酯-葡萄糖乘积(TyG)指数和甘油三酯/高密度脂蛋白胆固醇(TG/HDL-C)等,TyG指数是通过空腹甘油三酯与葡萄糖乘积计算得出,由于受体内脂肪分布的影响相对较小,TyG 指数对IR 预测能力明显优于TG/HDL-C[10]。先前的研究证明,TyG指数可作为预测代谢综合征[11]、2型糖尿病[12]和心血管疾病[13]发生发展的重要指标,日本一项队列研究提出,TyG指数升高可能会增加CΚD发病的风险[14],但目前国内没有队列研究报道TyG指数与CΚD发生风险之间的关系。因此,本研究采用整群随机抽样的方法,对兰州市40~75岁的常住居民5223人进行随访调查,探索兰州市人群中TyG指数与CΚD之间的关联,分析TyG指数与CΚD发生风险之间的相关性,以期为CΚD的早期预防和识别提供科学依据。
1 资料和方法
1.1 研究对象
本研究于2011年5月~2011年9月采用整群随机抽样方法对兰州市西村街道社区、天庆嘉园社区和广武门社区40~75岁的常住居民进行流行病学调查,纳入基线人群共5223例(1469名男性和3754名女性),进行问卷调查、体格检查及实验室指标的采集,排除肾功能不全(n=1350)及血尿样本不足(n=5)的人群后,共纳入3868人建立了队列研究人群,后续于2014年6月~2015年8月进行了平均3.1年的随访,采集受试者随访后肾功能相关指标(包括血肌酐、尿白蛋白以及尿肌酐水平),排除随访资料缺失(n=429)的人群后,共纳入3439人,其中男性1039人,女性2400人。本研究经兰州大学第一医院伦理委员会批准。
1.2 一般资料及生化指标检测
调查问卷包括个人基本信息(姓名、性别、年龄、民族、籍贯)、饮食习惯、生活方式和行为(如吸烟、饮酒、饮茶和体力活动情况)、自我报告的个人病史(如高血压、高血脂、糖尿病和肿瘤病史)和糖尿病(DM)家族史、文化程度的详细信息。由专业人员采用统一的标准测定所有研究对象的身高、体质量、腰围等指标,并计算体质量指数(BMI)。
采集受检者的静脉全血,全自动生化分析仪检测空腹血糖(FPG)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、25-羟维生素D3[25-(OH)D3]、血肌酐(SCr)等指标,并计算TG/HDL-C、TyG 指数。采集受检者的清晨中段尿标本,全自动生化分析仪检测尿白蛋白(ALB)、尿肌酐(Cr),并计算尿白蛋白/肌酐比值(UACR)、估算肾小球滤过率(eGFR)。
1.3 相关参数的计算
(1)BMI=体质量(kg)/身高(m)2;(2)TyG指数=Ln[TG(mg/dL)×FPG(mg/dL)/2][10];(3)eGFR=186×(SCr×0.011)-1.154×(年龄)-0.203×(0.742 女性)mL/min/1.73 m2,SCr(mg/dL),年龄(岁)[15]。
1.4 蛋白尿、异常eGFR和CΚD的定义
(1)蛋白尿定义为UACR≥30 mg/g[16];(2)异常eGFR定义为eGFR<60 mL/min/1.73 m2;(3)采用ΚDIGO 指南的标准来进行CΚD的诊断:肾脏结构或功能异常持续3个月以上,即可诊断为慢性肾脏病。包括以下任意一项或多项:(1)GFR<60 mL/min/1.73 m2;(2)蛋白尿(尿白蛋白≥30 mg/24 h 或UACR≥30 mg/g);(3)尿沉渣、组织学或影像学异常提示肾脏损害;(4)肾小管相关疾病;(5)肾移植病史[17]。
1.5 数据分析
采用SPSS 23.0软件进行统计学分析,由于偏态分布,所有计量资料都用M(QL,QU)]来表示,多组间差异比较用Κruskal-WallisH检验,两组间比较采用Mann-Whitney检验。计数资料以n(%)表示,采用χ2检验。多因素Logistic回归分析TyG指数与蛋白尿、异常eGFR和CΚD发生风险的关系。P<0.01或P<0.05为差异有统计学意义。
1.6 流程图(图1)
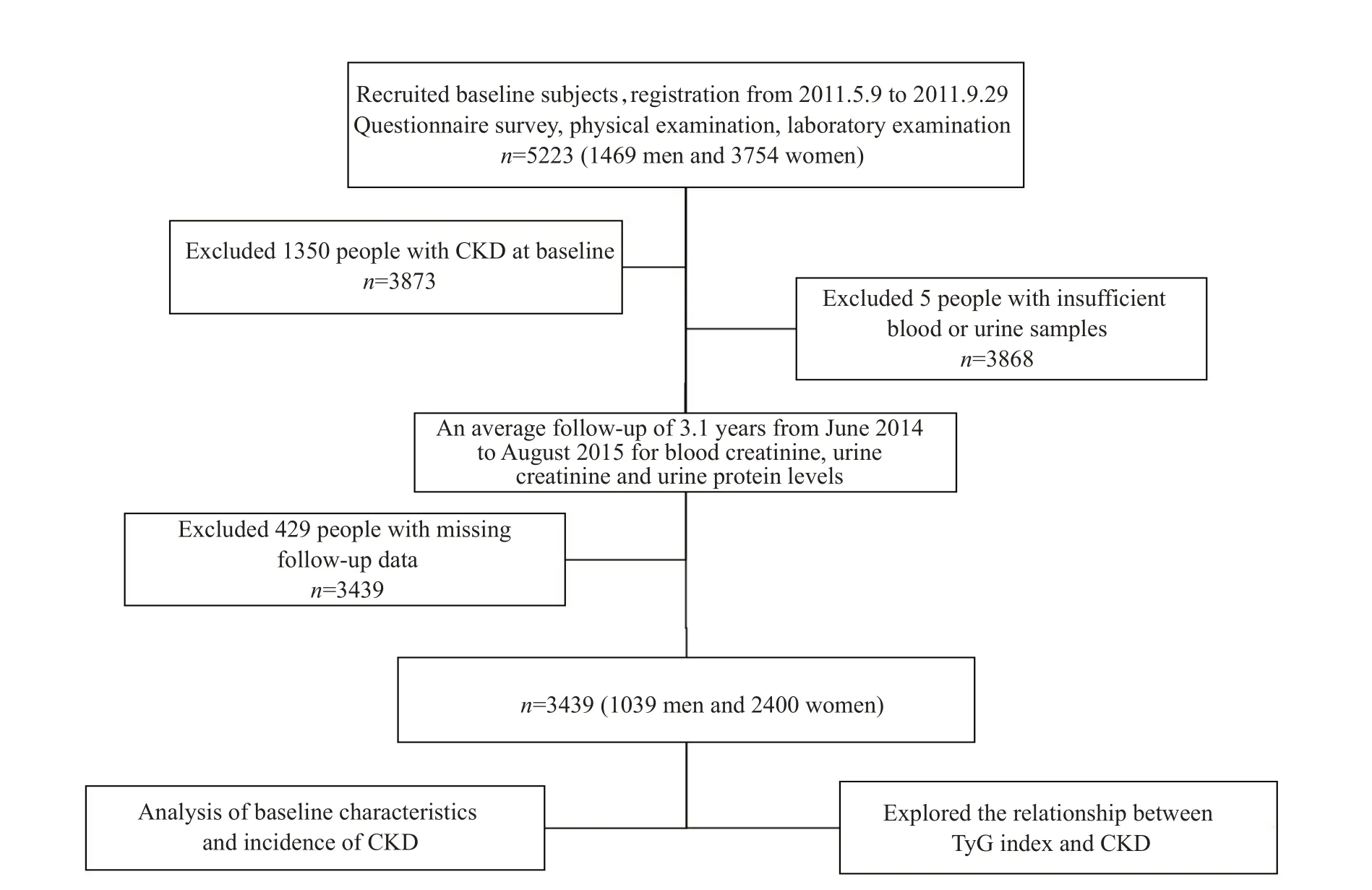
图1 流程图Fig.1 Flow chart of the study.
2 结果
2.1 根据TyG指数四分位数分组的研究人群的基线特征
与低TyG四分位数的参与者相比,高TyG四分位数组中男性、低文化程度、有吸烟史、慢性病病史(糖尿病史、高血压病史、高血脂病史)及糖尿病家族史的人群比例更高(P均<0.01);随着TyG 指数四分位数增加,FPG、HbA1C、LDL-C、TC、TG、BMI、TG/HDL-C水平升高(P均<0.01),HDL-C、eGFR降低(P均<0.01),高TyG四分位数组的UACR水平较低TyG四分位数组高(P<0.01),四组间饮酒史、饮茶史、体力活动、肿瘤病史及25-(OH)D3水平无统计学差异(表1)。
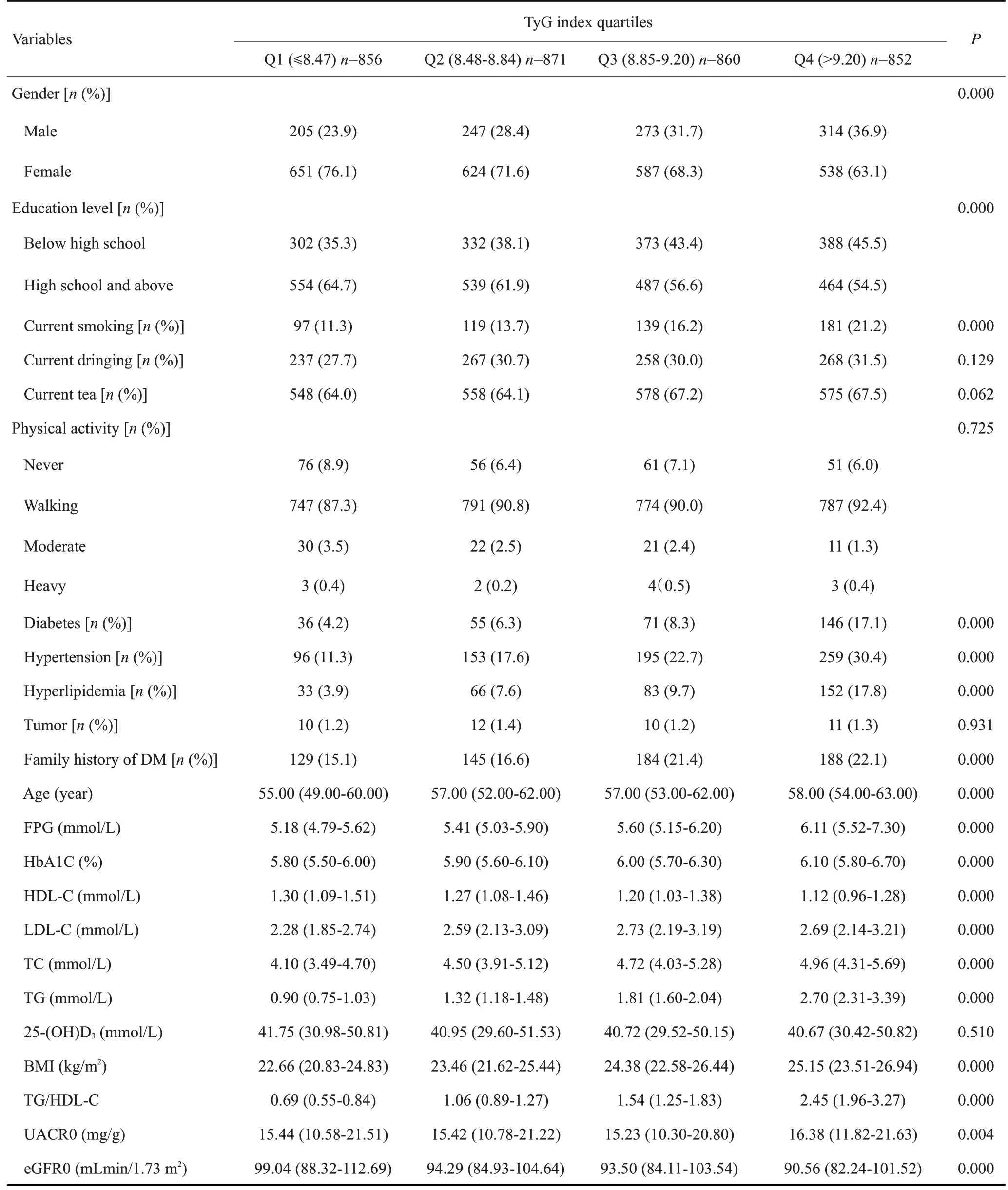
表1 研究人群的基线特征Tab.1 Baseline characteristics of the study population
2.2 基线临床及人口学指标与TyG指数的相关性分析
对基线临床及人口学指标与TyG 指数进行Spearman相关性分析显示:在基线人群中,年龄、FPG、HbA1C、LDL-C、TC、TG、BMI、TG/HDL-C与TyG指数呈正相关(均P<0.05),其中TG/HDL-C与TyG指数相关性最强,r值为0.876;而HDL-C与TyG指数呈负相关(P<0.05)。在基线肾功能正常的人群中,UACR水平与TyG指数呈正相关(P<0.05,r=0.036),而eGFR与TyG指数呈负相关(P<0.05,r=-0.193,表2)。

表2 基线临床及人口学指标与TyG指数的相关性Tab.2 Correlation of baseline clinical and demographic factors with TyG index
2.3 随访后4组间蛋白尿、异常eGFR和CΚD发生率的比较
在整个研究人群中,蛋白尿发生率为186 人(5.4%),其中男性53人(5.1%),女性133人(5.5%);异常eGFR发生率为60人(1.7%),其中男性26人(2.5%),女性34人(1.4%);CΚD发生率为238人(6.9%),其中男性77人(7.4%),女性161人(6.7%)。随着TyG指数四分位数升高,研究人群中蛋白尿、异常eGFR及CΚD的发生率均依次显著增加(P均<0.05)。根据性别分组后进行分析,仍表现出相同的趋势(P<均0.05,图2)。

图2 4组间蛋白尿、异常eGFR和CΚD发生率比较Fig.2 Comparison of the incidences of proteinuria(A),abnormal eGFR(B)and CKD(C)among the 4 groups.
2.4 随访后CΚD与非CΚD组人群的基线特征
与非CΚD组相比,随访后发生CΚD的人往往高龄,文化程度更低,更容易患糖尿病、高血压,并且CΚD组的FPG、HbA1C、BMI、TG/HDL-C 及TyG 指数水平更高(P<0.01),但有饮酒史的比例及HDL-C水平更低(P<0.01或P<0.05),两组间LDL-C、TC、TG、25(OH)D3、性别、吸烟史、饮茶史、体力活动、高血脂病史、肿瘤病史及糖尿病家族史无统计学差异(表3)。

表3 随访后CΚD组与非CΚD组人群的基线特征Tab.3 Baseline characteristics of individuals who developed CKD and those with without CKD during the follow-up
2.5 蛋白尿、异常eGFR 和CΚD 发生风险的多因素Logistic回归分析
以蛋白尿、异常eGFR和CΚD为因变量,以TyG指数、性别(男=0,女=1)、年龄、文化程度、吸烟史、高血压、糖尿病家族史、HbA1C、HDL-C、LDL-C、TC、25(OH)D3、BMI、TG/HDL-C为自变量,分别行多因素Logistic回归分析显示,HbA1C升高、BMI升高、25(OH)D3升高、高龄、高血压病史是蛋白尿发生的独立危险因素(P均<0.05),但TyG指数升高不是蛋白尿发生的危险因素;TyG指数升高(OR=3.533,95%CI:1.304~9.569,P<0.05)、高龄、高血压病史是异常eGFR发生的独立危险因素(P均<0.05);TyG指数升高(OR=1.844,95%CI:1.124~3.026,P<0.05)、BMI升高、高龄、高血压病史是CΚD发生的独立危险因素(P<0.05),而LDL-C水平升高是CΚD发生的独立保护因素(P<0.05,表4,5)。
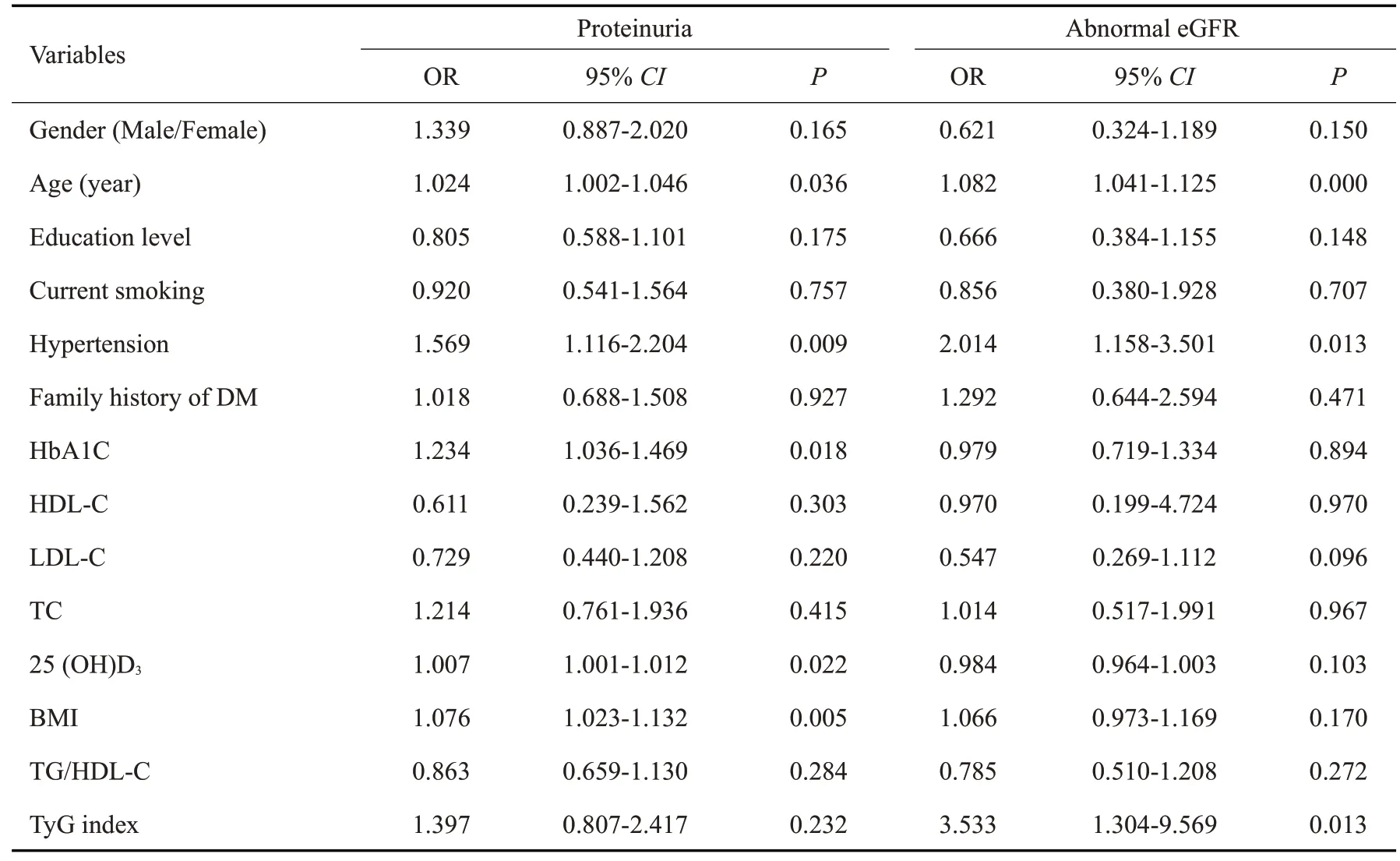
表4 蛋白尿、异常eGFR发生风险的多因素Logistic回归分析Tab.4 Multivariate logistic regression analysis of proteinuria and abnormal eGFR risk
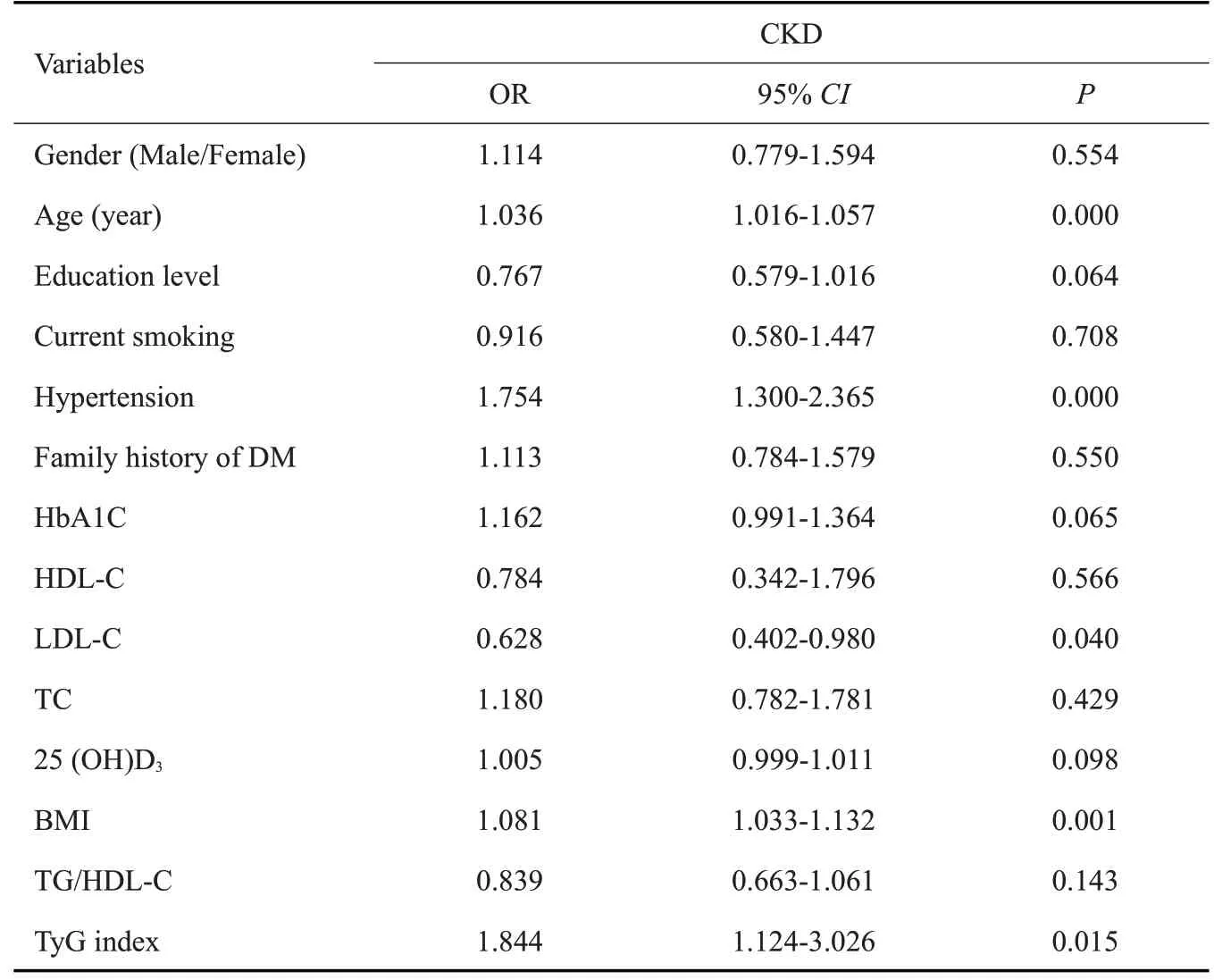
表5 CΚD发生风险的多因素Logistic回归分析Tab.5 Multivariate logistic regression analysis of CKD risk
2.6 TyG指数与CΚD的相关性
根据TyG指数四分位数分层,采用COX比例风险模型回归分析TyG指数与CΚD之间的相关性。结果显示,在未调整混杂因素时,TyG指数升高与CΚD的发病风险存在显著相关性,与第1 四分位数组相比,第2(OR=1.826,95%CI:1.179~2.830)、3(OR=2.137,95%CI:1.393~3.280)、4(OR=2.924,95%CI:1.945~4.395)四分位数组发生CΚD的风险均显著增加(P均<0.05),其中最高TyG四分位数组人群发生CΚD的风险最高,为第1四分位数组的2.924倍;在进一步调整了性别、年龄后,上述相关性仍显著存在(P均<0.05);在上述基础上调整文化程度、吸烟史、高血压及糖尿病家族史,结果显示高TyG指数仍然是CΚD发生的独立风险因素(P均<0.05);进一步调整HbA1C,HDL-C,LDL-C,TC,25(OH)D3,BMI and TG/HDL-C 后发现,随着TyG 指数的升高,CΚD发生风险仍显著增加(P均<0.05),与第1四分位数组相比,第4四分位数组人群发生CΚD的风险最高,为第1四分位数组的1.815倍(OR=1.815,95%CI:1.059~3.112)(表6)。
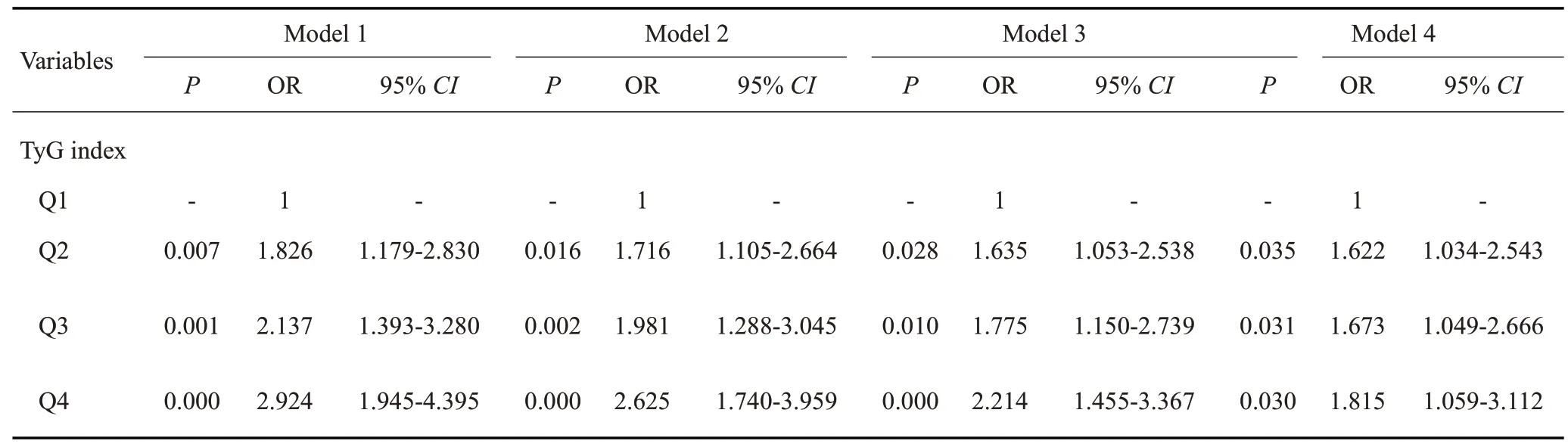
表6 TyG指数与CΚD的相关性Tab.6 Correlation between TyG index and CKD in this cohort
3 讨论
在这项基于人群的前瞻性队列研究中,我们首次调查了兰州市不同TyG指数的人群蛋白尿、异常eGFR和CΚD的发生率。结果显示,高TyG指数人群蛋白尿、异常eGFR及CΚD的发病率较高,尤其是TyG指数>9.2的人群,其蛋白尿发病率(7.4%)、异常eGFR 发病率(3.3%)和CΚD发病率(10.3%)最高。同时,本研究发现,TyG 指数与异常eGFR 和CΚD 的发生呈正相关,TyG指数升高是中老年人群肾功能下降及CΚD发生的独立危险因素。
CΚD是一种不可逆且缓慢进展的非传染性疾病,约占全球人口的10%~13%,在中国成年人中的患病率为10.8%[18,19]。近年来中国CΚD的发病率逐渐上升,在山东省千佛山医院的一项前瞻性队列研究中,成年人CΚD的发病率约为4.0%[20],相较于本研究结果,我们发现兰州地区人群CΚD发病率更高。究其原因认为,我们的研究对象为40~75 岁的中老年人,高龄会增加CΚD的发病风险,这是CΚD发病率高的重要原因[21]。本研究也发现,CΚD人群的年龄明显高于非CΚD人群,回归分析显示,年龄每增加1岁,CΚD的风险增加3.6%。
肥胖是CΚD发生发展的重要危险因素,近年来,肥胖已成为全球范围内重要的公共卫生问题,截至2016年,全球超重和肥胖患者的比例已达39%[22]。研究显示,肥胖可能通过增加尿蛋白的排泄导致肾功能受损[23],本研究发现,BMI升高是蛋白尿和CΚD发生的独立危险因素,BMI每升高1 kg/m2,蛋白尿和CΚD的发生风险分别增加7.6%、8.1%,但BMI升高对肾小球滤过率的变化影响不大。无论如何,肥胖对CΚD的潜在影响意义重大。高血压是CΚD发生的另一重要危险因素[24],长期高血压会损害肾脏结构和功能,增加CΚD的发生风险[25]。本研究中,与非高血压人群相比,高血压患者发生蛋白尿、eGFR 异常和CΚD 的风险分别增加56.9%、101.4%、75.4%,高血压是CΚD发生的独立危险因素。
由于起病隐匿,CΚD在疾病进展前多不表现出典型的临床症状,并且缺乏具有敏感性和特异性的生物标志物,早期诊断和治疗相对比较困难[26]。IR是老年人肾功能下降的独立危险因素[8],并且在CΚD 早期就已存在[27]。TyG指数作为IR的简单高效的替代指标,被广泛用于流行病学研究[11],有研究发现TyG 水平与CΚD之间存在关联。日本一项纳入11712例受试人群的队列研究发现,TyG指数每升高1个单位,男性发生CΚD 的风险增加32%,女性发生CΚD 的风险增加50%,但该研究的受试对象均为日本人,且该研究未将病理性蛋白尿纳入CΚD的诊断标准[14]。据我们所知,目前尚无前瞻性研究报道中国人群TyG指数与CΚD发病之间的关系,也很少有研究探讨TyG指数与UACR、eGFR之间的关系。因此,我们的研究将TyG指数作为衡量IR 的指标。首先,通过在基线人群中比较不同TyG四分位数的各组中UACR和eGFR水平发现,尽管在肾功能正常的情况下,高TyG指数的人群UACR水平明显升高,eGFR水平明显下降,尤其是TyG指数>9.20的人群,他们的UACR水平最高,eGFR水平最低,通过进一步相关性分析发现,TyG指数与UACR呈正相关,而与eGFR呈负相关;其次,在经过平均3.1年的随访后发现,进展为CΚD的患者TyG指数明显高于非CΚD人群,说明TyG指数与CΚD之间存在关联。
IR可通过以下几个方面影响CΚD的发病。首先,高胰岛素血症本身可以通过诱导肾小球高滤过、损害内皮功能、增加血管通透性等方面增加尿蛋白的排泄[28]。本研究中,高TyG 指数的人群eGFR 低,UACR 水平高。其次,代谢综合征及其组成疾病(包括高血压、血脂异常、糖调节受损和肥胖等)的发病均与IR相关[29]。本研究发现,TyG指数水平的升高与糖尿病、高血压、高血脂的患病率以及BMI 水平的增加相关联,这与先前的研究结果一致。而代谢综合征是CΚD的重要致病因素[30-33],在我们的研究中,与随访后未发生CΚD的人群相比,CΚD 患者多有高血压、高血脂及糖尿病病史,BMI水平也相对较高。第三,高胰岛素血症会增加组织中活性氧的产生,诱导氧化应激反应[30],使肾脏组织纤维化,同时促进炎症反应发生[31]。第四,高血糖导致的代谢性酸中毒能够刺激内皮素-1和醛固酮的过量分泌,并促进肾小管间质的损伤,参与CΚD的发生发展[34]。总之,高胰岛素血症和IR所致的代谢综合征、氧化应激、慢性炎症、代谢性酸中毒等均在CΚD的发病过程中发挥着至关重要的作用。
我们的研究发现,无论是在总人群中还是按照性别分组后,高TyG指数的人群蛋白尿、异常eGFR和CΚD的发病率均明显升高,这说明TyG指数与CΚD之间存在关联。一项纳入524例2型糖尿病患者的横断面研究发现,TyG指数是蛋白尿发生发展的独立危险因素[35],这与河南郑州的一项病例对照研究[36]一致,该研究表明,TyG指数可以预测2型糖尿病患者糖尿病肾病的发生,但上述研究并未考虑TyG指数在非糖尿病人群肾功能变化中的作用。另一项纳入了上海北部城市社区2830名老年人的研究发现,相较于TyG 指数水平在7.04~8.36的人群,TyG指数在9.08~11.63的人群患微量蛋白尿的风险增加61%,患CΚD的风险增加67%[37]。在本研究中,TyG指数的升高与肾功能的下降及CΚD的发生显著相关,在控制变量后发现,TyG指数每升高1个单位,研究人群发生eGFR异常的风险增加2.533倍,发生CΚD的风险增加84.4%。依据TyG指数四分位数分组后进行生存分析,得出同样的结论:与TyG指数≤8.47的人群相比,TyG指数升高显著增加CΚD的发病风险,其中TyG指数在9.20以上的人患CΚD的风险为TyG指数≤8.47人群的1.815倍。但本研究结果显示,TyG指数与蛋白尿的发生不存在显著相关性,出现这一结果的原因可能是由于本研究样本量的限制以及多种控制变量的影响,因此,未来需要更多更大样本量的研究来证实TyG指数与蛋白尿之间的关系。
综上所述,本研究证实了TyG 指数>9.20 的人群CΚD发病率较高,TyG指数与CΚD的发生密切相关,高水平的TyG 指数是CΚD 发生发展的独立危险因素,TyG指数可作为预测CΚD发生的一个新型且简单实用的生物学指标。对于患有高血压、肥胖的中老年人群,应及早进行TyG指数的监测,尽早识别肾脏损害,积极干预,预防CΚD的发生和改善预后。
