谷子SBP 转录因子家族基因的表达分析
2021-12-16杜晓芬韩康妮李禹欣王智兰连世超
杜晓芬,韩康妮,李禹欣,王智兰,连世超,王 军
(山西农业大学谷子研究所,杂粮种质创新与分子育种山西省重点实验室,杂粮种质资源发掘与遗传改良山西省重点实验室,山西长治 046011)
SBP(Squamosa promoter binding protein)转录因子是植物中一类重要的转录因子,又被命名为SPL(Squamosa promoter binding protein like),最早从金鱼草中鉴定出来,因其能够特异识别和结合花分生组织特征基因SQUAMOSA(SQUA)的启动子区而得名[1]。该基因家族由多个成员组成,尽管SBP 转录因子家族成员在蛋白质一级结构上存在较大差异,但是均含有一个由79 个氨基酸残基组成的高度保守的DNA 结构域,称为SBP 结构域,该结构域包含2 个典型的由半胱氨酸(Cys)和组氨酸(His)残基组成的锌指基序结构(Cys-Cys-His-Cys 和Cys-Cys-Cys-His)[2],在结构域的C 端具有保守的核定位信号,能够引导SBP 蛋白进入细胞核行使其功能[3]。
目前,SBP 转录因子家族基因已经在拟南芥[4]、水稻[5]、番茄[6]、玉米[7-8]、棉花[9-10]、高粱[11]、油菜[12]、大豆[13]、荞麦[14]、桑树[15]和小麦[16]等多种植物中进行了鉴定和分析。其中禾本科作物中,高粱鉴定的数量最少(18 个),小麦数量最多(56 个)。研究表明,SBP转录因子家族基因参与植物形态建成。拟南芥中,AtSPL3 促进开花,同时调控花和花序发育[17],AtSPL9和AtSPL10 能够降低叶片生产速率,导致叶片数量减少,叶面积增大[18],AtSPL3、AtSPL4 和AtSPL5 促进叶片远轴面表皮毛的形成[19];水稻中,OsSPL14 是控制水稻株型的关键基因,调控水稻的分蘖、花序分枝、穗粒数以及千粒质量[20-21],OsSPL13 正调控谷壳中的细胞大小,从而提高水稻的粒长和产量[22],OsSPL3/OsSPL12 调控水稻不定根的发生[23];玉米中,SBP 转录因子tga1(teosinte glume architecture)是玉米进化过程中的一个关键基因,对籽粒外面硬壳的生长发育具有调控作用[24],LG1(liguleless1)与叶舌和叶耳的发育密切相关[25],ZmSPL10/14/26 在叶片表皮毛和气孔的发育中发挥关键作用[26]。另外,SBP 转录因子家族基因在激素信号转导和逆境胁迫应答中也发挥重要作用。AtSPL8 参与GA 信号转导,调控花药发育、种子萌发和根系伸长[27],AtSPL7 在维持铜稳态方面发挥重要作用[28],OsSPL10 参与水稻幼苗耐盐性的调控[29]。
microRNA(miRNA)是一类在动植物中广泛分布的长度在20~24 nt 的非编码小RNA,通过对靶基因进行降解或者抑制翻译,进而降低靶基因的表达[30]。现有研究结果表明,一些SBP 基因是miR156 和miR529 的靶基因[5,31],拟南芥通过miR156/miR529-SPLs 模块调控开花[32-33],水稻通过miR156/miR529-SPLs 模块调控分蘖、株高、穗型和籽粒发育等[34-36]。
谷子(Setaria italica)起源于我国,具有抗旱耐瘠、营养均衡、粮饲兼用、C4 高光效等特点,是旱作生态农业绿色发展的主栽作物[37],谷子的抗旱、耐逆及高光效特性不断引起科学家和育种家的关注,已经成为功能基因组研究的模式作物之一[38]。SBP转录因子家族基因具有植物生长发育和逆境胁迫响应相关元件[7,10],谷子中目前鉴定出19 个SBP基因[39],但是并没有对表达模式进行深入研究。目前,SBP 转录因子家族基因在谷子组织器官以及响应激素和胁迫处理后的表达模式还没有见详细报道。
本研究拟通过分析谷子SBP 转录因子家族基因在不同组织器官中以及在激素和胁迫处理后的表达模式,探究该家族基因对植物激素和逆境胁迫的响应模式,为全面解析谷子SBP 转录因子家族基因的生物学功能提供参考。
1 材料和方法
1.1 试验材料
试验所用的谷子品种是长农35 号,由山西农业大学谷子研究所提供。
1.2 试验方法
将长农35 号种植于山西农业大学谷子研究所试验田,种植6 行,行长4.5 m,行间距33 cm,于苗期(三叶一心)采集新出叶片、于孕穗期采集长度1.5、2.5、10.0 cm 的幼穗(记为幼穗1、幼穗2、幼穗3)和倒二茎、于抽穗期采集根和旗叶,上述样品经液氮速冻后,立即放入-80 ℃超低温冰箱保存,用于谷子SBP 转录因子家族基因的组织器官表达分析。选择饱满的种子播于营养钵(营养土∶蛭石=1∶1(V/V)),放置于光照培养箱(RTOP-268Y)中,生长条件为光照16 h、温度30 ℃,黑暗8 h、温度25 ℃。生长至两叶一心时进行生长素(IAA,5 μmol/L)、赤霉素(GA3,100μmol/L)、茉莉酸甲酯(MeJA,100μmol/L)、脱落酸(ABA,100 μmol/L)、干旱(20%PEG)和冷胁迫(4 ℃)处理,每处理3 次重复,分别采集对照植株和处理后1、3、6、12 h 的植株叶片,液氮速冻后,放入-80 ℃超低温冰箱保存,用于谷子SBP 转录因子家族基因在不同激素和逆境胁迫处理的表达分析。
1.3 总RNA 提取及cDNA 合成
总RNA 提取参照RNAisoPlus(9108,TAKARA)说明书进行,提取检测合格的RNA 采用PrimeScript II 1st strand cDNA synthesis kit(6210A,TAKARA)合成cDNA,反应体系和程序参考试剂盒说明书。
1.4 荧光实时定量(Real-time PCR)分析
1.4.1 引物设计 根据宋健等[39]报道的谷子中19 个SBP 转录因子家族基因的ID 号,从Phytozome 数据库(https://phytozome.jgi.doe.gov/pz/portal.html)分别下载CDS 序列,利用Primer 5.0 软件设计实时定量引物(表1)。
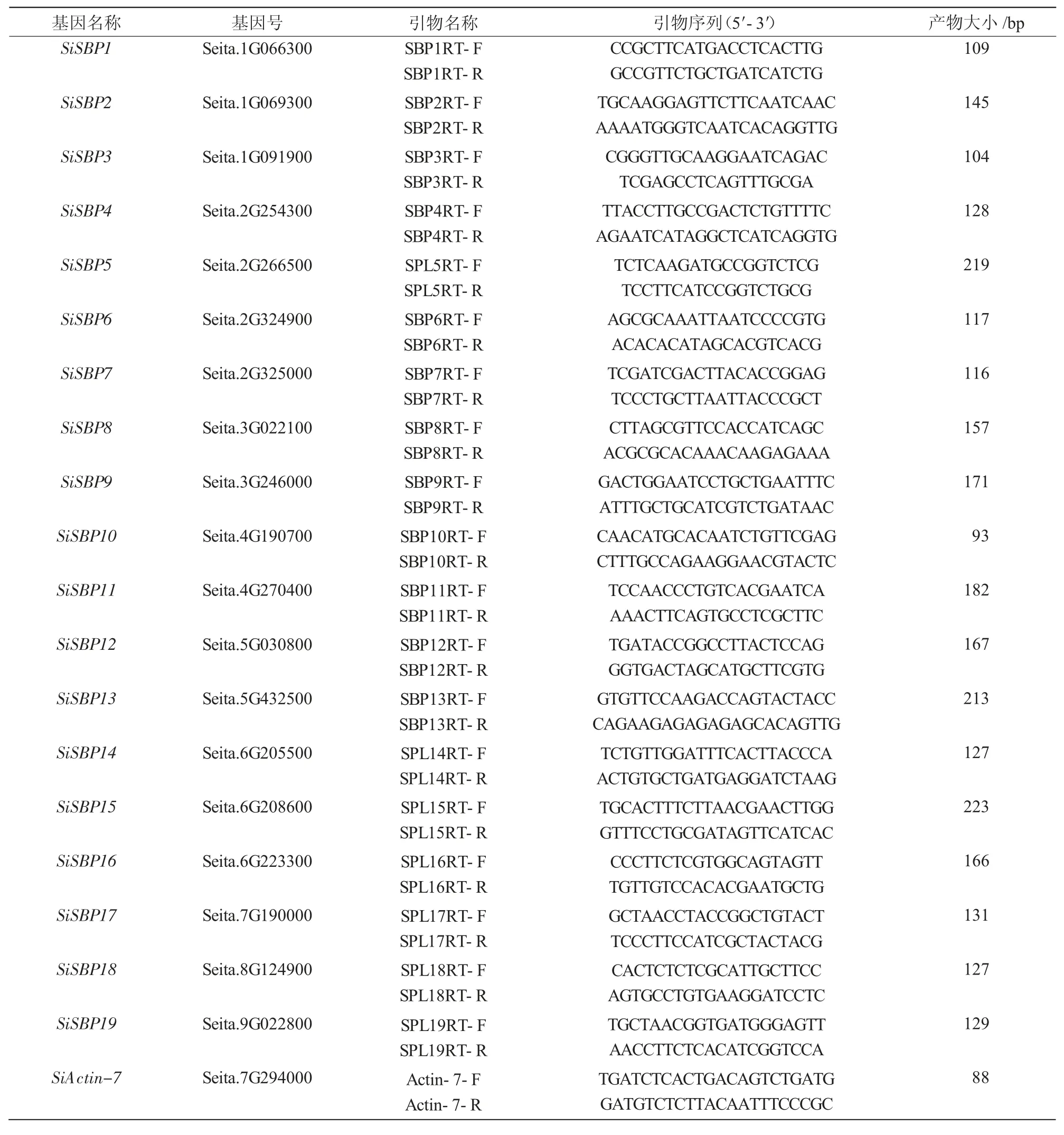
表1 实时定量PCR 的引物信息
1.4.2 反应体系及程序 荧光实时定量通过CFX96 Real-time PCR 仪(Bio-Rad)采集数据,扩增体系为:cDNA 模板1.0 μL,TB Green Premix Ex TapⅡ(RR820A,北京宝生物技术有限公司)5.0 μL,上下游引物(4 μmol/L)1.0 μL,补充ddH2O 至10 μL。扩增程序为:预变性95 ℃3 min;95 ℃10 s,60 ℃30 s,72 ℃30 s,40 个循环;终延伸72 ℃10 min。依据C=2-ΔCt(ΔCt=Ct目的基因-Ct内参基因)计算基因的相对表达量。采用SPSS 19 软件中单因素方差分析方法进行相对表达量显著性差异检测。
1.5 利用转录组数据对SBP 转录因子家族基因进行表达分析
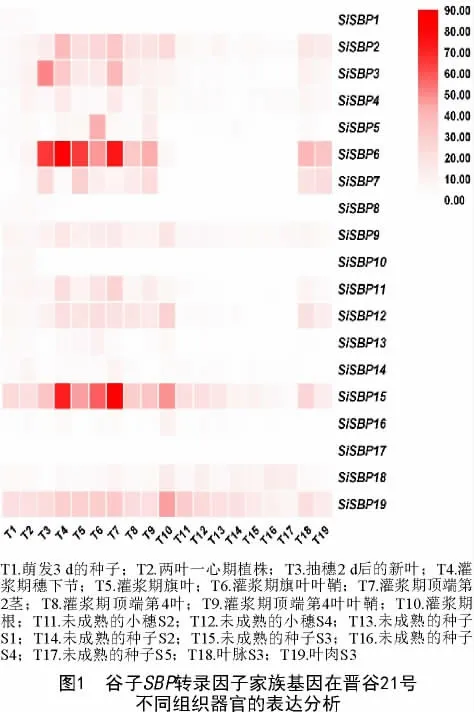
根据宋健等[39]报道的谷子中19 个SiSBPs 的ID 号,从Phytozome 数据库(https://phytozome.jgi.doe.gov/pz/portal.html)逐一下载对应的氨基酸序列,从MDSi 数据库(http://foxtail-millet.biocloud.net/home)搜索其对应的基因号,然后搜索其在晋谷21 号中不同组织器官中的FPKM(Fragments per kilobase million)值,利用TBtools 软件[40]将表达数据可视化,获得19 个SiSBPs 在晋谷21 号不同组织器官中的表达热图。
1.6 启动子顺式作用元件分析
通过Phytozome 数据库分别下载19 个SiSBPs基因1500bp 启动子区序列(起始密码子ATG上游),利用PlantCARE(http://bioinformatics.psb.ugent.be/we btools/plantcare/html/)分析基因的顺式作用元件。
1.7 谷子SBP 转录因子家族基因中miR156 和miR529 靶基因预测
利 用psRNATarget server(http://plantgrn.noble.org/psRNATarget/?function=3)[41]搜索谷子19 个SiSBPs 基因全长cDNA 序列中的miR156 和miR529 靶基因位点,miR156a-miR156k 和miR529a-miR529b序列参考文献[42],所有参数为默认参数。
2 结果与分析
2.1 转录组数据库中谷子SBP 转录因子家族基因在不同组织器官中的表达分析
为探究SBP 转录因子家族基因在谷子中的表达模式,利用MDSi 数据库中晋谷21 号的19 个组织器官的转录组数据,对SBP 转录因子家族基因的表达模式进行了分析,结果表明(图1),SiSBP1、SiSBP8、SiSBP10、SiSBP13、SiSBP14、SiSBP16 和SiSBP17 整体表达水平较低;SiSBP9、SiSBP14 和SiSBP19 表现为组成型表达,其中,SiSBP19 表达量相对较高,SiSBP14 表达量相对较低;另外,一些基因的表达具有组织特异性或发育时期特异性,例如SiSBP16 在灌浆期的根(T10)中特异表达,SiSBP10在萌发3 d 的种子(T1)和两叶一心期植株(T2)中特异表达,SiSBP6 和SiSBP15 在灌浆期穗下节、旗叶、旗叶叶鞘和茎(T4~T7)中相对高表达,SiSBP18在孕穗期小穗(T11~T12)和灌浆期种子(T13~T17)相对高表达。
2.2 谷子SBP 转录因子家族基因的组织器官表达分析
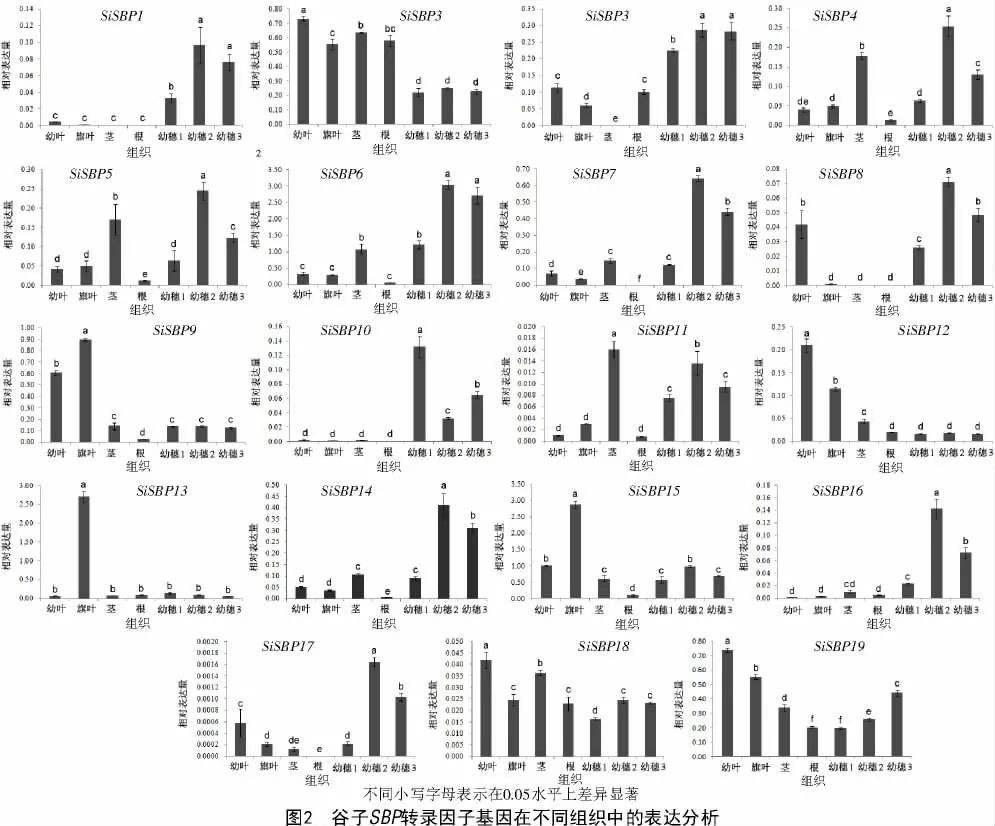
为进一步了解谷子SBP 转录因子家族基因的表达模式,本研究采用实时定量PCR 对19 个SiSBPs在长农35 号不同组织器官(幼叶、旗叶、茎、根、幼穗1.5 cm、幼穗2.5 cm 和幼穗10.0 cm)的表达模式进行了分析。结果表明(图2),SiSBP11、SiSBP17 和SiSBP18 的总体表达水平低于其他基因;SiSBP2、SiSBP18 和SiSBP19 表现为组成型表达。SiSBP2、SiSBP12、SiSBP18 和SiSBP19 在幼叶中相对高表达;SiSBP9、SiSBP13 和SiSBP15 在旗叶中相对高表达;SiSBP11 在茎中相对高表达;SiSBP1、SiSBP3、SiSBP4、SiSBP5、SiSBP6、SiSBP7、SiSBP8、SiSBP10、SiSBP14、SiSBP16 和SiSBP17 在幼穗中相对高表达。
2.3 谷子SBP 转录因子家族基因的顺式作用元件分析
为更好地了解谷子SBP 转录因子家族基因在逆境胁迫响应过程中的作用,本研究对19 个SiSBPs起始密码子上游1 500 bp 启动子区进行顺式作用元件分析(表2),除转录和光响应等必需顺式作用元件外,大部分SiSBPs 还存在激素和逆境胁迫响应等顺式作用元件。其中,除SiSBP5、SiSBP11、SiSBP12外,其余16 个SiSBPs 启动子区都含有脱落酸响应元件(ABRE);除SiSBP1、SiSBP6、SiSBP10、SiSBP13、SiSBP16、SiSBP18 外,其余13 个SiSBPs 启动子区都含有茉莉酸甲酯响应元件(CGTCA-motif和TGACGmotif);生长素响应元件(AuxRR-core 和TGA-element)分布于SiSBP1、SiSBP2、SiSBP3、SiSBP4、SiSBP5、SiSBP13、SiSBP16、SiSBP19 的启动子区;赤霉素响应元件(GARE-motif 和P-box)分布于SiSBP2、SiSBP3、SiSBP5、SiSBP7、SiSBP10、SiSBP11、SiSBP12、SiSBP13、SiSBP14、SiSBP19 的启动子区;低温响应元件(LTR)分布于SiSBP1、SiSBP3、SiSBP8、SiSBP9、SiSBP10、SiSBP13、SiSBP17、SiSBP18 和SiSBP19 的 启 动 子区;干旱响应元件(MBS)分布于SiSBP2、SiSBP3、SiSBP6、SiSBP7、SiSBP10、SiSBP11、SiSBP12、SiSBP16、SiSBP19 的启动子区;胚乳表达相关元件(GCN4_motif)分布于SiSBP6、SiSBP10 和SiSBP12 的启动子区;水杨酸响应元件(TCA-element)分布于SiSBP4、SiSBP9 和SiSBP11 的启动子区;生物钟相关响应元件(circadian)分布于SiSBP9 和SiSBP12 的启动子区;种子特异调控响应元件(RY-element)分布于SiSBP1 和SiSBP17 的启动子区;根特异响应元件(motif I)位于SiSBP17 的启动子区。

表2 谷子SBP 转录因子家族基因启动子区的顺式作用元件
2.4 谷子SBP 转录因子家族基因在激素和胁迫条件下的表达分析
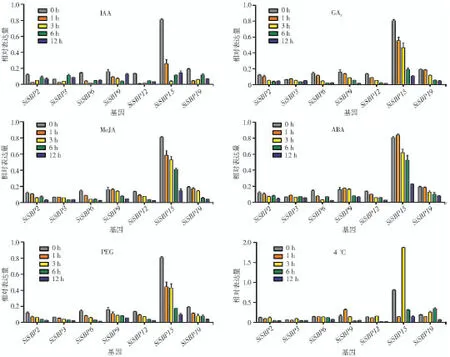
顺式作用元件分析表明,19 个SiSBPs 启动子区均存在激素和逆境胁迫等相关顺式作用元件。为进一步研究谷子SBP 转录因子家族基因在激素和逆境胁迫响应过程中的作用,本研究在谷子苗期分别进行生长素、赤霉素、茉莉酸甲酯、脱落酸、干旱和冷处理,利用荧光实时定量方法检测谷子SBP 转录因子家族基因对激素和逆境的响应情况。综合19 个SiSBPs 在晋谷21 号中两叶一心期植株(T2)和长农35 号中幼叶的表达情况,选取7 个在幼叶中表达量较高的SBP 基因(SiSBP2、SiSBP3、SiSBP6、SiSBP9、SiSBP12、SiSBP15 和SiSBP19)进行激素和逆境胁迫的响应分析。结果表明(图3),在5 μmol/L生长素处理条件下,SiSBP2、SiSBP3 和SiSBP19 的表达趋势为1 h 时显著下降—3 h 后上升—12 h 时下降,SiSBP6 和SiSBP15 的表达趋势为3 h 时下降到最低值随后上升,SiSBP9 的表达趋势为6 h 时下降到最低值随后上升,SiSBP12 在生长素处理后一直维持在较低的表达水平;在100 μmol/L 赤霉素处理条件下,除SiSBP3 响应不明显外,其他6 个基因的表达趋势均为处理1 h 后表达量逐步下降;在100 μmol/L 茉莉酸甲酯处理条件下,除SiSBP3 响应不明显外,其他6 个基因的表达趋势均为表达量逐步下降;在100 μmol/L 脱落酸处理条件下,SiSBP2、SiSBP6 和SiSBP12 在处理1 h 时表达量开始下降,SiSBP9、SiSBP15 和SiSBP19 在处理3 h 时开始下降,SiSBP3 对脱落酸处理无响应;在20%PEG 处理条件下,7 个基因的表达趋势均为表达量逐步下降;在4 ℃处理条件下,SiSBP2、SiSBP3 和SiSBP12 在处理6 h 时显著下降,SiSBP6 在处理12 h 时显著下降,SiSBP9 在处理1 h 时显著上升随后逐步下降,SiSBP15 和SiSBP19 表达趋势为1 h 时下降—3 h后上升—12 h 时下降。整体来看,谷子SBP 转录因子家族基因参与多种激素和逆境胁迫响应过程。
2.5 谷子SBP 转录因子家族基因miR156 和miR529 靶基因预测
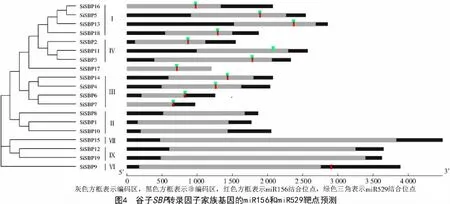
分析SiSBPs 全长cDNA 序列中miR156 和miR529 靶基因位点预测结果,发现13 个SiSBPs 可能存在与miR156 或miR529 相互补的序列,它们分别属于SBP 家族基因的第Ⅰ、Ⅲ、Ⅳ、Ⅵ亚类。其中,SiSBP9 仅含有miR156 位点(位于3'UTR),SiSBP11仅含有miR529 结合位点(位于编码区),其余11 个均含有靶位点相同或相近的2 个结合位点,且多位于编码区,说明miR156 和miR529 的靶基因具有保守性(图4)。
3 结论与讨论
SBP 转录因子是植物中特有转录因子之一,参与植物株型、开花、产量、激素信号转导、逆境响应等多种生长发育进程的调控,在多个物种中都对其进行了鉴定和分析。前期,宋健等[39]在谷子中共鉴定出19 个SBP 蛋白,并将谷子SBP 蛋白家族分为7 个亚类。本研究利用晋谷21 号的19 个组织器官的转录组数据进行分析发现,第Ⅰ亚类基因SiSBP5、SiSBP13、SiSBP16 和SiSBP18 在叶片或穗中有较高表达,水稻SPL16 也聚为这一类,OsSPL16 控制籽粒大小和形状,该基因的过表达可增加粒宽、粒质量和产量[43];第Ⅱ亚类基因SiSBP1、SiSBP8 和SiSBP10除在萌发期的种子和幼苗中表达外,在其余器官中均低表达;第Ⅲ亚类基因SiSBP4、SiSBP6、SiSBP7和SiSBP14 在叶和茎中表达量较高,控制水稻株型的关键基因OsSPL14 就属于这一亚类[20-21],可以将该亚类基因作为今后谷子株型研究的关键候选基因;第Ⅳ亚类基因SiSBP2、SiSBP3 和SiSBP11 表达模式与第Ⅲ亚类相似;第Ⅵ亚类基因SiSBP9 为组成型表达;第Ⅶ亚类基因SiSBP15 在叶鞘和茎等组织中有较高表达;第Ⅸ亚类基因SiSBP12 和SiSBP19在根和叶中有较高表达。另外,本研究中SiSBP17并未聚到第Ⅲ亚类,与宋健等[39]的结果略有不同,其总体表达水平低于其他基因。进一步分析19 个SiSBPs 在长农35 号和晋谷21 号中的表达模式,发现SiSBP19 都表现为组成型表达,SiSBP17 都表现为低表达或不表达,SiSBP13 和SiSBP15 都在旗叶中高表达,说明SBP 基因在不同谷子品种中具有保守性,同时由于品种的不同,一些基因的表达有所不同,例如SiSBP16 在长农35 号的幼穗中特异表达,而晋谷21 号中该基因在灌浆期根中特异表达。
SBP 转录因子参与多种逆境胁迫应答反应。玉米ZmSPL1、ZmSPL9、ZmSPL12、ZmSPL15、ZmSPL22、ZmSPL26 和ZmSPL29 对急性脱水、盐、冷和ABA等4 种逆境胁迫均有响应[7];甜橙CcSBPs 对高温、低温、盐和伤流等4 种不同逆境胁迫中表现出多重响应模式[44]。前期,宋健等[39]对谷子SBPs 在ABA 和PEG 这2 种逆境胁迫下的表达模式分析表明,2 种胁迫处理后该家族基因在叶和茎中均上调表达。本研究分析了7 个SBP 基因(SiSBP2、SiSBP3、SiSBP6、SiSBP9、SiSBP12、SiSBP15、SiSBP19)在脱落酸、干旱和冷处理下的表达量变化,4 ℃处理下,除了SiSBP9、SiSBP15 和SiSBP19 在处理后1 h 或3 h 表达上调外,其余基因表达均下调,其中,SiSBP3、SiSBP9 和SiSBP19 的启动子区存在低温响应元件(LTR);ABA处理下,7 个SiSBP 基因均为下调表达,除SiSBP12外,其他6 个基因的启动子区存在脱落酸响应元件(ABRE);PEG 处理下,7 个SiSBP 基因表达模式与ABA 处理相似,其中除SiSBP15 外,其他6 个基因的启动子区存在干旱响应元件(MBS)。本研究中SiSBPs 对ABA 和PEG 响应结果与宋健等[39]的研究结果不同,但与玉米、甜橙中该家族基因对逆境胁迫的响应是相似的。
结合顺式作用元件的预测结果,本研究又选用了3 种激素(IAA、MeJA 和GA3)处理来分析SiSBPs对激素的响应。IAA 处理下,大部分SiSBPs 表现出显著下降后又上调表达,但总体表达量低于对照,其中,SiSBP2、SiSBP3 和SiSBP19 的启动子区存在生长素响应元件(AuxRR-core 和TGA-element);MeJA处理下,SiSBPs 表达量随着处理时间而逐渐下降,其中除SiSBP6 外,其他6 个基因的启动子区存在有茉莉酸甲酯响应元件(CGTCA-motif和TGACG-motif);GA3处理下,SiSBPs 表达模式与MeJA 处理相似,其中SiSBP2、SiSBP3 和SiSBP19 的启动子区存在赤霉素响应元件(GARE-motif 和P-box)。这些结果为进一步研究谷子SBP 转录因子家族基因参与逆境及激素信号转导的机制提供了参考。
miR156 和miR529 通过miR156/miR529-SPL模块调控植物开花、株型建成、穗型发育等[24,30-32]。本研究中,19 个SiSBPs 基因中13 个(68.4%)可能存在miR156 或miR529 的结合位点,这一比例稍高于拟南芥(64.7%)、水稻(57.9%)和玉米(61.3%)[5,7,25],暗示谷子中可能有更多的SBP 基因通过miR156/miR529-SPL 模块调控谷子生长发育,miR156/miR529 与13 个SiSBPs 之间的关系有待于进一步试验验证。
本研究利用荧光实时定量PCR 分析了19 个SiSBP 基因在7 种组织器官中的表达模式,预测了19 个SiSBPs 启动子区顺式作用元件,发现7 个SiSBPs 在生长素、赤霉素、茉莉酸甲酯等外源植物激素和ABA、冷、干旱等胁迫处理下表达量发生明显变化,暗示该基因家族参与了多种激素信号转导和逆境胁迫响应过程。另外,预测到13 个SiSBPs存在miR156 和miR529 靶位点。研究结果为进一步解析SBP 转录因子家族基因参与谷子生长发育及激素和逆境胁迫的响应机制奠定了基础。
