多点活检在隐匿性子宫颈上皮内瘤变Ⅱ级及以上病变诊断中的价值
2021-12-15蔡春华
宋 娟,王 莉,张 琼,杨 鸿,蔡春华
0 引 言
阴道镜检查是子宫颈癌筛查中的重要环节,旨在通过这项光学检查技术对子宫颈细胞学或HPV检测阳性患者进行病变观察和活检标本提取[1]。但受限于结果判断过分依赖操作医师的主观性,阴道镜检查可能导致部分较高级别(Ⅱ级及以上级别)的宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)漏诊。这种观点也得到国内外诸多专家学者的认同,甚至有学者经统计认为,阴道镜对高级别CIN的活检诊断敏感度仅为43.4%[2]。这也为隐匿性CIN的客观存在事实提供了循证医学支持[3]。随机多点活检方案的提出和应用,是对阴道镜检查的有效补充,但其对隐匿性CIN病变的诊断价值目前尚无定论。本研究选取行宫颈癌筛查,且经病理确诊为CINⅡ级及以上病变患者的石蜡标本象限作为研究对象,探讨多点活检在隐匿性CINⅡ级以上病变诊断中的价值。
1 资料与方法
1.1 一般资料选取2020年1月至2021年1月我院行宫颈癌筛查的患者进行前瞻性研究,年龄39~72岁,平均年龄(57.1±3.9)岁。筛查内容根据《外科学》[4]中相关标准,为高危型HPV检查联合子宫颈液基细胞学检查。对于出现一项及以上阳性结果的患者,进行阴道镜检查以及子宫颈随机多点活检。以阴道镜下可见病灶活检和未见病灶象限随机多点活检样本作为病理检查对象,共确诊103例患者的198个石蜡标本象限发生CINⅡ级及以上病变(其中CINⅡ级71例,共129个标本象限;CINIII级32例,共69个标本象限)。本研究已通过医院医学伦理委员会批准(批准号:200312),所有筛查对象均签署知情同意书。
1.2 方法
1.2.1 标本处理根据《外科学》中定义,以阴道镜可见病灶活检确诊的病例定义为可见病变,以阴道镜下不可见而由随机多点活检确诊的病例定义为隐匿性病变。使用“三明治”法将研究对象标本逐一重制为5张连续切片,首张和尾张进行HE染色用以明确诊断,并确保连续切片包含同样级别病灶。取第2~4张白片使用基质辅助激光解吸电离飞行时间质谱法(MALDI-TOF-MS法)对HPV分型进行检测。每个蜡块切片后均更新刀片并清洁台面,确保交叉污染不发生。
1.2.2 MALDI-TOF-MS法检测HPV分型使用手术刀将标本中间3张白片病灶组织刮入1.5 mL离心管,12 000×g离心30 s,加入180 μL孵育液和20 μL蛋白酶K,70 ℃恒温孵育过夜。次日,按照说明书使用Promega公司生产的DNA自动提取仪提取组织中HPV DNA。使用MALDI-TOF-MS法对所收集的DNA进行检测。
1.2.3 病灶鳞状上皮厚度的测量使用日本Olympus公司生产的BX41显微镜在×10镜头下对连续切片中首尾两片中选取的病变连续、完整的鳞状上皮部位进行厚度测量。垂直放置测微尺,测量从基底层到鳞状上皮表层的厚度,取最厚和最薄部位的平均值作为鳞状上皮厚度。
2 结 果
2.1 可见病变与隐匿性病变HPV亚型分布比较确诊的103例患者的198个石蜡标本象限中,发现隐匿性病变31例,占52个象限;可见病变72例,占146个象限。经MALDI-TOF-MS法检测,可见病变中HPV16型所占象限的比例高于隐匿性病变(P<0.05)。其他HPV亚型分布的差异则无统计学意义(P>0.05)。见表1。
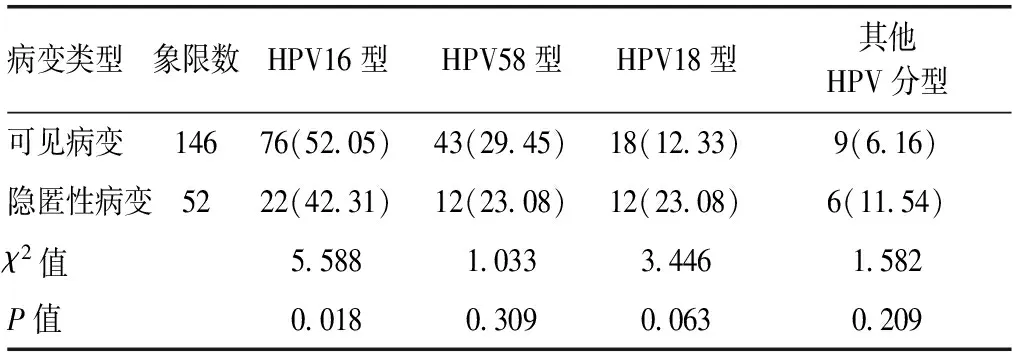
表1 子宫颈上皮内瘤变患者可见病变与隐匿性病变HPV亚型分布比较[n(%)]
2.2 可见病变与隐匿性病变范围及鳞状上皮厚度比较可见病变中病灶>1个象限的病例占比高于隐匿性病变(P<0.01),可见病变的病灶范围更大。可见病变的鳞状上皮厚度亦厚于隐匿性病变(P<0.01)。见表2,图1。
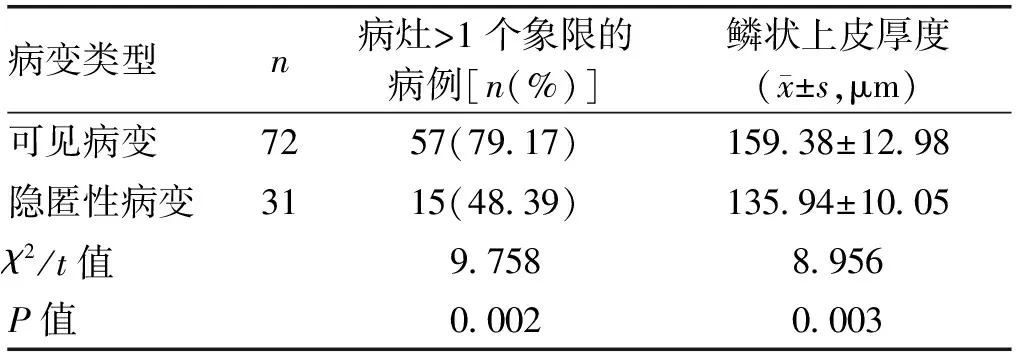
表2 子宫颈上皮内瘤变患者可见病变与隐匿性病变范围及鳞状上皮厚度比较
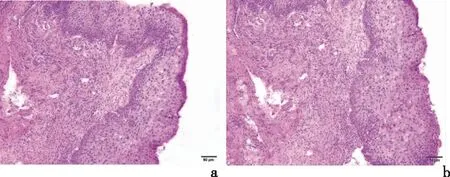
a:隐匿性病变;b:可见病变图1 子宫颈上皮内瘤变患者病灶鳞状上皮病理(HE染色 ×10)
2.3 HPV不同亚型病灶中病变范围及鳞状上皮厚度比较HPV16型阳性患者中病灶>1个象限的病例占比高于非HPV16型阳性患者(P<0.01),HPV16型阳性患者的病灶范围更大。HPV16型阳性病例的鳞状上皮厚度亦厚于非HPV16型阳性病例(P<0.01)。见表3。
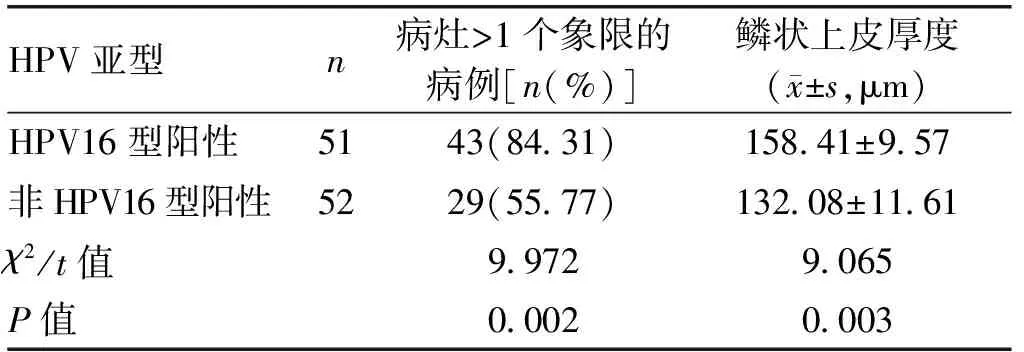
表3 HPV不同亚型病灶中病变范围及鳞状上皮厚度比较
3 讨 论
子宫颈癌筛查的“三阶梯”程序目前已在临床上广泛开展,作为其中的重要组成部分,阴道镜下子宫颈活检的重要性不言而喻[5]。伴随该操作实施数量的增加,其短板也日益引起重视,并逐渐成为相关领域的研究热点:如何弥补因敏感度不足而导致阴道镜检查中高级别子宫颈病变被漏诊。国外有学者研究认为,子宫颈随机多点活检能够有效提升阴道镜检查对Ⅱ级以上CIN的敏感度[6]。但国内相关的报道较少,且缺乏对子宫颈随机多点活检发现CIN临床和生物学特点的深入研究[7]。故笔者选取我院行宫颈癌筛查的患者,确保每例患者均接受细胞学检测和HPV病毒学检测筛查,并对阳性患者行阴道镜活检+随机多点活检+自宫颈管搔刮术,在尽可能避免高级别子宫颈病变漏诊的同时,对经阴道镜可见病灶活检确诊和阴道镜不可见而经随机多点活检确诊的组织进行对比分析。
本研究中,阴道镜可见病变和隐匿性病变石蜡标本象限中HPV亚型的分布差异具有统计学意义,前者的高危HPV16亚型所占比例更高,这可能提示隐匿性病变的疾病进展风险相对较低。但也有报道称,对隐匿CIN和可见CIN的p16蛋白表达水平进行分析后发现差异不具有统计学意义,故推测隐匿CIN与可见CIN具备相似的恶变潜能[8]。笔者认为这为隐匿CIN进展风险的研究提供了一种思路,可在下一步研究中结合中长期临床随访进行深入探讨。
有国外学者对CIN病变程度和鳞状上皮厚度的相关性进行分析,结果显示CIN病变程度越重,组织鳞状上皮厚度越大[9]。而本研究结果显示,经随机多点活检发现的CIN病变,其鳞状上皮厚度较阴道镜可见病变的鳞状上皮厚度薄,这可能提示两种病变的生物学特征不尽相同。子宫颈表面的醋酸白反应是子宫颈CIN病变在阴道镜下可见的关键因素,当病变的鳞状上皮较薄,会导致醋酸涂抹在子宫颈表面后的醋酸白反应弱,使病灶难以在阴道镜下观察和显示[10]。这也是隐匿性CIN客观存在的依据。因此,对初筛阳性的病例行随机多点活检是必要的,因为针对隐匿性病变的发生机制,仅依靠提升阴道镜检查医师的技能水平,价值有限[11]。
对HPV不同亚型病灶中病变范围及鳞状上皮厚度比较,显示HPV16型阳性病变的范围更大,鳞状上皮更厚,这也是这类病变更容易在阴道镜下被观察到的重要原因[12]。笔者认为这与HPV16型的高致癌性和自然病史密切相关。此外,还有学者认为高龄患者更易感染HPV16[13],而这类患者较低的雌激素水平会使鳞状上皮变薄,子宫颈鳞柱交界向上移动至子宫颈管,大大增加了阴道镜的识别难度[14]。这种观点有待于进一步流行病学分析论证[15]。
综上所述,非HPV16型阳性导致的CINⅡ级及以上病灶鳞状上皮相对较薄,病灶范围小,可能是导致隐匿性CIN不易发现的主要原因。临床中在行宫颈癌筛查时,建议对于非HPV型阳性感染的患者在阴道镜检查中同时行宫颈转化区域的病灶活检和多点随机活检,有助于提升隐匿性病灶的检查率,减少临床漏诊,使患者获得早期干预。
