阿司匹林抗结直肠癌的作用机制的生物信息学分析
2021-12-14郎吉萍戴秋月郭志刚
郎吉萍 戴秋月 吕 萍 郭志刚
南方医科大学南方医院(广州 510515)
结直肠癌是常见的消化道恶性肿瘤之一,发病率在全球恶性肿瘤中位居第3 位,死亡率位居第2位。据估计,2018年全世界有超过180万新发结直肠癌病例[1-2]。近年来由于饮食、环境、生活方式等因素的改变,我国的癌症谱正在从发展中国家向发达国家转变,结直肠癌的发病率呈逐年上升趋势[3]。患癌高风险人群的化学预防是目前最经济、最现实可行的肿瘤预防途径。近年来免疫细胞和炎性微环境为癌症治疗提供了新的策略。虽然这些新策略前景良好,但对于初级化学预防来说,大多数毒性太强和/或太昂贵,临床上亟需更加经济、较低毒性的初级化学预防策略。其中阿司匹林是目前最有前景的化学预防药物之一[4-5]。
2003年《新英格兰医学杂志》报道阿司匹林可预防结直肠癌患者大肠腺瘤的复发,掀起了阿司匹林预防结直肠癌的研究热潮[6]。近年来大量临床流行病学、临床研究发现,阿司匹林对结直肠癌具有潜在的一级预防作用,并且能够降低早期肠癌根治术后患者的复发转移风险[7-8]。心血管疾病预防试验数据表明服用阿司匹林的心脑血管患者能够有效降低结直肠癌的患病率[9]。体外实验发现阿司匹林可以通过抑制结直肠癌细胞增殖和诱导凋亡,显著减弱肿瘤生长[10]。2016年美国预防服务工作组在指南中首次推荐服用低剂量阿司匹林来预防结直肠癌[11]。随后,美国国立综合癌症网络指南也开始推荐阿司匹林用于结直肠癌根治术后的“辅助治疗”,以达到肿瘤二级预防的目的。
虽然阿司匹林对于结直肠癌的预防作用得到了很大程度的认可,但其防治结直肠癌的分子机制仍尚未达成共识。目前讨论最多的机制涉及抑制血小板中的环氧化酶(血小板假说)。然而抑制生长所需的非甾体抗炎药浓度是抑制前列腺素合成所需浓度的10~100倍,这表明存在额外的细胞靶点[5-6, 12-14]。随着测序技术的成熟以及大数据时代的到来,生物信息学分析展现出其独特的优势,药物数据库及多种公共基因表达谱数据库为我们研究药物作用新靶点提供了广泛的平台。本研究中,我们基于生物信息学方法,通过多种公共数据库预测并分析阿司匹林防治结直肠癌的候选基因,探讨阿司匹林抗结直肠癌的潜在作用靶点[15]。
1 材料与方法
1.1 确定阿司匹林直接作用靶蛋白
DrugBank数据库(https://www.drugbank.ca/)是目前唯一将详细的药物(即化学、药理和药物)数据与全面的药物靶标(即序列、结构和途径)信息相结合的数据库。在DrugBank 5.1.5中可查找到阿司匹林的分子信息及直接作用蛋白靶点(direct protein targats, DPTs)[16]。
1.2 构建阿司匹林DPTs的蛋白质-蛋白质相互作用网络和信号通路分析
STRING(https://string-db.org/cgi/input.pl)是构建蛋白质互作网络的经典在线工具[17]。通过STRING在线构建阿司匹林DPTs的蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络,并对阿司匹林DPTs的KEGG信号通路进行分析。
1.3 预测与癌症有关的阿司匹林DPTs相互关联的基因
通过STRING构建与癌症有关的阿司匹林DPTs相互关联的基因的PPI网络。设定物种为人种,设置直接及间接关联均不超过50个,筛选出最高置信度(得分0.900)的靶点,并用Cytoscape软件可视化[18]。
1.4 分析阿司匹林DPTs在结直肠癌中的基因组学数据
cBioPortal(http://www.cbioportal.org/)可探索多维癌症基因组数据[19]。OncoPrint是一个可视化基因在肿瘤样本中突变、拷贝数、表达情况的工具[20]。为了进一步了解 6个与癌症相关的阿司匹林DPTs(EDNRA,IKBKB,NFKB2,NFKBIA,PTGS2,TP53)在结直肠癌患者中的基因特征,我们通过cBioPortal数据库分析这些基因在结直肠癌患者中的表达改变,并用OncoPrint可视化。其中EDNRA,IKBKB,NFKB2,NFKBIA,PTGS2和TP53及结直肠癌作为限定条件。
1.5 确认阿司匹林抗结直肠癌的潜在作用靶点
GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)是公共基因表达谱数据库。选择GEO数据库中的4个结直肠癌表达谱芯片GSE9348(T=70、N=12)[21]、GSE21510(T=123、N=25)[22]、GSE32323(T=17、N=17)[23]、GSE21815(T=132、N=9)[24],获取上述芯片的标准化数据Series Matrix File(s),并将芯片数据按照肿瘤组织及正常组织进行分组,应用R 3.6.1软件的limma 函数进行差异表达分析,参数选择|log2FC|>1,FDR<0.05,筛选结直肠癌和正常组织间的差异表达基因,将4个芯片数据差异分析的结果用韦恩图(http://bioinformatics.psb.ugent.be/webtools/Venn/)进行整合,获取差异表达数据中相同的基因。利用Cytoscape软件筛选中心度最高的20个结直肠癌差异表达基因作为Hub基因(记为A组);用STRING分析得到DPTs相互关联基因(记为B组)。将以上两组数据求交集,确认阿司匹林抗结直肠癌的潜在作用靶点。GEPIA(http://gepia.cancer-pku.cn/index.html)是一个新开发的用于癌症和正常基因表达谱分析的公共数据库[25]。利用GEPIA进一步验证阿司匹林抗结直肠癌的潜在作用靶点在TCGA数据库结肠腺癌样本中的表达情况。
1.6 阿司匹林抗结直肠癌潜在靶点的基因本体论分析和KEGG通路分析
基因本体论(gene oncology,GO)分析包括生物过程、分子功能或细胞成分分析。京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)是系统分析基因功能,联系基因组信息和功能信息的知识库。利用R 3.6.1软件enrichGO、enrichKEGG包进行GO分析和KEGG通路分析并可视化,对阿司匹林抗结直肠癌潜在靶基因进行功能注释。
1.7 细胞培养
人结肠癌细胞株HT-29由含10% FBS的1640培养基培养,经0.25%胰蛋白酶消化传代,置于37 ℃,5% CO2的细胞培养箱培养。实验组和对照组分别用阿司匹林和等量DMSO处理。
1.8 RT-PCR检测HT-29中CDK1,AURKA,CCNB1,MAD2L1,TPX2的mRNA水平
将HT-29细胞分为4组,分别经 0、2、4、8 mmol/L阿司匹林处理48 h,用Trizol试剂提取HT-29总RNA,纯化后用紫外分光光度仪检测RNA浓度,用逆转录试剂盒将RNA逆转录成 cDNA。利用染料法(SYBR Green I)将反应体系进行定量PCR分析,GAPDH作为内参。引物由上海生工公司设计并合成。引物序列:CDK1上游:TGGGAAGTTGGTAGCTCTGAA,下游:CCAGGGTGCTTGTCCATGTA;AURKA上游:TTGGGTGGTCAGTACATGCTC,下游:GTGAATTCAACCCGTGAT;CCNB1上游:GCACT-TTCCTCCTTCTCA,下游:CGATGTGGCATACTTGTT;MAD2L1上游:GTTCTTCTCATTCGGCAT-CAACA,下游:GAGTCCGTATTTCTGCACTCG;TPX2上游:ACGGGCTGTGACCTGCAAAAGT,下游:AGCCAATAGGCTCGGTGGGTGG;内参上游:TGTGGGCATC-AATGGATTTGG,下游:ACACCATGTATTCCGGGTCAAT。2-△△ct法计算CDK1,AURKA,CCNB1,MAD2L1,TPX2的mRNA相对表达量。
1.9 WB检测HT-29中CDK1,AURKA,CCNB1,MAD2L1,TPX2的蛋白表达水平
将HT-29细胞分为4组,分别经 0、2、4、8 mmol/L阿司匹林处理48 h。去除培养基,PBS洗细胞3次。用预冷的RIPA裂解液裂解30 min后,BCA试剂盒检测蛋白质浓度。取40 μg进行电泳、转膜和封闭,孵育相应的一抗和二抗后用ECL发光法分析各蛋白的表达量,以GAPDH为内参。
2 结 果
2.1 阿司匹林直接作用靶蛋白
阿司匹林(乙酰水杨酸)为弱酸性小分子药物,其主要应用于解热、镇痛、抗血小板聚集等方面。在DrugBank 5.1.5中共查找到11个阿司匹林的DPTs(PTGS1,PTGS2,AKR1C1,PRKAA1,EDNRA,IKBKB,TP53,HSPA5,RPS6KA3,NFKBIA,NFKB2),见表1。

表1 DrugBank数据库中阿司匹林的直接作用靶点
2.2 阿司匹林DPTs的PPI网络与KEGG通路分析
利用STRING构建了11个阿司匹林DPTs的PPI网络与KEGG通路分析(图1、表2)。阿司匹林DPTs主要富集的KEGG信号通路包括NF-κB信号通路,神经营养因子信号通路,胰岛素抵抗信号通路,肿瘤信号通路,小细胞肺癌信号通路。其中6个阿司匹林DPTs(EDNRA,IKBKB,NFKB2,NFKBIA,PTGS2和TP53)富集在肿瘤信号通路中。
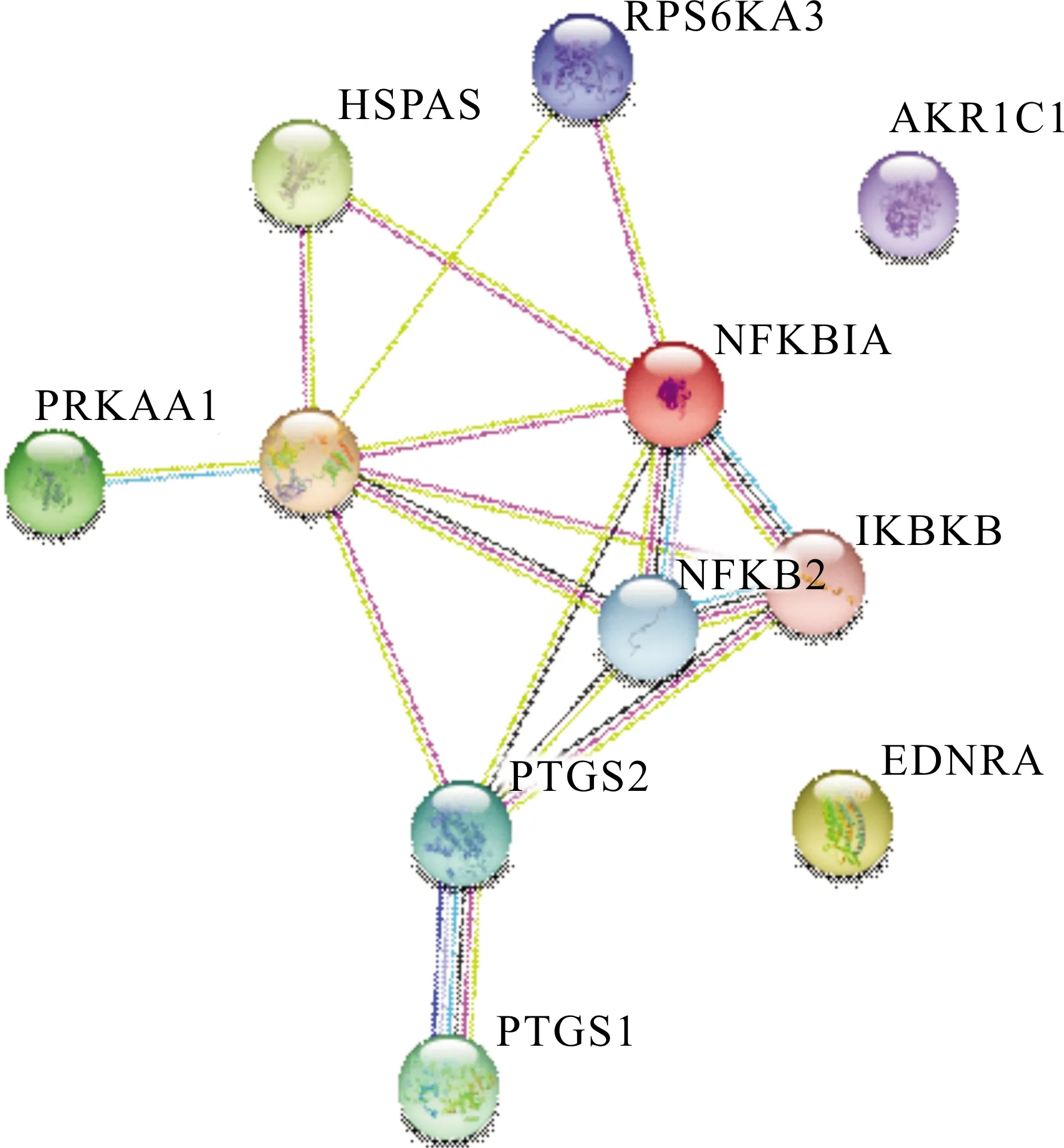
图1 阿司匹林DPTs的蛋白质-蛋白质互作网络
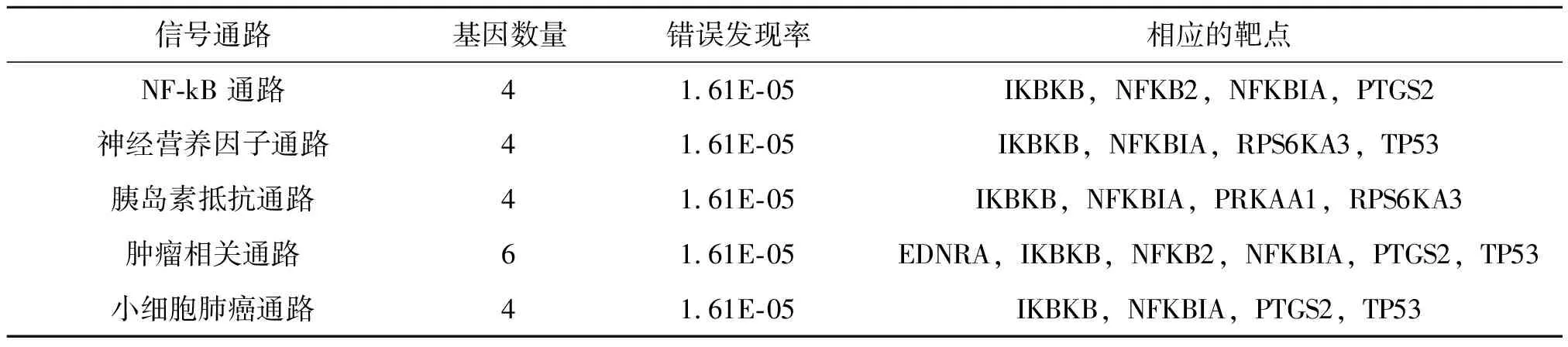
表2 阿司匹林DPTs主要富集的KEGG信号通路
2.3 预测6个阿司匹林DPTs相互关联的基因
利用STRING的在线PPI分析预测6个富集于肿瘤信号通路的阿司匹林DPTs(EDNRA,IKBKB,NFKB2,NFKBIA,PTGS2,TP53)相关联的基因,并用Cytoscape软件可视化(图2)。这些基因可能是阿司匹林抗肿瘤的潜在靶点。KEGG信号通路分析表明,这些基因主要富集于细胞周期,人类嗜T淋巴细胞病毒Ⅰ型感染,EB病毒感染,病毒性肿瘤,肿瘤等信号通路(表3)。

图2 与EDNRA,IKBKB,NFKB2,NFKBIA,PTGS2,TP53相关联的基因

表3 阿司匹林DPTs相关联基因的KEGG信号通路
2.4 结直肠癌中6个阿司匹林抗肿瘤相关靶点的基因特征
为进一步了解6个阿司匹林抗肿瘤相关靶点的表达变化及功能,我们利用cBioPortal检测了EDNRA,IKBKB,NFKB2,NFKBIA,PTGS2和TP53在结直肠癌患者中的肿瘤基因组改变(图3A)。OncoPrint可视化结果表明在3项人结直肠癌研究中(DFCI研究[26]、TCGA研究和Genentech研究[27]),EDNRA,IKBKB,NFKB2,NFKBIA,PTGS2和TP53 6个基因的变化范围在0.2%到37%之间,其中TP53发生变化比例最大。489例患者(37%)至少有一种 EDNRA,IKBKB,NFKB2,NFKBIA,PTGS2和TP53发生改变。其中EDNRA的改变表现为错义突变;PTGS2的改变表现为错义突变和基因扩增;TP53、NFKB2的改变表现为错义突变,截短突变,纯和缺失;IKBKB的改变表现为基因扩增,纯和缺失,错义突变和截短突变;NFKBIA的改变表现为基因扩增,纯合缺失和错义突变(图3B)。
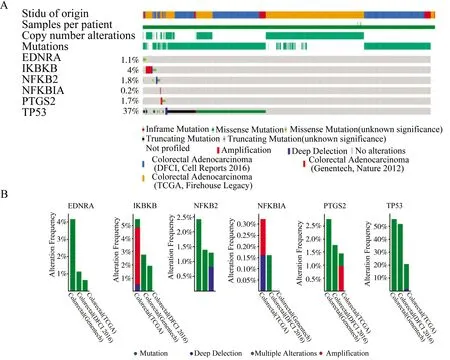
图3 cBioPortal数据库结肠腺癌研究中6个阿司匹林DPTs(EDNRA,IKBKB,NFKB2,NFKBIA,PTGS2和TP53)的遗传改变
2.5 确定结直肠癌的差异表达基因
利用R3.6.1软件对GEO中4个结直肠癌表达谱芯片数据进行差异分析并用火山图可视化(图4)。使用韦恩图将上述结果进行整合,结果显示在 4个芯片中,共有606个差异表达基因,表达上调的基因265个,表达下调的基因341个(图5)。其中包括参与细胞分裂周期的基因如CDC25B、CDCA7、GTF2IRD1等,与细胞粘附功能相关的分子 CDH3、CLDN1等,参与肿瘤转移的基质金属蛋白酶家族分子MMP1、MMP3、MMP7、MMP12等。利用Cytoscape软件筛选中心度最高的20个结直肠癌差异表达基因作为Hub基因(图6)。
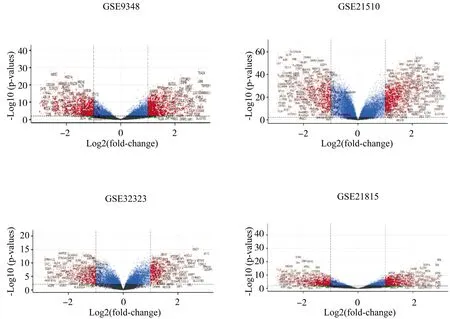
图4 GSE9348、GSE21510、GSE32323、GSE21815基因表达谱火山图

图5 4个基因表达数据集的韦恩图

图6 结直肠癌TOP 20 Hub基因
2.6 预测阿司匹林抗结直肠癌潜在靶点
通过比较20个结直肠癌Hub基因与肿瘤相关的6个阿司匹林DPTs相互关联的基因,我们发现两组中有5个基因(CDK1,AURKA,CCNB1,MAD2L1,TPX2)共同表达,其可能是阿司匹林抗结直肠癌的潜在靶基因(表4)。GEPIA在线工具表明其在TCGA数据库结肠腺癌样本中的表达水平均上调(图7)。
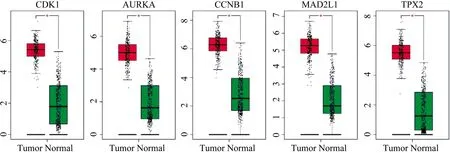
图7 阿司匹林抗结直肠癌的潜在靶基因在TCGA数据库结肠腺癌样本中的表达情况
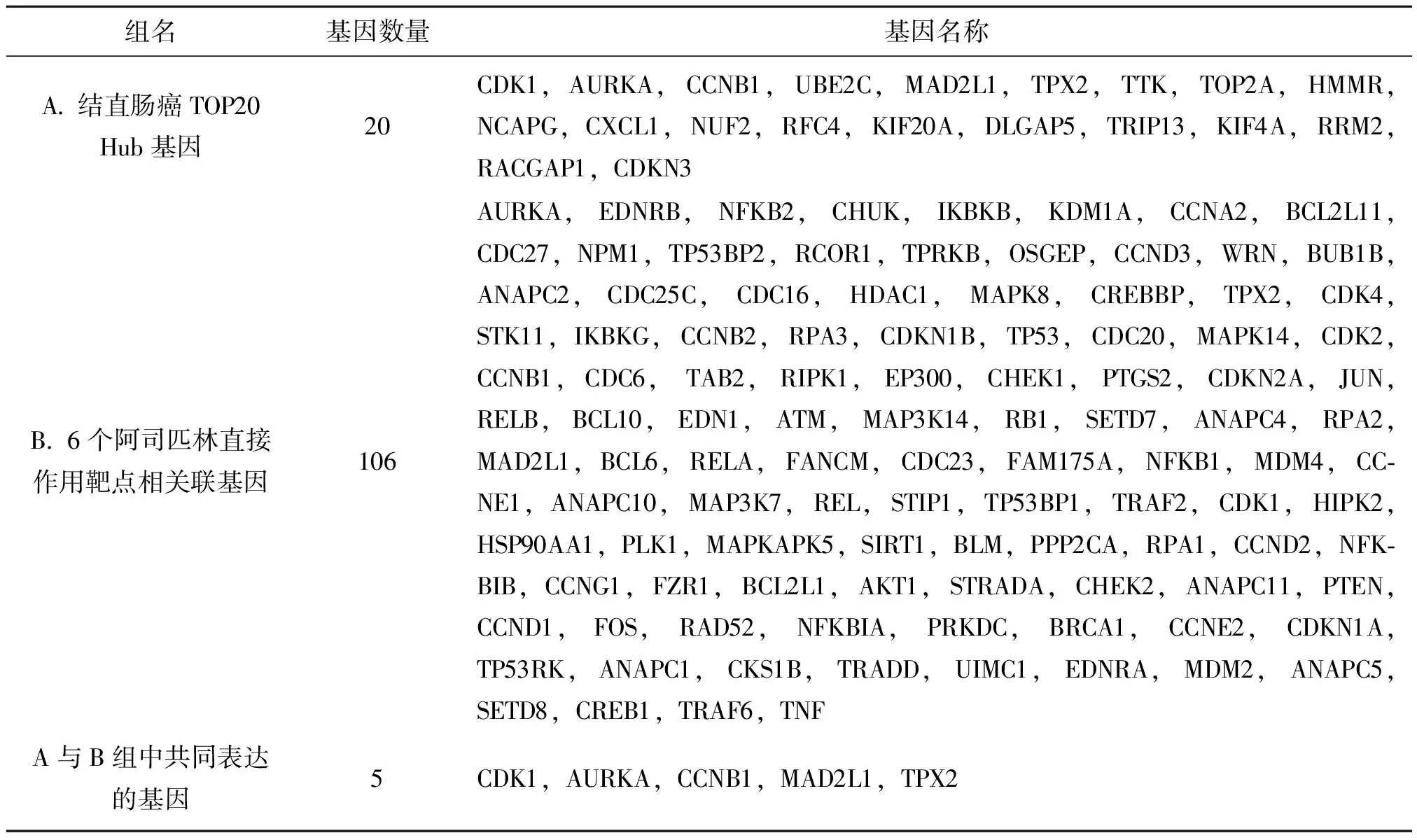
表4 结直肠癌TOP 20 Hub基因与阿司匹林DPTs相关联基因的交集
2.7 分析阿司匹林抗结直肠癌的潜在靶点
对这5个阿司匹林抗结直肠癌潜在靶点的GO富集分析表明其主要参与细胞周期时相转换的调控、微管细胞骨架的组成、有丝分裂细胞周期时相转换的调控等生物学过程,其中CDK1,CCNB1,AURKA,MAD2L还参与有丝分裂细胞周期检查点和细胞周期末期促进复合物依赖的分解代谢过程。KEGG富集分析表明这些靶点主要富集在与细胞周期调控相关的信号通路(图8,图9)。研究发现,细胞周期调控异常是细胞癌变和肿瘤发生的重要原因,细胞骨架与肿瘤的侵袭转移密切相关。这提示这些潜在靶点可能通过以上方式对肿瘤的发生、发展产生影响。
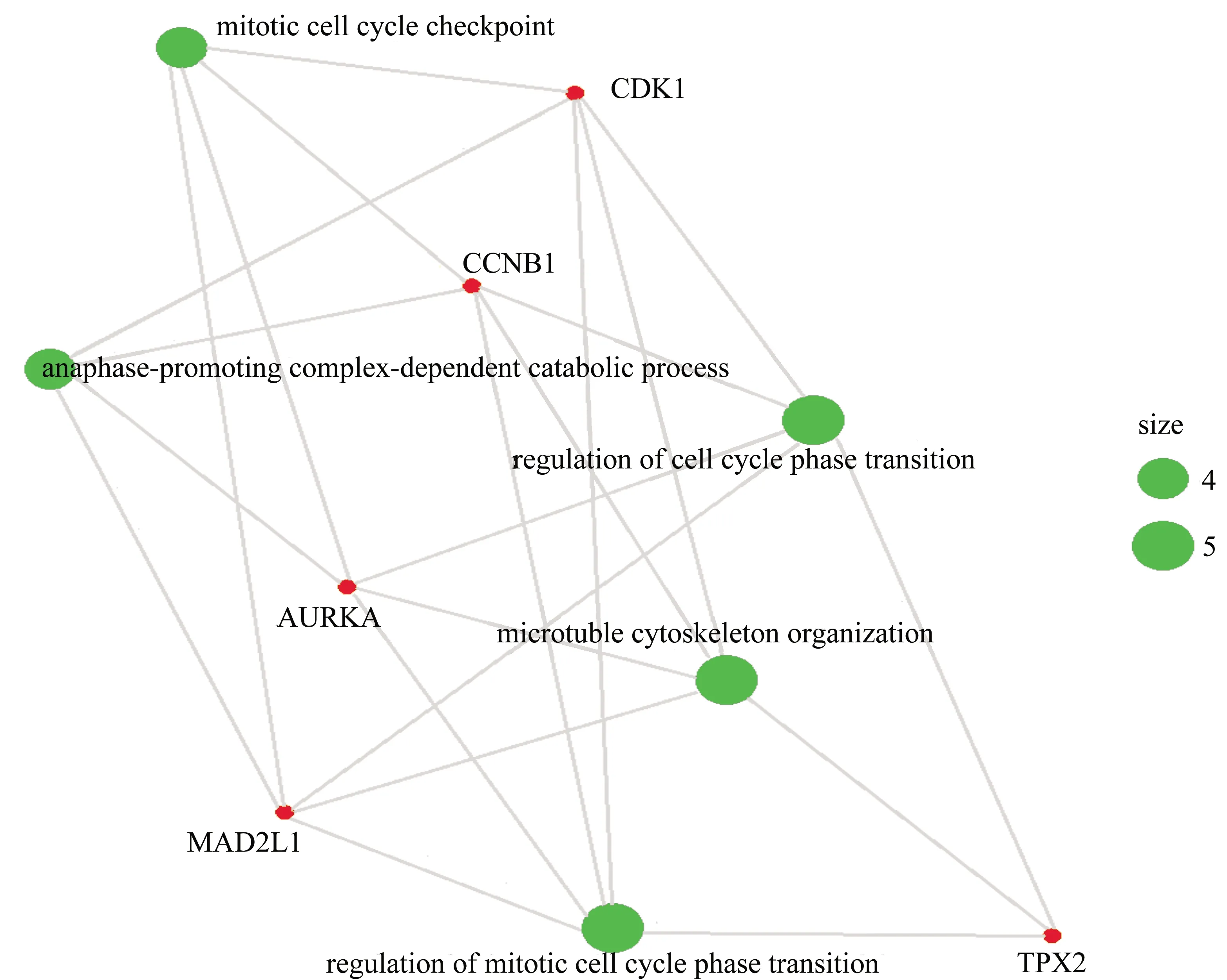
图8 阿司匹林抗结直肠癌的潜在靶点的GO富集分析

图9 阿司匹林抗结直肠癌潜在靶点的KEGG通路分析
2.8 RT-PCR、WB结果
为进一步验证生物信息学分析的阿司匹林抗结直肠癌增殖的潜在靶点,我们用RT-PCR和WB分别检测了不同浓度阿司匹林处理48 h的HT-29细胞中CDK1,AURKA,CCNB1,MAD2L1,TPX2的mRNA和蛋白表达(图10、图11)。阿司匹林可以下调上述5个基因的mRNA和蛋白表达,且呈剂量依赖性。

图10 阿司匹林作用于HT-29 48h后CDK1,AURKA,CCNB1,MAD2L1,TPX2的mRNA相对表达(**P<0.01)
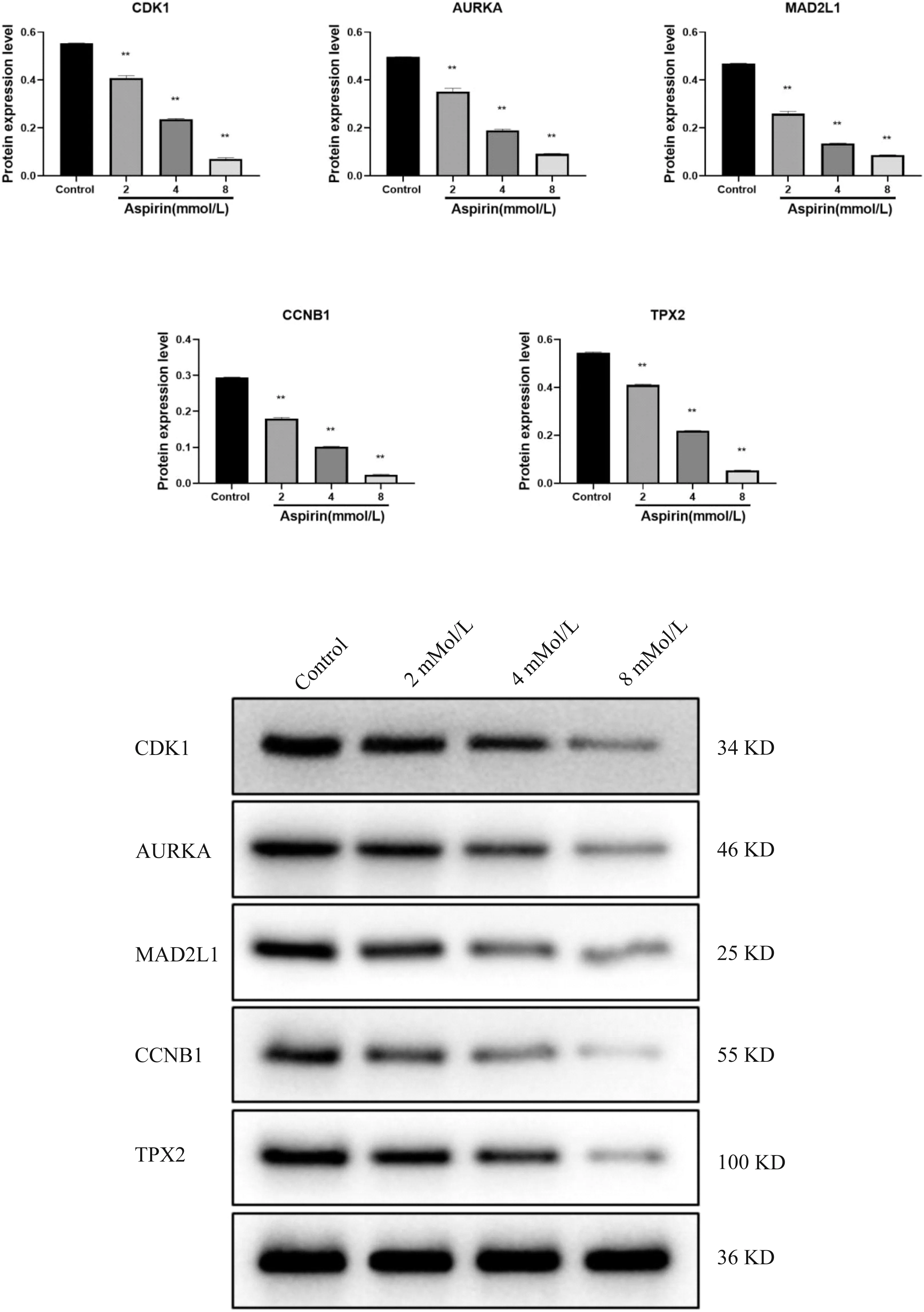
图11 阿司匹林作用于HT-29 48 h后CDK1,AURKA,CCNB1,MAD2L1,TPX2的蛋白表达水平(**P<0.01)
3 讨 论
结直肠癌是常见的消化道肿瘤,严重影响人类健康。临床上亟需新的防治方法以减少疾病负担、提高患者存活率及生存质量。近年来大量研究表明阿司匹林对结直肠癌具有潜在的一级预防作用,并且能够降低早期肠癌根治术后患者的复发转移风险。本研究基于生物信息学,通过多种公共数据库发现了阿司匹林与癌症相关的6个DPTs及其相关联基因,并得到阿司匹林抗结直肠癌的5个潜在作用靶点(CDK1,AURKA,CCNB1,MAD2L1,TPX2)。并通过RT-PCR、WB法进一步分析验证了阿司匹林作用HT-29细胞后5个潜在作用靶点(CDK1,AURKA,CCNB1,MAD2L1,TPX2)的表达。与我们的研究一致的是,已有研究报道这5个基因在结直肠癌中起重要作用。
CDK1是调控G2-M关键节点的重要基因。CDK1在结直肠癌患者癌症组织中高表达,且研究发现CDK1核浆比≥1.5可作为结直肠癌独立危险因素,其核浆比越高,患者预后越差[28]。结直肠癌中10%的患者发生BRAF基因V600E突变,预后很差。维罗非尼是一种BRAF V600E抑制剂,但对结肠癌没有明显的抑制作用。研究表明CDK1会激活诱导维罗非尼耐药[29]。近年来研究发现阿司匹林代谢产物及其衍生物对CDK1酶活性有抑制作用,阿司匹林可能通过抑制CDKs对大肠癌起化学预防作用[30]。
研究表明,TPX2(20q11)和AURKA(20q 13.2)是位于染色体20q的不同区域的两个基因,它们促进了20q扩增驱动的大肠腺瘤向癌的进展。TPX2和AURKA的下调可抑制细胞的侵袭[31]。长期以来,MYC癌基因一直被认为是包括结直肠癌在内的许多类型人类癌症的主要驱动因素。AURKA和TPX2与MYC位点呈现频繁的共扩增,而MYC及其两个基因的表达水平在多种癌症类型中与MYC下游靶基因的表达水平呈正相关。此外,AURKA或TPX2的敲除或AURKA特异性抑制剂的治疗有效地抑制了MYC表达的大肠癌细胞的增殖。MYC、AURKA和TPX2的联合高表达被证明是结直肠癌患者生存的不良预后指标[32]。
CCNB1是细胞G2/M检查点有关的重要细胞周期调控因子。它的一个重要角色就是调节CDK1并与之形成复合体后使底物磷酸化,启动细胞从G1/S期进入G2/M期,并促进有丝分裂。越来越多的证据表明CCNB1参与了细胞周期检查点的控制,它的功能障碍是肿瘤发生中的早期事件[33]。结直肠癌细胞中高表达的CCNB1可促进肿瘤细胞增殖和肿瘤生长,下调CCNB1的表达可抑制结直肠癌细胞增殖、诱导细胞周期G2/M期阻滞和促进肿瘤细胞凋亡。研究发现阿司匹林可使肿瘤细胞中的CCNB1表达下调,从而抑制细胞增殖[34]。
MAD2L1是调控细胞有丝分裂的关键分子,是结肠特异增殖相关基因,它在结直肠癌细胞周期的活跃期和结肠隐窝中高度表达[35]。研究发现MAD2L2的过表达可抑制CRC细胞的增殖,迁移和克隆形成[34]。纺锤体组装检查点已被确定为驱动非整倍体的重要机制,异倍体在结直肠肿瘤的发生中频率很高。纺锤体组装检查点的两个重要组件是MAD1L1和MAD2L1,它们以交互方式协同工作以启动检查点信号。MAD1L1和MAD2L1结合域中的遗传变异可能调节蛋白质结构,最终导致大肠癌易感[36]。
总而言之,这5个基因与结直肠癌发生、发展有关(表5)。通过生物信息学我们预测它们是阿司匹林抗结直肠癌的潜在作用靶点,并推测阿司匹林可能通过影响细胞周期等方式起到抗结直肠癌作用。我们的研究结果为分析阿司匹林抗结直肠癌的分子机制提供了新的线索,为今后的实验研究奠定基础。

表5 阿司匹林对潜在作用靶点的影响及靶点基因在结直肠癌中的临床意义
在大数据背景下,生物信息学在医学研究和临床实践中的重要性日益明显,成为当前的热点领域之一。此研究基于公共数据库分析阿司匹林抗结直肠癌的潜在作用靶点,该方法能够更加经济、灵活的预测药物治疗疾病潜在的靶点基因。然而,此方法也存在一定的局限性,其主要依赖于数据库的完整性。近年来非编码RNA与疾病进展的关系成为研究热点,其也是一类重要的药物靶点。本研究的不足在于未发现阿司匹林可以作用的非编码RNA[37]。相信数据库的不断完善有助于我们对非编码RNA与药物靶点的研究。总之,生物信息学分析提供了一个便捷的方法,可用于预测药物治疗疾病潜在的靶点基因,为研究药物在疾病预防和治疗中的作用提供新的思路。
