苯并(a)芘诱导恶性转化的BEAS-2B细胞中miRNA和mRNA表达谱的改变
2021-12-14栗振凯李中秋孟丽雅张佳彤
栗振凯,李中秋,孟丽雅,张佳彤,张 巧
1)郑州大学公共卫生学院卫生毒理学教研室 郑州 450001 2)郑州大学医院疾病预防控制科 郑州 450001
肺癌发病隐匿,易转移,预后差[1-2],是最危险的恶性肿瘤之一,其发病率和死亡率居全球之首,每年约有120万人死于肺癌,5 a生存率仍然很低[3]。苯并(a)芘[benzo(a)pyrene,B(a)P]是一种多环芳香烃类化合物,其代谢活化产物是毒性最大的强致癌物,是一种持久性的有机污染物,普遍存在于汽车尾气、煤、石油等产生的烟和化工产品中,目前已有大量实验[4-5]证明B(a)P与肺癌关系密切,但是其致癌机制尚不明确。miRNA是一类长度约为22nt的非编码RNA,它通过与mRNA结合发挥分子功能,包括促进mRNA的降解或增强其翻译过程、转录后调控编码基因[6-7]等。研究[8-9]表明,miRNA具有很多生物学功能,并且与肿瘤的发生发展有密切的关系。本研究构建染毒B(a)P的永生化人支气管上皮细胞(BEAS-2B细胞)模型,通过芯片技术检测染毒和未染毒细胞的miRNA和mRNA表达谱,筛选出差异表达miRNA和mRNA,从而为进一步研究miRNA与肺癌之间的关系提供实验依据。
1 材料与方法
1.1 细胞株、主要试剂和仪器BEAS-2B细胞由本课题组留存。B(a)P购自美国Sigma公司,用DMSO溶解制成2.5 g/L的母液待用。RPMI 1640培养基、DMSO和胰蛋白酶均购自北京索莱宝科技有限公司;胎牛血清购自美国Gemini公司;Trizol试剂购自美国Invitrogen公司;4×gDNA wiper Mix、RNA模板,5×HiscriptRⅡRT SuperMix Ⅱ,AceQ®qPCR SYBR®Green Master Mix(Low ROX Premixed)购自南京诺唯赞生物有限公司。mRNA分离试剂盒购自美国Epicentre公司;SureHyb购自美国Agilent公司;miRCRYTMArray Labeling试剂盒、CIP缓冲剂、CIP酶、免疫荧光双标和酶标记物购自美国Exiqon公司;RNA Flash Labeling 试剂盒购自美国Arraystar公司;7500 Fast实时荧光定量PCR系统购自美国 Applied Biosystems 公司。
1.2 恶性转化BEAS-2B细胞模型的构建及鉴定取10 μL的B(a)P母液与5 mL培养基混匀,使B(a)P浓度为5 mg/L[10]。BEAS-2B细胞用含B(a)P培养基培养24 h后,弃去含B(a)P培养基,胰蛋白酶消化、常规传代;当细胞再次融合至约70%时,再次加入含B(a)P培养基培养 24 h、传代。反复染毒3次的细胞确定为第一代染毒细胞。未染毒细胞用同体积DMSO培养,方法同前。取传至30代后的细胞检测克隆形成能力、迁移能力和增殖活性。
①克隆形成能力:采用平板克隆形成实验。细胞经胰蛋白酶消化后,200个/孔接种于6孔板,加入3 mL RPMI 1640培养基培养,5 d换液一次,培养2周。终止培养后弃上清,PBS清洗,甲醇固定20 min,吉萨姆染色10 min,干燥。镜下计数多于 50 个细胞的克隆数,计算克隆形成率。克隆形成率=(克隆数/接种细胞数)×100%。
②迁移能力:采用划痕实验。用记号笔在6孔板背面画5条间隔相等的横线。细胞经胰蛋白酶消化后,1×106个/孔接种于6孔板,常规培养24 h后,使用枪头垂直于横线划痕,PBS清洗,加入无血清培养基培养。于培养6、12、24、48 h后镜下观察并拍照,使用Image-Pro Plus 6.0 软件分析划痕间距,记录迁移距离。
③增殖活性:采用MTT实验。细胞经胰蛋白酶消化后,5 000个/孔接种于96孔板,培养12、24、36和48 h后,避光加入5 g/L MTT溶液20 μL,培养箱中孵育4 h,弃上清,加入150 μL DMSO,摇床振荡10 min,置于酶标仪中检测490 nm处吸光度值。
1.3 差异表达miRNA的筛选用Trizol法提取染毒和未染毒细胞中的总RNA,用miRCRYTMArray Labeling试剂盒标记miRNA:将1 μg总RNA 样品和1 μL CIP缓冲剂和CIP酶加入到 2 μL水中,混合均匀后,37 ℃放置30 min,95 ℃放置5 min。再加入3 μL标记缓冲液、1.5 μL免疫荧光双标和2.0 μL的酶标记物,混合均匀后16 ℃孵育1 h,65 ℃孵育15 min。取25 μL样品和25 μL杂交缓冲液混匀并于95 ℃变性2 min,冰上静置2 min。将样品置于芯片上,56 ℃反应16~20 h。用清洗液洗涤芯片,用生物芯片扫描仪扫描,对芯片进行标准化分析。以变化倍数(FC)≥2.0且P<0.05 为差异表达miRNA。
1.4 差异表达mRNA的筛选用Trizol法分别提取染毒和未染毒细胞中的总RNA。采用mRNA分离试剂盒去除tRNA,用RNA Flash Labeling试剂盒标记mRNA,使用SureHyb进行杂交。芯片洗涤固定后,再进行扫描杂交。使用GeneSpring软件对芯片进行标准化处理,以FC≥2.0且P<0.05 为差异表达mRNA。对差异表达mRNA进行GO和KEGG分析。
1.5 细胞中hsa-miR-2115-3p和hsa-miR-4521表达的检测染毒和未染毒细胞融合至90%时,分别提取总RNA,加入2 μL的4×gDNA wiper Mix,2 μL的RNA模板混匀,42 ℃孵育2 min。加5×HiscriptRⅡRT SuperMix Ⅱ混匀;25 ℃孵育10 min,50 ℃孵育30 min,85 ℃孵育5 min;反转录成cDNA。取2 μL cDNA加入10 μL的AceQ®qPCR SYBR®Green Master Mix(Low ROX Premixed)、10 μmol/L上下游引物各0.4 μL和7.2 μL无酶水。扩增过程:95 ℃5 min预变性;95 ℃10 s,60 ℃30 s,40个循环;融解95 ℃15 s,60 ℃60 s,95 ℃15 s。用2-ΔΔCt法计算目的基因相对表达量。重复3次。引物由南京诺唯赞基因组研究中心有限公司合成,序列见表1。

表1 实验用引物序列
1.6 统计学处理采用SPSS 21.0对数据进行分析,染毒和未染毒细胞各指标的比较采用两独立样本t检验,检验水准α=0.05。
2 结果
2.1 恶性转化BEAS-2B细胞模型的鉴定染毒、未染毒组平板克隆形成实验结果见图1,克隆形成率分别为(23.444±0.727)%、(0.889±0.601)%,染毒组大于未染毒组(t=41.420,P<0.001)。染毒组细胞增殖活性、迁移能力均强于未染毒组(图2、3),提示染毒组细胞发生恶性转化。

图1 未染毒(A)和染毒(B)组细胞克隆形成情况

图2 未染毒和染毒组细胞增殖活性比较(*:P<0.05)

图3 未染毒和染毒组细胞迁移距离比较(*:P<0.05)
2.2 差异表达mRNA与miRNA的筛选芯片表达谱见图4。聚类分析结果显示,染毒组和未染毒组细胞在不同的簇中,说明B(a)P染毒改变了细胞功能。共筛选出127种差异表达miRNA,其中29种表达上调,98种表达下调,前20位表达差异的miRNA见表2。共筛选出159种差异表达mRNA,其中99种表达上调,60种表达下调,前20位表达差异的mRNA见表3。

图4 染毒和未染毒组细胞miRNA(左)和mRNA(右)的芯片表达谱
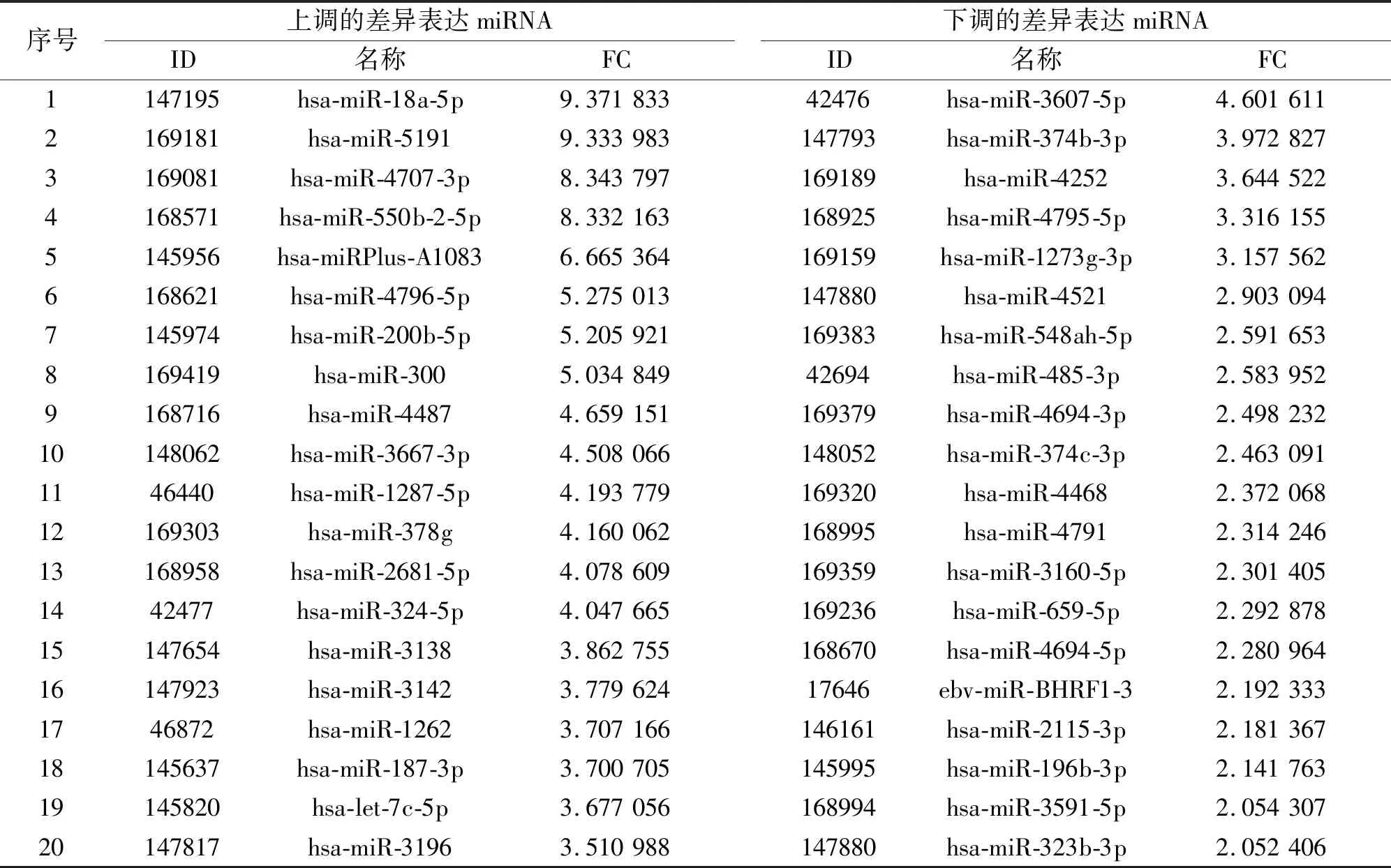
表2 前20位差异表达miRNA

表3 前20位差异表达mRNA
2.3 差异表达mRNA的GO和KEGG分析结果GO分析结果显示,表达上调的差异表达mRNA主要涉及的生物学过程有组织器官生长发育、维持细胞金属离子稳态和免疫应答等,涉及的细胞组分主要有反式高尔基体管网状膜结构对蛋白质进行分选和转运、MHC蛋白复合体、MHC 基因家族Ⅰ蛋白等,涉及的分子功能主要有抗原结合、细胞因子受体结合、受体活化等。表达下调的差异表达mRNA主要涉及的生物学过程有P38MAPK 级联反应、正向调控细胞凋亡、负调控转录等,涉及的细胞组分主要有胞内膜结合细胞器构成细胞独立的结构及功能、转录抑制复合物、通过膜结构相互协作等,涉及的分子功能主要有跨膜受体蛋白酶活性、双链DNA结合及转录因子等。
KEGG分析结果显示,表达上调的差异表达mRNA可能参与了细胞活素-受体相互作用介导的信号通路和Jas-STAT介导的信号通路,并且参与Toll样受体介导的信号通路,通过TLR9来活化NF-κB和转录激活因子AP-1,释放TNF-α因子从而发挥免疫监视功能;表达下调的mRNA可能参与了p53信号通路介导的细胞凋亡、周期阻滞和肿瘤血管抑制,TGF-β介导的抑制细胞分裂和Gadd45介导的DNA损伤修复等。
2.4 两组细胞中hsa-miR-2115-3p 和hsa-miR-4521表达的比较针对miRNA芯片检测结果,选取hsa-miR-2115-3p和hsa-miR-4521进行验证。PCR检测结果显示,染毒组细胞hsa-miR-2115-3p和hsa-miR-4521表达水平均低于未染毒组。
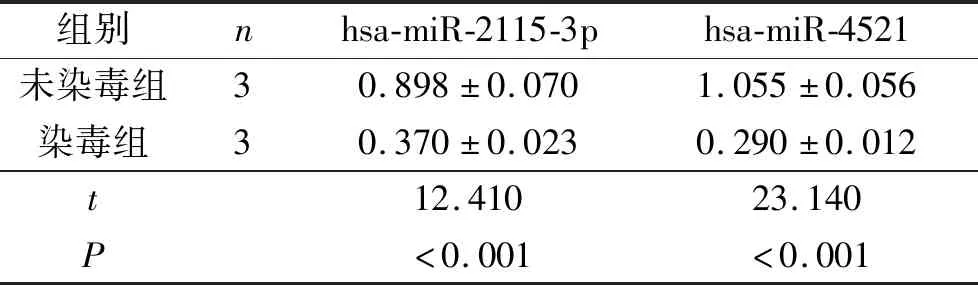
表6 两组细胞中两种miRNA表达水平的比较
3 讨论
B(a)P常常存在于汽车尾气及化学制品中,是主要的大气污染物之一,被国际癌症研究机构IARC评为一级致癌物[11-12]。细胞模型是研究癌症的重要手段。本研究用B(a)P对BEAS-2B染毒后,细胞克隆形成能力、迁移能力和增殖活性均明显增强,提示成功构建了B(a)P诱导的恶性转化细胞模型。
miRNA是非编码蛋白的小RNA,通过碱基互补抑制翻译或降解靶mRNA,调节mRNA的稳定性[13]。miRNA通过影响不同的mRNA参与细胞癌变的生物学过程[14]。研究[15]发现抑制miR-223-3p表达可以抑制JAK2、STAT3蛋白的表达,从而抑制胃癌细胞周期进展。Giordano等[16]以50岁为界限将88名肺腺癌患者分为两组,发现7种差异表达miRNA。本研究发现,B(a)P染毒和未染毒的BEAS-2B有159种差异表达mRNA,其中99种表达上调,60种表达下调;有127种差异表达miRNA,其中29种表达上调,98种表达下调。对差异表达mRNA的GO分析结果显示:表达上调的mRNA分子功能主要富集于受体活化、抗原结合和细胞因子受体结合等;细胞组分主要富集于蛋白质分类转运、MHC蛋白复合体与抗原呈递过程等;生物学过程主要富集于促进器官生长、免疫应答和维持金属离子在细胞内的稳态等。表达下调的mRNA分子功能主要富集于影响跨膜受体蛋白酶活性、转录因子和双链DNA结合等;细胞组分主要富集于胞内膜结合细胞器构成细胞独立的结构及功能;生物学过程主要富集于调控P38MAPK级联反应、调控逆转录和细胞凋亡。KEGG分析结果显示:表达上调的mRNA可能参与了细胞活素-受体相互作用介导的信号通路等;表达下调的mRNA可能参与了p53信号通路介导的细胞凋亡、周期阻滞和肿瘤血管抑制等。本研究对染毒和未染毒细胞中hsa-miR-2115-3p和hsa-miR-4521的表达水平进行检测,结果染毒组均低于未染毒组,与芯片分析结果一致。
基因组不稳定性和突变是正常细胞转变为癌细胞的基础[17]。有研究[18]发现上调反式-7,8-二羟-9,10-环氧苯并芘诱导的恶性转化的人支气管上皮细胞中miR-542-3p表达水平,可降低细胞的增殖能力和恶性程度。生物信息学分析发现差异表达mRNA参与了脂肪积聚肝细胞的恶性转化过程[19]。本研究发现B(a)P诱导恶性转化的BEAS-2B中miRNA及mRNA表达谱发生显著改变,差异表达miRNA及mRNA可能参与了细胞的恶变过程;发现的与恶性转化相关的mRNA和miRNA将有助于发现新型分子标志或靶点,为B(a)P诱导肺癌的诊断和治疗提供实验基础。
