禽致病性大肠杆菌的分离与毒力基因检测
2021-12-14王凯莉侯梦丹史慧娟杨文文李玉保司振书
王凯莉,刘 成,侯梦丹,史慧娟,杨文文,李玉保,司振书
(聊城大学农学院,山东 聊城 252000)
0 引言
禽致病性大肠杆菌(Avian pathogenic Escherichiacoli,APEC)可引起家禽的大肠杆菌病,出现特征性纤维性病变,如心包炎、气囊炎、肝周炎、输卵管炎及腹膜炎等,常与H9亚型流感病毒等其他病原混合感染,严重时可引起败血症,导致禽类死亡[1-5]。大肠杆菌分布广泛,主要通过饮水传播,也可以通过消化道、呼吸道及种蛋进行传播。大肠杆菌感染鸡胚后会导致鸡胚死亡、孵化率降低以及雏鸡发病死亡率增高。禽大肠杆菌病的发生往往与禽舍通风不良、空气潮湿、氨气等有害气体含量高、饲养密度较大等因素有关,各年龄鸡都可感染,幼龄鸡更易感,该病一年四季均可发生,无明显的季节性,给养禽业带来了巨大的经济损失[6]。对聊城某肉鸡养殖场送检的12只精神沉郁、消瘦的20日龄817肉杂鸡进行剖检,发现主要病变为:心包和肝包膜有纤维素性渗出物、肠壁有出血点,有些鸡只肝脏黄染、肠鼓气。无菌采取肝脏和心脏进行细菌分离和病毒的检测,经鉴定分离到1株禽致病性大肠杆菌,并对该菌进行了药敏试验和毒力基因的测定。
1 材料与方法
1.1 材料
营养琼脂、麦康凯琼脂,肠杆菌科生化编码鉴定管及药敏纸片由杭州滨和微生物试剂有限公司生产,根据参考文献[7],由生工生物工程(上海)股份有限公司合成粘附相关基因(aatA、papC、tsh、fimC、mat),侵袭及毒素相关基因(ibeB、vat、yijp、ibeA),抗血清存活因子相关基因(ompA、neuC、cva/cai、iss)及铁转运相关基因(iroN、fyuA、iucD、irp2、chuA),共18种毒力基因引物。
1.2 细菌的分离培养
将病料划线接种于麦康凯琼脂平板,37℃培养18~24 h,挑取单个菌落进行纯化。纯化后分别接种普通琼脂及哥伦比亚血琼脂平板,37℃培养18~24 h,观察生长情况。
1.3 分离菌的染色观察
挑取分离菌进行涂片、革兰染色,光学显微镜下观察。
1.4 分离菌的生化鉴定
将分离菌接种于各生化鉴定管,置37℃恒温箱培养,按使用说明书观察判定结果。
1.5 分离菌的药物敏感性试验
用浸湿生理盐水的无菌棉棒擦洗分离菌菌落1~2个,在盛有灭菌生理盐水的离心管中反复挤压混匀,制备成0.5麦氏单位的菌悬液,采用纸片扩散法对分离株进行药物敏性试验,观察并测量抑菌圈直径,按细菌药敏试纸(扩散法)说明书判断结果。
1.6 毒力基因的PCR检测
挑取纯化后的单菌落置于LB液体培养基内,放到摇床增菌6~8 h后取出作为模板。采用多重PCR的方法对大肠杆菌的aatA、papC、ibeA、ompA、neuC、iss、iroN、irp2等18种毒力基因进行扩增,各毒力基因引物浓度皆为10 μmol/L。粘附素相关基因五重PCR扩增体系:aatA和tsh上、下游引物各0.3 μL,papC、fimC和mat上、下游引物各0.2 μL,菌液2 μL,2×Taq PCR Mix 12.5 μL,DEPC水8.1 μL;侵袭及毒素相关基因四重PCR扩增体系:ibeB 上、下游引物各0.3 μL,vat、yijp和ibeA上、下游引物各0.2 μL,菌液2 μL,2×Taq PCR Mix 12.5 μL,DEPC水8.7 μL;抗血清存活因子相关基因四重PCR扩增体系:ompA、neuC和cva/cvi上、下游引物各0.2 μL,iss上、下游引物各0.4 μL,菌液2 μL,2×Taq PCR Mix 12.5 μL,DEPC水8.5 μL;铁转运相关基因五重PCR扩增体系:5个基因的上、下游引物各0.2 μL,菌液2 μL,2×Taq PCR Mix 12.5 μL,DEPC水8.7 μL[8]。
各多重PCR扩增程序皆为:95℃预变性5 min;94℃变性50 s,55℃退火50 s,72℃延伸80 s,共30个循环;72℃延伸10 min。
2 结果
2.1 剖检结果
剖检可见心包有纤维素渗出物,有些鸡只肝脏黄染,肝包膜有纤维素性渗出物,有的肠壁有出血点,肠鼓气,如图1、图2所示。
2.2 细菌的分离培养结果
分离菌在麦康凯琼脂平板上,的菌落呈红色、圆形,表面光滑、湿润,边缘整齐;在普通琼脂上形成圆形凸起、光滑、湿润、灰白色的菌落;在哥伦比亚血琼脂平板上,生长呈灰白色菌落,无溶血环如图3所示。

图3 分离菌在琼脂上的生长情况
2.3 分离菌形态染色特点
菌体呈杆状,多单个散在,两端钝圆。革兰染色呈红色,为革兰阴性菌,如图4所示。
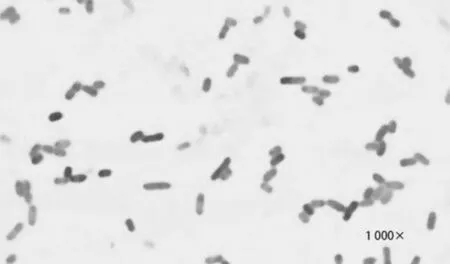
图4 分离菌革兰染色及镜检结果
2.4 分离菌的生化鉴定结果
分离菌的生化特点为:赖氨酸+,鸟氨酸+,精氨酸-,尿素-,葡萄糖厌氧菌发酵+,β半乳糖+,乳糖+,山梨醇+,棉子糖+,蔗糖-,肌醇-,七叶苷-,甘露醇+,丙二酸盐-,靛基质试验+,枸橼酸盐和VP试验为阴性,不产生硫化氢,与大肠杆菌的生化特点相符合。
2.5 药敏试验结果
根据分离到的鸡大肠杆菌的药敏试验结果可知,敏感的药物及抑菌圈直径分别为:头孢西叮28 mm,妥布霉素18 mm,大观霉素18 mm,米诺环素25 mm,头孢他叮18 mm,多粘菌素B 14 mm,阿米卡星25 mm;耐药的药物及抑菌圈直径分别为:头孢曲松8 mm,头孢哌酮9 mm,头孢噻肟10 mm,氧氟沙星11 mm,左氟沙星12 mm,诺氟沙星12 mm,环丙沙星10 mm,链霉素10 mm,庆大霉素9 mm,哌拉西林8 mm,四环素10 mm,氯霉素8 mm;中介的药物及抑菌圈直径分别为:卡那霉素16 mm,氨曲南18 mm,头孢吡肟16 mm。
2.6 毒力基因检测
毒力基因电泳结果显示,分离到的大肠杆菌基因组内含有粘附相关基因aatA、fimC、mat,侵袭及毒素相关基因ibeB、yijp,抗血清存活因子相关基因ompA、iss,铁转运相关基因iroN、iucD,共9种毒力基因如图5所示。
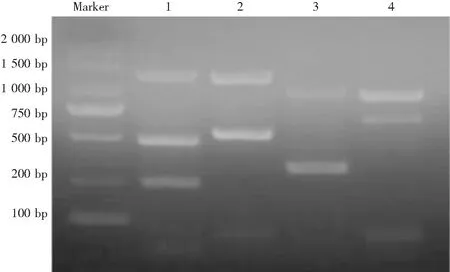
注:1-3条带自上而下分别为aatA、fimC和mat基因;2-2条带自上而下分别为ibeB和yijp基因;3-2条带自上而下分别为ompA和iss基因;4-2条带自上而下分别为iroN和iucD基因。
3 讨论
禽致病性大肠杆菌携带的毒力基因与菌株的致病性有直接关系[9]。因此大肠杆菌的致病性可以根据其携带的毒力基因来判断,已有研究表明大肠杆菌携带的毒力因子的数量与致病性具有显著相关性[10-11]。也就是说,可通过毒力基因的检测对大肠杆菌的致病能力进行评估。目前,大肠杆菌毒力因子按功能可分为粘附素、摄铁系统、毒素、脂多糖、侵袭素和血清抗性相关因子[12]。王俊丽等[8]的研究表明,聊城地区鸡源大肠杆菌普遍携带5~9种毒力基因,且侵袭与毒素相关基因yijp的携带率最高。本研究对禽大肠杆菌常见的18种毒力基因进行检测,结果分离菌检测到9种毒力基因,包括yijp基因。王怡平等[10]的研究表明,大肠杆菌若携带iss、cvaC、irp2、iucD、iroN和tsh 6种基因中的3种或3种以上则可判定为致病性大肠杆菌。分离株检测出其中的iss、iucD、iroN 3个基因,据此可判定为致病性大肠杆菌。
Oh等[13]研究了9种毒力基因与鸡胚致死之间的关系,发现毒力基因表达频率越高,胚胎死亡率越高,而最能评估胚胎死亡率的基因是iucD,本试验分离的大肠杆菌检测出iucD,提示该分离株可能引起较高的胚胎死亡率。fimC 基因编码 I型 菌毛,主要在协调菌毛装配及细菌致病过程中起作用。iss 位于ColV质粒上,是外膜蛋白的组成成分,iss 基因不仅能使大肠杆菌对 1 日龄雏鸡的致病力显著增强,还能增强转化菌的血清抗性,所以iss基因常作为大肠杆菌毒力基因的参考指标[14-15]。试验中的分离株检测出fimC和iss,提示分离株对 1 日龄雏鸡的致病力较强。ompA编码肠外致病性大肠杆菌的结构蛋白,ompA基因能增强菌株的抗血清杀菌能力,还有助于菌株进入脑膜引发感染,增强菌株的生存力和致病性[16]。试验中分离株携带ompA,提示分离株致病性和生存力较强。
