白蛋白紫杉醇与五氟尿嘧啶联合用药对人胃癌细胞增殖及周期的影响*
2021-12-14成兴真杨芳王杨聂微刘泽莹王黔严芝强
成兴真,杨芳 ,王杨,聂微,刘泽莹,王黔,严芝强**
(1.贵州医科大学 外科学教研室,贵州 贵阳 550004;2.贵州医科大学 医学检验学院 临床血液教研室,贵州 贵阳 550004;3.贵州医科大学附属医院 临床检验中心,贵州 贵阳 550004;4.贵州医科大学附属医院 胃肠外科,贵州 贵阳 550004)
白蛋白紫杉醇(albumin-bound paclitaxel,Nab-PTX)是一种新型无溶剂的紫杉醇(paclitaxel,PTX)纳米制剂,具有微管抑制剂的作用,其抗肿瘤原理是通过促进微管蛋白聚合以及稳定微管导致肿瘤细胞停滞在 G2-M 期,最终导致有丝分裂细胞死亡[1-2]。目前Nab-PTX已广泛用于乳腺癌、肺癌和胰腺癌等肿瘤的治疗,但日本胃癌治疗指南(最新版)指出 Nab-PTX可用于胃癌治疗[3],发现在可切除胃癌的围手术期、腹膜转移、进展期胃癌、不可切除及复发性胃癌等的治疗中均表现出较好疗效[4-7],且国内将 Nab-PTX应用于胃癌治疗的临床报道也表明 Nab-PTX抗肿瘤效果良好[8-13]。五氟尿嘧啶(5-fluorouracil,5-Fu)作为各大指南推荐的胃癌一线化疗药[3,14-15],其作用机制为抑制胸腺嘧啶核苷酸合成酶,从而阻断脱氧嘧啶核苷酸转换为胸腺嘧啶核苷酸,从而发挥抗肿瘤作用[16]。目前关于Nab-PTX联合5-Fu对胃癌细胞的研究较少,且尚无研究表明Nab-PTX联合5-Fu对胃癌细胞周期的作用影响,因此本研究通过研究Nab-PTX联合5-Fu对胃癌细胞(AGS)增殖及周期的影响,为胃癌用药提供新的参考。
1 材料与方法
1.1 主要材料与仪器
1.1.1细胞、试剂及药物 胃癌细胞株AGS购于中国科学院细胞库,RMPI 1640、PBS缓冲液、普通胰酶(含EDTA)及不含EDTA胰酶、胎牛血清均购于Biological Industries(BI,以色列),Cell Counting Kit-8购于Dojindo Laboratories(日本),流式细胞周期检测试剂盒购自Becton,Dickinson and Company(BD,美国),Nab-PTX购自江苏恒瑞医药股份有限公司,5-Fu购自天津金耀药业有限公司。
1.1.2主要仪器 流式细胞仪Canto II plus (美国,Becton,Dickinson and Company)、酶标仪Varioskan LUX (美国,Thermo scientific)。
1.2 方法
1.2.1细胞培养 采用含10%胎牛血清的 RMPI 1640 完全培养基培养细胞株AGS,并置于含 5% CO2的湿润空气以及37 ℃的恒温培养箱中培养;胰酶(含EDTA)消化处于对数生长期的细胞,用完全培养基重悬成细胞单悬液,进行传代培养。
1.2.2CCK-8法检测细胞增殖情况 将处于对数生长期的AGS 细胞以 1×104/孔接种于96孔板中,每孔加入200 μL完全培养基。24 h后去除培养基,PBS洗涤3次并向Nab-PTX组加入 Nab-PTX(浓度梯度为0.1、0.2、0.4 μmol/L),5-Fu组加入5-Fu(浓度梯度分别为1、2、4 μmol/L),Nab-PTX+5-Fu组加入Nab-PTX+5-Fu[浓度梯度分别为(0.1+1)、(0.2+2)、(0.4+4)μmol/L],各200 μL,将只含200 μL RMPI 1640培养基的对数生长的AGS细胞作为对照组(Ctrl组),仅含200 μL RMPI 1640 培养基(不含AGS细胞)作为空白组。每组设置5个复孔,分别培养24 h、48 h、72 h后,去原培养液;用 PBS 洗涤3次,加入100 μL的 RPMI 1640 培养液、每个孔10 μL CCK-8 溶液,在 37 °C 含 5 % CO2孵箱孵育1.5 h,使用酶标仪在吸光度为 450 nm 波长处测量吸光度。实验重复3次,计算细胞增殖存活率=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.2.3流式细胞术分析细胞周期 取 2×105个对数期的AGS细胞,接种于6孔板中,待生长至80%时,分别加入 Nab-PTX(0.2 μmol/L)、5-Fu(2 μmol/L)、Nab-PTX+5-Fu[(0.2+2)μmol/L];培养细胞24 h,用预冷PBS洗涤3次,加入不含 EDTA 的 0.25% 胰蛋白酶消化,离心后收集细胞;收集细胞后加入 4 ℃ 预冷的70%乙醇固定24 h,1 000 r/min离心后去上清,使用预冷 PBS 洗涤细胞 3 次,后加入 500 μL Staining Buffer、25 μL PI、10 μL RNA 酶,避光 37 ℃ 水浴 30 min 后上机检测,计算每组细胞所处G0/G1、S以及G2/M期的比例,评估每组细胞的周期阻滞情况,实验重复3次。
1.3 统计学分析
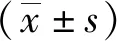
2 结果
2.1 细胞增殖
培养72 h时,与Ctrl组比较,Nab-PTX组(0.4 μmol/L)、5-Fu组(2、4 μmol/L)及Nab-PTX+5-Fu组[(0.1+1)、(0.2+2)、(0.4+4)μmol/L]细胞存活率降低,差异有统计学意义(P<0.05);结果显示,与Ctrl组比较,同一时间点(培养72 h)不同浓度的Nab-PTX组、5-Fu组、Nab-PTX+5-Fu组细胞存活率增殖能力均受到抑制,且随浓度增加,细胞增殖存活率下降。同一浓度[Nab-PTX组(0.2 μmol/L)、5-Fu组(2 μmol/L)、Nab-PTX+5-Fu组(0.2+2)μmol/L]不同作用时间,各组细胞的存活率随着时间的延长而下降,其中培养24 h时的Nab-PTX组和Nab-PTX+5-Fu组,培养48 h 时的5-Fu组和Nab-PTX+5-Fu组,培养72 h 时的3组与对应时点的Ctrl组相比,差异有统计学意义(P<0.05)。提示Nab-PTX、5-Fu、Nab-PTX+5-Fu抑制AGS细胞的增殖具有剂量-时间依赖性,Nab-PTX+5-Fu组较Nab-PTX组、5-Fu组能更有效抑制AGS细胞的增殖。见图1。
注:A为 Nab-PTX、5-Fu、Nab-PTX+5-Fu不同浓度作用72 h对AGS细胞增殖能力的影响变化;B为Nab-PTX(0.2 μmol/L)、5-Fu(0.2 μmol/L)、Nab-PTX+5-Fu(0.2+2 μmol/L)作用不同时间对AGS细胞增殖能力的影响变化;(1)与Ctrl组相比,P<0.05。图1 各组AGS细胞抑制率(CCK-8)Fig.1 Cell inhibition rates of AGS in each group (CCK-8)
2.2 细胞周期
流式细胞术检测细胞周期结果显示:各组处理24 h后,与Ctrl组相比,5-Fu组G0/G1期比例明显减少、S期比例明显增加,Nab-PTX组及Nab-PTX+5-Fu组G2/M期比例明显增加,组间对比差异具有统计学意义(P<0.05);与Ctrl组相比,Nab-PTX组及Nab-PTX+5-Fu组G0/G1期比例明显减少,Nab-PTX+5-Fu组S期比例明显增加,5-Fu组G2/M期比例明显减少,组间对比结果极具有统计学意义(P<0.01)。由此可见,Nab-PTX组使AGS细胞周期阻滞在G2/M期,5-Fu组使细胞周期阻滞于S期,Nab-PTX+5-Fu组使AGS细胞周期阻滞在S期,且Nab-PTX+5-Fu组S期比例较5-Fu组增加,G2/M期较Nab-PTX组明显减少。见图2。
3 讨论
目前胃癌的物治疗仍以化疗或新辅助化疗为主,当前各大指南推荐的化疗药物主要为5-Fu及其衍生物、铂类、PTX及其衍生物等,而化疗药物的耐药性成为胃癌有效治疗的主要障碍[17]。实验研究及临床试验表明Nab-PTX在胃癌治疗中有明显作用[7,18-19 ],作为PTX制剂衍生物,Nab-PTX的抗肿瘤机制主要是诱导和促进微管蛋白聚合,抑制其解聚,进而有效抑制细胞有丝分裂过程中纺锤体及纺锤丝的形成,故导致肿瘤细胞发育在G2-M期受到阻滞和在有丝分裂时发生死亡,从而发挥抗肿瘤作用。与PTX相比,Nab-PTX的优势在于不仅完全避免了激素脱敏处理,还改变了体内药代动力学特征、提高了患者的耐受剂量,提高药物在肿瘤组织中蓄积[20-21]。一项三期临床试验结果表明,Nab-PTX每周1次用药的生存率不逊于PTX每周1次用药的生存率,这种优势使其成为胃癌二线治疗的潜在方案[19]。
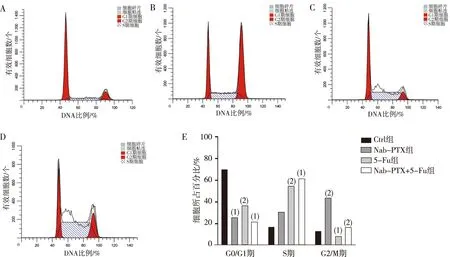
注:A为Ctrl组AGS细胞,B为Nab-PTX组AGS细胞,C为5-Fu组AGS细胞,D为Nab-PTX+5-Fu组AGS细胞,E为各组AGS细胞24 h结果统计图;与Ctrl组相比,(1)P<0.01,(2)P<0.05。图2 Nab-PTX、5-Fu、Nab-PTX+5-Fu作用24 h对AGS细胞周期的影响Fig.2 The effects of Nab-PTX,5-Fu ,and Nab-PTX+5-Fu treatment for 24 h on AGS cell cycle
有研究表明,从3例胃癌患者手术标本建立的人胃癌器官模型的研究中,Nab-PTX半数抑制率(IC50)明显低于5-Fu及表柔比星,且随着 Nab-PTX作用时间增加,肿瘤细胞的凋亡率明显增加,Nab-PTX具有较强的抗肿瘤活性,可望成为治疗GC患者的一线药物[22];研究还发现,Nab-PTX较5-Fu更能抑制肿瘤细胞增殖,且同样表现出随作用时间增加抑制率增加的现象。在本研究中发现,Nab-PTX联合5-Fu作用于胃癌细胞,诱导细胞凋亡率高于 Nab-PTX、5-Fu单独应用时;且有研究证实,在胰腺癌细胞中,吉西他滨和 Nab-PTX联合作用,可增强两种药物的细胞毒性作用,从而降低其剂量,减少不良反应的发生[23]。由此推测,在将来胃癌的临床治疗中,Nab-PTX联合5-Fu较 Nab-PTX或5-Fu单药有更好的抗肿瘤作用。
众所周知,细胞周期须经历DNA合成前期(G1期)、DNA合成期(S期),DNA合成后期(G2期)以及细胞有丝分裂期(M期),这些过程又可以划分为DNA复制与染色体分裂两个部分,而在整个增殖过程中,有着严密精确的调控机制,如CDKs正向调节细胞周期,同时CDKs依赖cyclins,cyclinD与CDK4/6结合在G1期末期发挥作用,细胞由G1期过渡到S期则需cyclinE与CDK2结合[24],CDK2与cyclinB结合将促使细胞从S期进入G2期,进入M期则需要cyclinA与CDK1结合。在细胞周期中,生长因子发挥着重要作用,但同时细胞周期也受到CKIs的反向调控作用,其发挥作用的机制主要是抑制CDKs与cyclins的结合。细胞周期的正常进行,需在CDKs、cyclins、CKIs共同协调下完成,其监控途径又主要由在G1期向S期转化起首要作用的pRb和DNA损伤检查点上的p53发挥作用[25-27]。在胰腺癌细胞的研究中发现,Nab-PTX与吉西他滨联用增强了细胞在S期的积累,由于在S期积累的细胞增加,导致G2期细胞的急剧减少[23]。同时通过对细胞周期信号蛋白的检测,发现cyclinD1水平不受治疗影响,而吉西他滨单独或与 Nab-PTX联合使用后,cyclinA2和cyclinE2水平升高。Nab-PTX联合吉西他滨与吉西他滨单独用药相比,其cyclinB1的表达降低[23]。而cyclinB1参与S-G2细胞周期转变[25],由此也佐证了联合用药G2/M期细胞的减少。由此推测 Nab-PTX似乎干扰细胞S期的早期阶段。本研究证实,Nab-PTX能将 AGS细胞株的细胞周期阻滞在G2/M期、5-Fu细胞周期阻滞发生在S期、Nab-PTX联合5-Fu使细胞周期阻滞则发生在S期;相较于5-Fu单药,Nab-PTX联合5-Fu能使更多细胞阻滞于S期,由此推测Nab-PTX联合5-Fu作用于胃癌细胞,一方面可能通过激活cyclinA2和cyclinE2表达 ,使细胞阻滞在S期;Nab-PTX还可加强5-Fu对DNA的损伤作用,激活p53抑制CDK2与cyclinB,Nab-PTX同时激活Rb,使细胞周期不能顺利进入M期[27]。
综上所述,Nab-PTX与5-Fu联合用药不仅能有效抑制细胞增殖,其抑制细胞增殖随剂量及时间增加而增加,研究结果可为 Nab-PTX广泛应用于胃癌治疗提供数据参考,而 Nab-PTX与5-Fu联合用药使细胞周期阻滞在S期,但其潜在机制有待进一步探索。
