不同曲霉感染大蜡螟幼虫模型的构建及曲霉毒力评价*
2021-12-14杨碧刘翔张明山田询江银辉
杨碧,刘翔,张明山,田询,江银辉*
(1.贵州医科大学 分子生物学重点实验室,贵州 贵阳 550004;2.贵州医科大学 地方病与少数民族疾病教育部重点实验室,贵州 贵阳 550004)
自20世纪80年代以来,侵袭性真菌感染(invasive fungal infections,IFI)的发病率在全球范围内发生了一些变化,以往常见的白念珠菌感染表现出下降趋势,而由烟曲霉和黄曲霉菌导致的侵袭性曲霉病的发病率呈上升趋势[1-4]。构建曲霉菌感染模型是研究曲霉病的前提条件,目前常见的用于构建曲霉感染的动物模型有大鼠、小鼠及兔等[5],这些动物模型不仅成本高、还存在伦理问题,故而阿米巴变性虫、线虫、果蝇及大蜡螟幼虫成为了最常见的替代模型[6-7]。大蜡螟(GalleriamellonellaL.)为鳞翅目螟蛾科蜡螟亚科蜡螟属昆虫,其幼虫免疫系统由细胞免疫和体液免疫构成,与哺乳动物相似[8];吞噬细胞介导幼虫的细胞免疫,体液免疫应答包括虫体黑化、调理素和抗菌肽的产生,其中黑化是由于幼虫黑色素的形成以及沉积造成的[9]。此外,大蜡螟幼虫繁殖能力强,生长周期短,容易饲养,无自残性,实验操作简单,且无需伦理审查[10-11]。故而,大蜡螟是一个合适的昆虫模型[12]。目前,研究人员多用大蜡螟感染模型检测抗真菌、抗细菌类药物药效及菌株耐药性等[13-14],而对曲霉菌株间毒力检测及比较的报道较少。因此,本研究利用大蜡螟幼虫构建烟曲霉和黄曲霉感染模型,用于评价曲霉致病力,为研究针对病原体的免疫反应和评估抗真菌药物的效果等实验提供技术基础。
1 材料和方法
1.1 实验材料
1.1.1菌株和昆虫 烟曲霉菌株ygy来源于病人脑脊液,黄曲霉菌株LD-F来源于呼吸科病房空气;大蜡螟幼虫120条,体质量为200~280 mg/条,老熟幼虫,通体为浅黄色、无斑点,购自天津惠裕德生物科技有限公司,置于37 ℃黑暗环境培养。
1.1.2主要试剂和仪器 LEICA DM500显微镜和生化培养箱(天津赛得利斯),恒字PYX-DHS隔水式电热恒温培养箱,GENESPEED 1730R离心机、磷酸盐缓冲液(phosphate buffered saline,PBS)、吐温-80及Neubauer血细胞计数板(北京索莱宝),微量注射器(上海安亭)。
1.2 实验方法
1.2.1马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)制备 称取马铃薯200 g、葡萄糖200 g及琼脂粉13 g,蒸馏水加至体积1 000 mL,121 ℃灭菌20 min。
1.2.2菌悬液制备 将烟曲霉ygy和黄曲霉LD-F分别接种于PDA培养基上,30 ℃培养5 d,含0.1%吐温80的PBS 10 mL冲洗PDA培养基表面的菌丝,灭菌的擦镜纸过滤,收取曲霉孢子;所得滤液8 000 r/min离心10 min,弃上清,PBS再次重悬,8 000 r/min离心10 min,血细胞计数板计数;根据实验要求调整曲霉分生孢子的质量浓度为1×108CFU/L(低剂量组)、1×109CFU/L(中剂量组)及1×1010CFU/L(高剂量组)。
1.2.3实验分组 60条大蜡螟幼虫随机均分为6组,每条幼虫参考文献[15]方法注射烟曲霉ygy和黄曲霉LD-F孢子悬液高、中、低不同剂量各10 μL,每5条幼虫装于铺有滤纸的9 cm干净培养皿中;60条大蜡螟幼虫随机均分为6组,对应于2种曲霉各设置3种形式对照,即空白对照(untouched larvae,UTC)组(不做任何处理)、穿刺(pierced larvae,PC)组(微量注射器穿刺但不注射PBS)及PBS组(注射接种PBS 10 μL )。
1.2.4建立模型 参考文献[16]方法建立感染模型,即70%乙醇浸泡棉球清洗感染组和对照组幼虫的右侧尾足区,固定幼虫,微量注射器1×108CFU/L、1×109CFU/L及1×1010CFU/L 孢子悬液分别取10 μL注入相应剂量组的大蜡螟虫体内;大蜡螟幼虫置于37 ℃培养箱黑暗环境培养,监测5 d,每天记录大蜡螟幼虫体表颜色变化、应对刺激反馈及存活情况,当大蜡螟幼虫对外界刺激持续无反应时认为已死亡;黑化的幼虫死亡,再结合以下病理组织切片观察可判断模型构建是否成功。
1.2.5病理组织切片 高剂量组大蜡螟幼虫感染48 h后,取UTC组和此时死亡的大蜡螟幼虫,从幼虫尾部纵向切开虫体,约1 cm,浸泡于4%多聚甲醛72 h;将固定的幼虫包埋于石蜡中,切片,苏木精和伊红(haema eosin,HE)染色,对幼虫进行病理学检查;切片进行六铵银染色,观察大蜡螟幼虫体内菌丝形成情况。
1.3 统计学分析
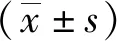
2 结果
2.1 大蜡螟幼虫感染状态
烟曲霉接种24 h后,各剂量组大蜡螟幼虫开始出现黑化并死亡,未死亡的幼虫对外界刺激反应迟钝,但每条幼虫的黑化程度与接种孢子悬液质量浓度无明显相关;UTC组、PC组和PBS组大蜡螟幼虫无死亡,通体呈浅黄色、无色斑,行动活跃,应对所受外界刺激反应灵敏。黄曲霉接种24 h后,高剂量组大蜡螟幼虫开始出现黑化并死亡,低剂量组与中剂量组幼虫无死亡,但多数幼虫在应对外界刺激时反应微弱;黄曲霉接种48 h后出现大量幼虫黑化后死亡,其黑化程度无规律;UTC组、PC组和PBS组大蜡螟幼虫无死亡,外观无明显变化,应对所受外界刺激反应灵敏。见图1。

图1 各组大蜡螟幼虫干预48 h后的一般状态Fig.1 The general status of G. mellonella larvae in each group after 48 h intervention
2.2 体腔组织的病理特征
高剂量烟曲霉组和高剂量黄曲霉组大蜡螟幼虫接种曲霉孢子悬液后,虫体均发生黑化、死亡,HE切片可见幼虫体腔结构遭到破坏,但UTC组幼虫体腔结构完整;六铵银染色切片可见烟曲霉高剂量组和黄曲霉高剂量组幼虫体腔内有真菌菌丝团,但UTC组幼虫体腔无真菌菌丝着色。见图2。
2.3 存活率
烟曲霉接种24 h时,低、中、高剂量组大蜡螟幼虫存活率分别为80%(8/10)、90%(9/10)及90%(9/10);接种48 h和72 h时,3组大蜡螟幼虫存活率分别为70%(7/10)、90%(9/10)、20%(2/10)和70%(7/10)、70%(7/10)、0%(0/10);接种96 h时,低、中剂量组大蜡螟幼虫存活率分别为60%(6/10)、30%(3/10);接种120 h时,低、中剂量组大蜡螟幼虫存活率分别为60%(6/10)和10%(1/10);UTC组、PC组及PBS组大蜡螟幼虫存活率为100%(10/10);对照组与感染组存活率差异有统计学意义(P<0.000 1)。接种孢子质量浓度越高存活率越低,低剂量组、中剂量组及高剂量组存活率差异有统计学意义(P=0.000 8)。黄曲霉接种24 h时,低剂量、中剂量组大蜡螟幼虫存活率均为100%(10/10),但高剂量组为80%(8/10);接种48 h时,低剂量组大蜡螟幼虫存活率为80%(8/10),中剂量、高剂量组的存活率为0%(0/10);接种72 h时,低剂量组大蜡螟幼虫存活率为70%(7/10);96 h后,低剂量组的存活率为70%(7/10);接种120 h时,低剂量组大蜡螟幼虫存活率为70%(7/10);UTC组、PC组及PBS组大蜡螟幼虫存活率为100%(10/10),对照组与感染组存活率差异有统计学意义(P<0.000 1)。接种孢子质量浓度越高存活率越低,低、中及高剂量组大蜡螟幼虫存活率差异有统计学意义(P<0.000 1)。见图3。
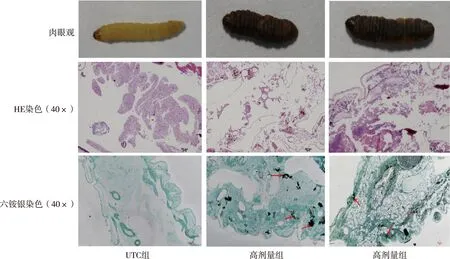
注:图中红色箭头所指为真菌菌丝团。图2 各组大蜡螟幼虫感染48 h后死亡虫体的组织病理特征Fig.2 Histopathological characteristics of dead worms in each group of G.mellonella larvae 48 h after infection
3 讨论
大蜡螟属于昆虫,有卵、幼虫、蛹及成虫4个发育阶段,幼虫的老熟阶段常用于构建感染模型[17]。与线虫相比而言,昆虫的抗菌防御系统相对高级,因免疫系统的差异,昆虫模型与哺乳动物模型的研究结果也存在着一定的差异[18]。但多项研究表明,大蜡螟幼虫作为一种昆虫模型,大部分研究结果与哺乳动物模型有正相关性[19-20],如Brennan等[21]研究表明,白念珠菌突变体的毒力在大蜡螟幼虫与Balb/C 小鼠体内中的测定结果一致。大蜡螟幼虫最初是作为一种用于研究酵母菌感染的体内模型,目前已被广泛的应用于各种微生物的研究[22-24]。大蜡螟被广泛应用的原因在于其能于37 ℃下生长繁殖,符合人类病原体研究的重要的特征。在生物基因组的研究中,大蜡螟有许多与人类基因同源物编码产物参与病原体的识别或信号转导[25-27]。
研究认为大蜡螟幼虫的黑化是由于血淋巴中酚氧化酶的激活造成,在昆虫抵御各种病原体过程中至关重要,也是幼虫免疫反应的一部分,感染幼虫的黑化表现为斑驳的灰色到均匀的黑色外观,其程度具体取决于感染的菌株[28-30]。但目前尚无研究证实大蜡螟的黑化与所感染真菌的毒力及幼虫的载菌量有直接相关性[31]。本研究结果表明,烟曲霉和黄曲霉感染大蜡螟幼虫后,幼虫出现黑化、死亡,2种菌株相同剂量感染导致的黑化的程度无明显差异,同一菌株但不同接种剂量感染导致的幼虫黑化程度也无明显相关,同一个处理的感染幼虫黑化程度情况有少许差异。
此前,大量研究表明,烟曲霉菌是引起曲霉病的第一大病原菌,黄曲霉菌次之[32-33]。本研究结果提示,大蜡螟幼虫可以承受较低的曲霉菌感染剂量,接种烟曲霉时低剂量组大蜡螟幼虫最终的存活率为60%,接种黄曲霉时低剂量组大蜡螟幼虫的最终存活率为70%,说明存活的大蜡螟幼虫产生了抗曲霉的免疫应答,故而可以抵抗低剂量曲霉感染。但在最高剂量下,烟曲霉和黄曲霉都会导致大蜡螟幼虫大量死亡,说明幼虫免疫应答失败中、高剂量组黄曲霉可以较短时间内杀死大蜡螟幼虫,而烟曲霉所用时间稍长,但低剂量烟曲霉的存活率比黄曲霉低,此致病机理有待进一步研究。在病理组织切片观察中,低倍镜下可见烟曲霉感染大蜡螟幼虫模型多处菌丝团,HE及六铵银染色切片均表明烟曲霉感染后引起大蜡螟幼虫体腔结构的破坏程度更严重。根据此结果推断,烟曲霉和黄曲霉菌的毒力存在明显不同,但2种曲霉菌接种引起的死亡率均有孢子悬液质量浓度依赖性,与既往研究结果一致[34]。因此,本研究对曲霉毒力评价的研究表明了该模型的可靠性和实用性,提示大蜡螟幼虫可以作为构建曲霉感染的模型。
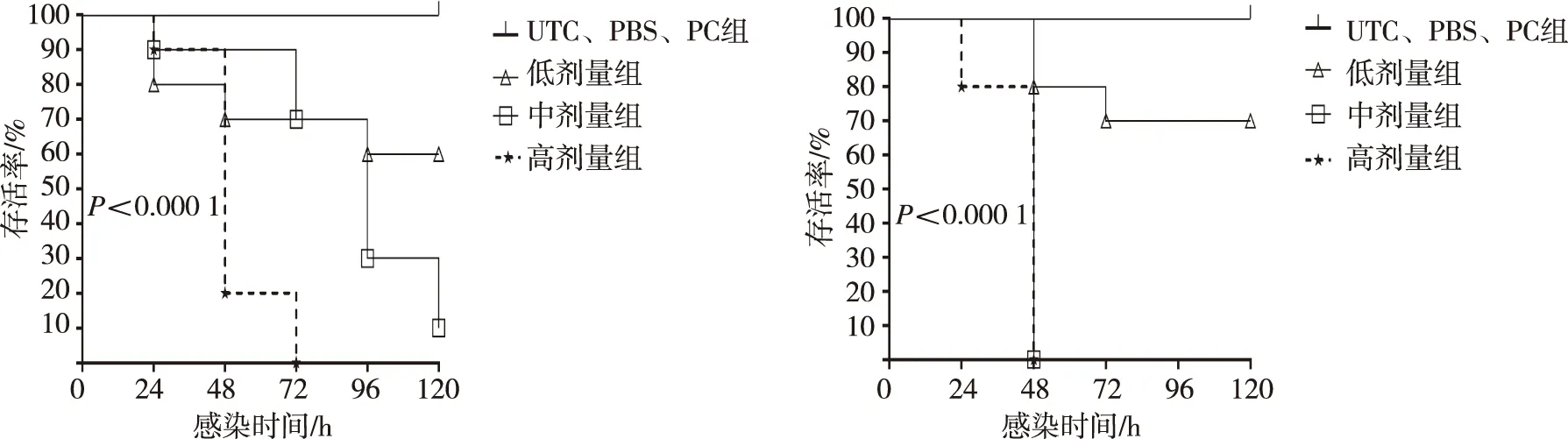
烟曲霉感染 黄曲霉感染图3 不同曲霉感染120 h时各组大蜡螟幼虫的存活情况Fig.3 Survival curves of the G. mellonella larvae in each group after 120 h intervention
综上所述,利用大蜡螟幼虫构建曲霉感染模型中,其死亡后黑化程度与曲霉毒力无相关性,但其存活率可以用于判断菌株毒力。大蜡螟幼虫可以快速稳定的评价曲霉的致病力,研究针对病原体的免疫反应和评估抗真菌药物的效果等实验提供技术基础,为研究曲霉感染提供了一种重要的体内模型选择。
