西地那非对野百合碱诱导的大鼠肺动脉高压中Notch- 1/Jagged- 1通路的影响研究
2021-12-14向贻佳蔡昌宏吴勇辉叶士勇赵欢曾春来
向贻佳 蔡昌宏 吴勇辉 叶士勇 赵欢 曾春来
肺动脉高压是一种以肺动脉压力升高、右心室肥厚及右心衰竭为特征的恶性血管疾病[1]。目前认为肺血管重塑在肺动脉高压病理发生发展中起着重要作用,其病理过程涉及肺小动脉内膜纤维化、中膜肥厚以及管腔狭窄[2-3]。其中Notch 信号通路在肺动脉重塑过程中起着重要作用[4-5]。研究已经证实西地那非能通过抑制磷酸二酯酶、发挥内皮保护作用等改善肺动脉高压[6-8]。基于Notch 信号通路及西地那非在肺动脉平滑肌细胞重塑中的作用,本文探讨西地那非对野百合碱诱导的大鼠肺动脉高压血管重塑过程中Notch-1/Jagged-1 信号通路的影响,现将结果报道如下。
1 材料和方法
1.1 实验动物和试剂 选择雄性SD 大鼠(年龄6~8 周,体重250~300 g)42 只,购于浙江省医学科学院实验动物中心,饲养在无特定病原体级环境中,温度(21±1)℃,湿度(55±5)%,给予标准饮食及饮用水。野百合碱(C2401) 购自美国Sigma 公司,Notch-1 抗体(ab52627) 购自英国Abcam 公司、Hes-1 抗体(ab71559) 购自英国Abcam 公司、Jagged-1 抗体(ab7771) 购自英国Abcam 公司、α-SMA 抗体(ab5694) 购自英国Abcam 公司、GAPDH 抗体(5174S)购自美国Cell Signaling Technology 公司。
1.2 方法
1.2.1 动物造模及给药 42 只大鼠采用随机数字表法分成3 组,模型组16 只、西地那非组16 只及对照组10 只。模型组及西地那非组大鼠一次性背部皮下注射野百合碱溶液60 mg/kg 建立肺动脉高压模型,对照组背部皮下注射0.8 mL 0.9%氯化钠注射液。造模3 周后西地那非组予西地那非100 mg·kg-1·d-1灌胃,连续2 周,每周测体重1 次,根据大鼠体重调整西地那非用量(100mg·kg-1·d-1)。西地那非给药期间,模型组及对照组予等体积0.9%氯化钠注射液灌胃。
1.2.2 右心室收缩压(right ventricular systolic pressure,RVSP)及右心肥厚指数(right ventricular hypertrophy index,RI)测定 至给药第5 周末,存活大鼠用4%水合氯醛麻醉后固定,剪去颈部毛发,依次切开皮肤、皮下组织,分离右侧颈外静脉,结扎远心端,采用右心导管法,Medlab 生物信号记录仪记录RVSP。测压结束后,自右心室导管注入10%氯化钾溶液处死动物,分离心脏及肺。剪去心房,分离右心室和左心室+ 室间隔,分别称重,计算RI。RI= 右心室质量/(左心室质量+ 室间隔质量)。右肺置于4%多聚甲醛中固定,其余肺立即置于-80 ℃冰箱中保存。
1.2.3 肺组织肺小动脉病理检查 右肺组织在4%多聚甲醛中固定72 h 后,取右肺上叶组织经过不同浓度乙醇脱水、二甲苯透明及石蜡包埋,切成3~5 μm薄片。采用HE 和Masson 染色方法观察肺小动脉形态及纤维化情况。
1.2.4 Notch-1、Hes-1、Jagged-1 及α-SMA 表达水平的检测 取冰冻的肺组织100 mg (每组6 个样本),以冰PBS 漂洗3 次,剪成细小的碎片,按每20 mg 组织加入150~250 μL 裂解液的比例,加入含蛋白酶和磷酸酶抑制剂的组织细胞快速裂解液,采用匀浆器匀浆直至肺组织完全裂解。将裂解后的样品以4 ℃12 000 g 离心15 min,取上清液,用蛋白定量法进行蛋白质定量后贮存于-80 ℃冰箱。经过配胶(10%分离胶分离胶+ 浓缩胶)、上样(每孔蛋白80 μg)、电泳、转膜、化学发光检测靶蛋白条带,软件分析灰度值,与内参GAPDH 比较,得出靶蛋白Notch-1、Hes-1、Jagged-1 及α-SMA 相对含量。
1.2.5 肺小动脉中α-SMA 表达水平的检测 石蜡切片通过脱蜡、水化及PBS 漂洗后,随后进行抗原修复与阻断,孵育α-SMA 抗体及二抗,苏木素复染,清洗,脱水及封片。光学显微镜下观察肺小动脉染色情况。
1.3 统计学处理 采用Graph Pad Prism(vision 7.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用Tukey 检验。P<0.05为差异有统计学意义。
2 结果
2.1 3 组大鼠RVSP 及RI 比较 第5 周末,模型组、西地那非组及对照组存活大鼠分别为8、10、8只。3 组大鼠RVSP 及RI 比较见表1。
由表1 可见,模型组RVSP 和RI 均高于对照组,差异均有统计学意义(均P<0.01)。西地那非组RVSP 和RI 均低于模型组,差异均有统计学意义(均P<0.05)。
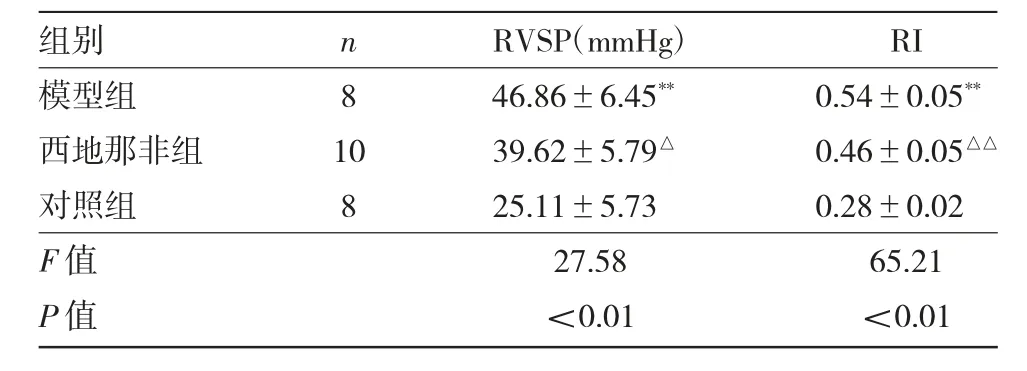
表1 3 组大鼠RVSP 及RI 比较
2.2 3 组大鼠肺小动脉病理检查结果比较 见图2(见封三)。
由图2 可见,HE 及Masson 染色显示,与对照组比较,模型组肺小动脉明显增厚、纤维化增加。西地那非组肺小动脉结构异常较模型组改善。
2.3 3 组大鼠肺组织中靶蛋白Notch-1、Hes-1 以及Jagged-1 表达比较 见图3。
由图3 可见,模型组Notch-1、Hes-1 及Jagged-1表达水平均高于对照组,差异均有统计学意义(均P<0.01)。西地那非组Notch-1、Hes-1 及Jagged-1表达水平均低于模型组,差异均有统计学意义(均P<0.05)。
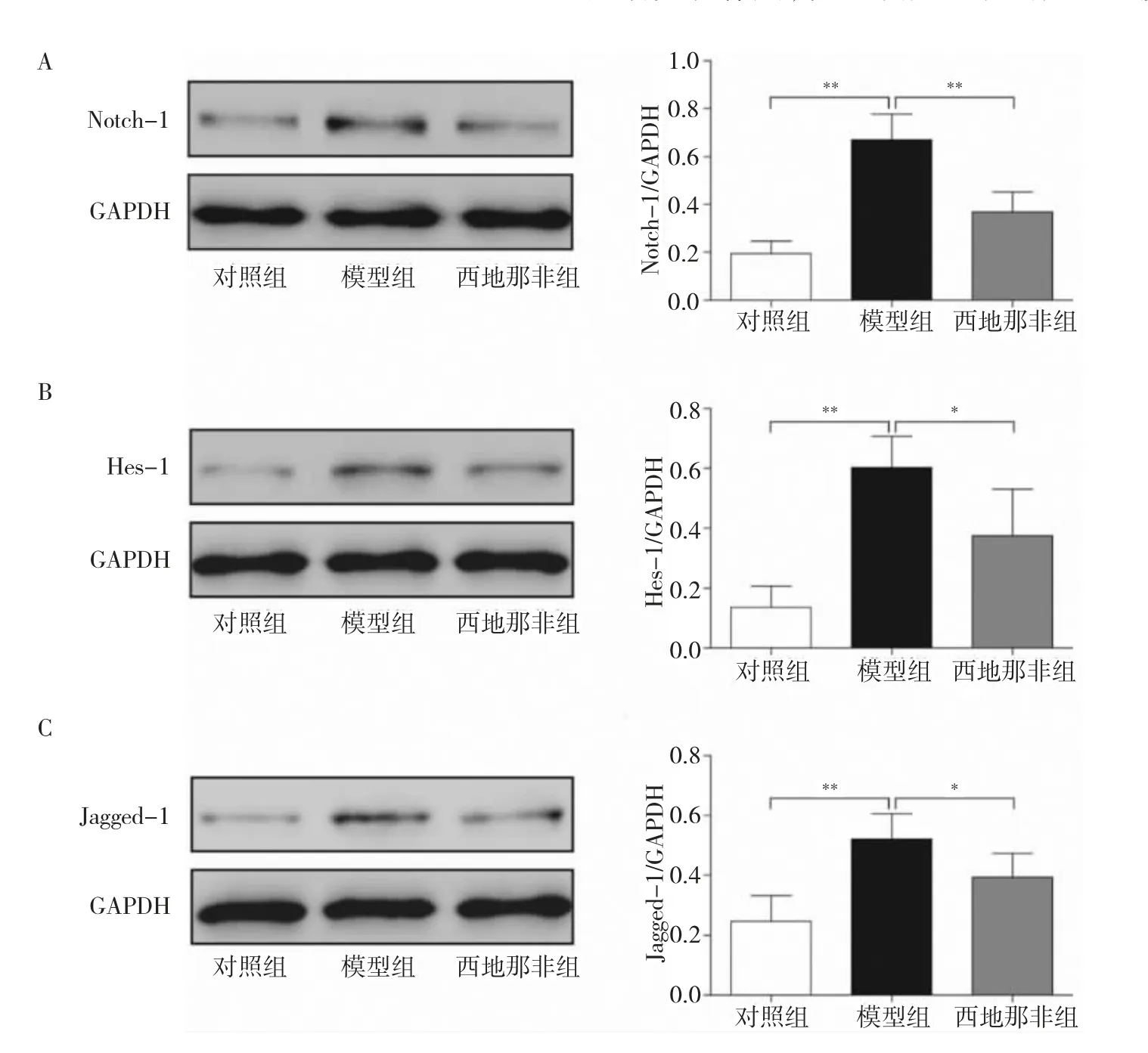
图3 3 组大鼠肺组织中靶蛋白Notch-1,Hes-1 以及Jagged-1 表达比较(A:3 组大鼠Notch-1、GAPDH 蛋白电泳图及Notch-1/GAPDH 柱状图;B:3 组大鼠Hes-1、GAPDH 蛋白电泳图及Hes-1/GAPDH 柱状图;C:3 组大鼠Jagged-1、GAPDH 蛋白电泳图及Jagged-1/GAPDH 柱状图;*P<0.05,**P<0.01)
2.4 3 组大鼠肺小动脉α-SMA 蛋白表达比较 见图4(见封三)。
由图4 可见,模型组α-SMA 表达水平高于对照组,差异有统计学意义(P<0.01)。西地那非组α-SMA 表达水平低于模型组,差异有统计学意义(P<0.01)。
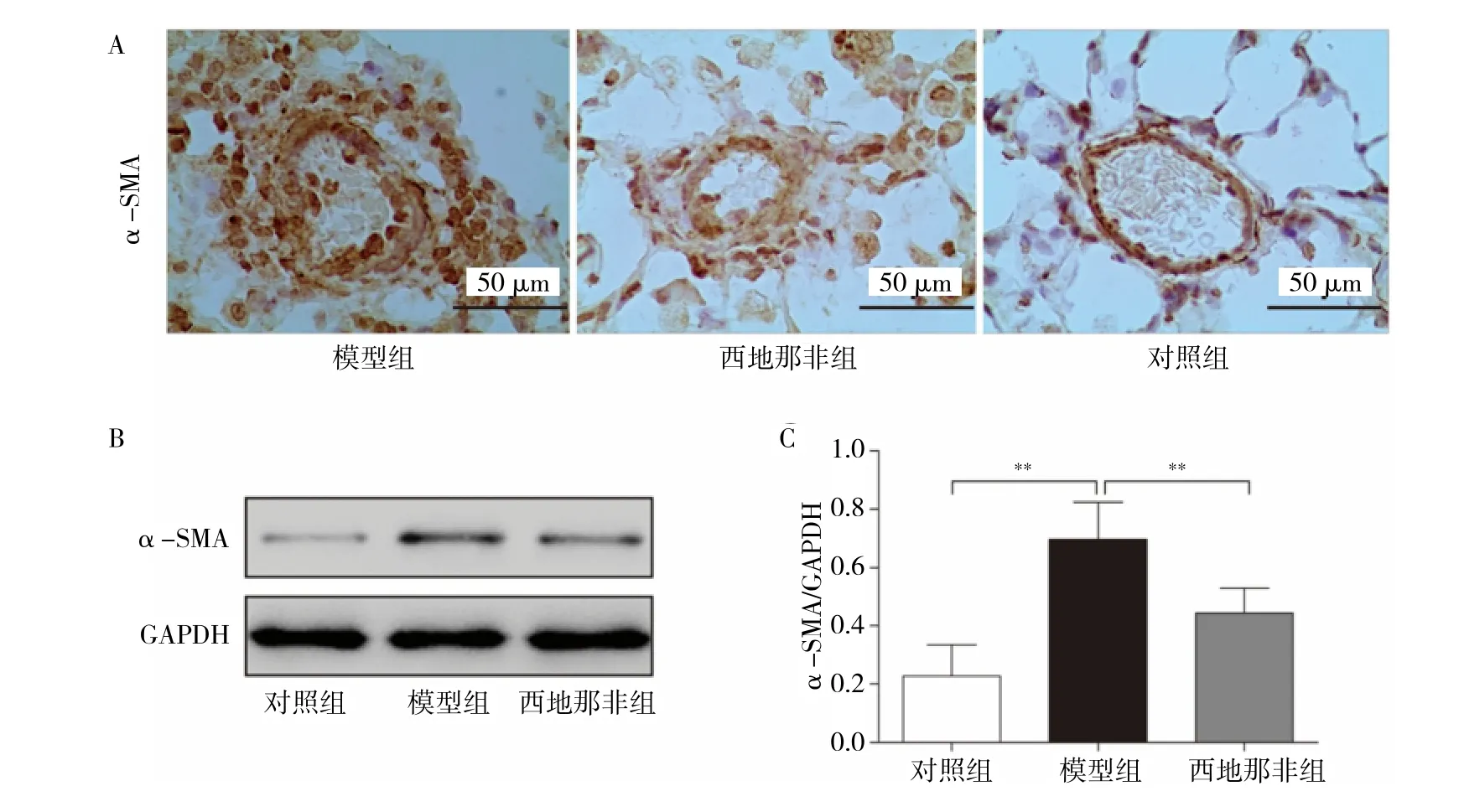
图4 3组大鼠肺小动脉α-SMA 蛋白表达比较(A:3 组大鼠肺小动脉α-SMA 免疫组化,×400;B:3 组大鼠α-SMA、GAPDH 蛋白电泳图;C:3 组大鼠α-SMA/GAPDH 柱状图;**P<0.01)
3 讨论
肺动脉高压是一种严重的恶性血管疾病,本研究采用皮下注射野百合碱溶液建立肺动脉高压模型。本研究结果表明,野百合碱注射5 周后RVSP 及RI 明显升高,提示成功建立野百合碱诱导的肺动脉高压模型。西地那非干预后,RVSP 及RI 明显下降,说明西地那非可改善肺动脉高压,研究结果与其他研究结果一致[9-12]。本研究还观察发现,建模后肺小动脉明显增厚、纤维化增加,而西地那非干预后上述表现得到改善。
目前已知肺血管重塑在肺动脉高压形成过程中起着关键作用,涉及细胞肥厚、增殖、迁移、凋亡及细胞外基质沉积等病理改变。多种细胞及细胞因子参与血管重塑。近年来,研究发现Notch 信号通路在细胞凋亡及血管重构中起着重要作用[13-16],且Notch 信号通路也参与了肺动脉高压形成病理过程[17-19]。Notch信号通路包括4 种受体(Notch-1、Notch-2、Notch-3、Notch-4) 和5 种 跨膜 配 体(Jagged-1、Jagged-2、Delta-like 1、Delta-like 2、Delta-like 3)[20-21]。研究表明,Notch 受体1、3 和4 以及配体Dll4、Jagged-1 和Jagged-2 在动脉系统中高度表达,对维持正常血管结构、凋亡及血管重构起着重要作用[16]。受体胞外区和相邻细胞上的配体结合导致受体构象改变,暴露蛋白水解酶切位点,Notch 胞内段经分解酶水解进入细胞核并与重组信号结合蛋白J 结合调节下游靶基因(Hes/Hey,ERBB2,Id 等),从而发挥作用。本研究发现野百合碱诱导的肺动脉高压模型Notch-1、Jagged-1 及Hes1 蛋白表达明显增加,西地那非可抑制上述蛋白的表达。此外,血管平滑肌中α-SMA 表达水平在肺动脉高压模型中明显升高,而西地那非干预后可抑制其表达。 本研究进一步证实Notch-1/Jagged-1 信号通路参与野百合碱诱导的肺动脉高压形成过程,而西地那非能够抑制野百合碱诱导的肺动脉高压中Notch-1/Jagged-1 信号通路。
综上所述,Notch-1/Jagged-1 信号通路在野百合碱诱导的肺动脉高压中活化,而西地那非能够抑制肺动脉高压中Notch-1/Jagged-1 信号通路,为西地那非用于治疗包括肺动脉高压在内的血管重构性疾病提供了实验基础。但本研究存在不足之处,西地那非是否通过Notch-1/Jagged-1 信号通路直接作用于肺动脉平滑肌细胞,从而抑制肺动脉重构仍有待进一步体内外实验证实。