降温毯不同预设温度对心脏外科术后患者降温效果及并发症的影响
2021-12-14王岩王哲芸叶家欣管艳余云卢山
王岩,王哲芸,叶家欣,管艳,余云,卢山
(南京大学医学院附属鼓楼医院心胸外科重症监护,江苏南京 210008)
体温>38℃,即中度发热,体温过高易引起心率增快、血压降低等一系列并发症,对心脏术后患者的影响尤为突出[1]。 由于心脏外科术中全麻、体外循环、血液降温与复温等原因诱发患者体温调节中枢功能紊乱,60%~70%的术后患者早期会有不同程度的发热[2-3]。为避免发热导致的体力过度消耗和重要器官损害,临床常规对中度发热患者进行物理降温[4]。然而,传统物理降温法如:局部冰袋冷敷,温水擦浴等不能提供持久有效的降温效果,降温毯的应用很好的解决了这一问题。 钟超超等[5]认为体外循环过程中快速降温对患者是有益的,可以减少患者乳酸(Lactic acid,Lac)生成;而陈丽等[6]发现快速降温会引发肌肉震颤,并带来胃肠道蠕动减缓等不良后果。 其中降温期寒颤的发生,表现为单个或多个肌群肌颤,导致耗氧量增加,加重心脏负荷,引起患者乳酸增加,对患者的循环系统、凝血功能及各器官代谢造成不同程度的负面影响[7-10]。陈丽[6]、刘桂英[10]等研究认为:不同的降温毯预设温度能产生同样的降温效果,但预设温度过低会增加中枢性高热(体温≥40℃)患者寒颤的发生率,这可能与毯温和患者自身体温差异过大有关。目前针对心脏外科术后当天患者降温期寒颤发生率的相关研究较少。因此,本研究观察使用降温毯在不同预设温度下对心脏外科术后当天发热患者的影响,旨在为进一步规范心脏外科术后发热患者体温管理提供参考。
1 对象与方法
1.1 研究对象 采用便利抽样法, 选取2019 年3月—2020 年3 月南京市某三级甲等医院的心脏术后患者为研究对象, 其中2019 年9 月—2020 年3 月的99 例患者为观察组,2019 年3—8 月的77 例患者为对照组。 纳入标准:(1)年龄≥18 周岁;(2)全麻下行开胸心脏手术;(3)术中进行体外循环;(4)心脏术后返回心脏外科监护室12 h 内膀胱温(Bladder temperature,T)≥38.5℃;(5)手术时间≤8 h 的患者。 排除标准:(1)合并除心脏病外的重大疾病;(2)术前有抗精神疾病药物使用史;(3)术前合并任何感染,包括尿标本、痰培养或者血培养阳性;(4)术前心脏射血分数<40%;(5)孕妇;(6)术后12 h 内纤维蛋白原<1.5 g/L;(7)术中二次体外循环或术后二次开胸;(8)有先天性骨骼肌肉疾病;(9)有恶性高热家族史;(10)术中降温时间>30 min 或复温时间>1 h 的患者。 2 组患者一般资料及使用降温毯前Wrench 评分(Wrench 评分1)、乳酸、膀胱温情况,见表1。
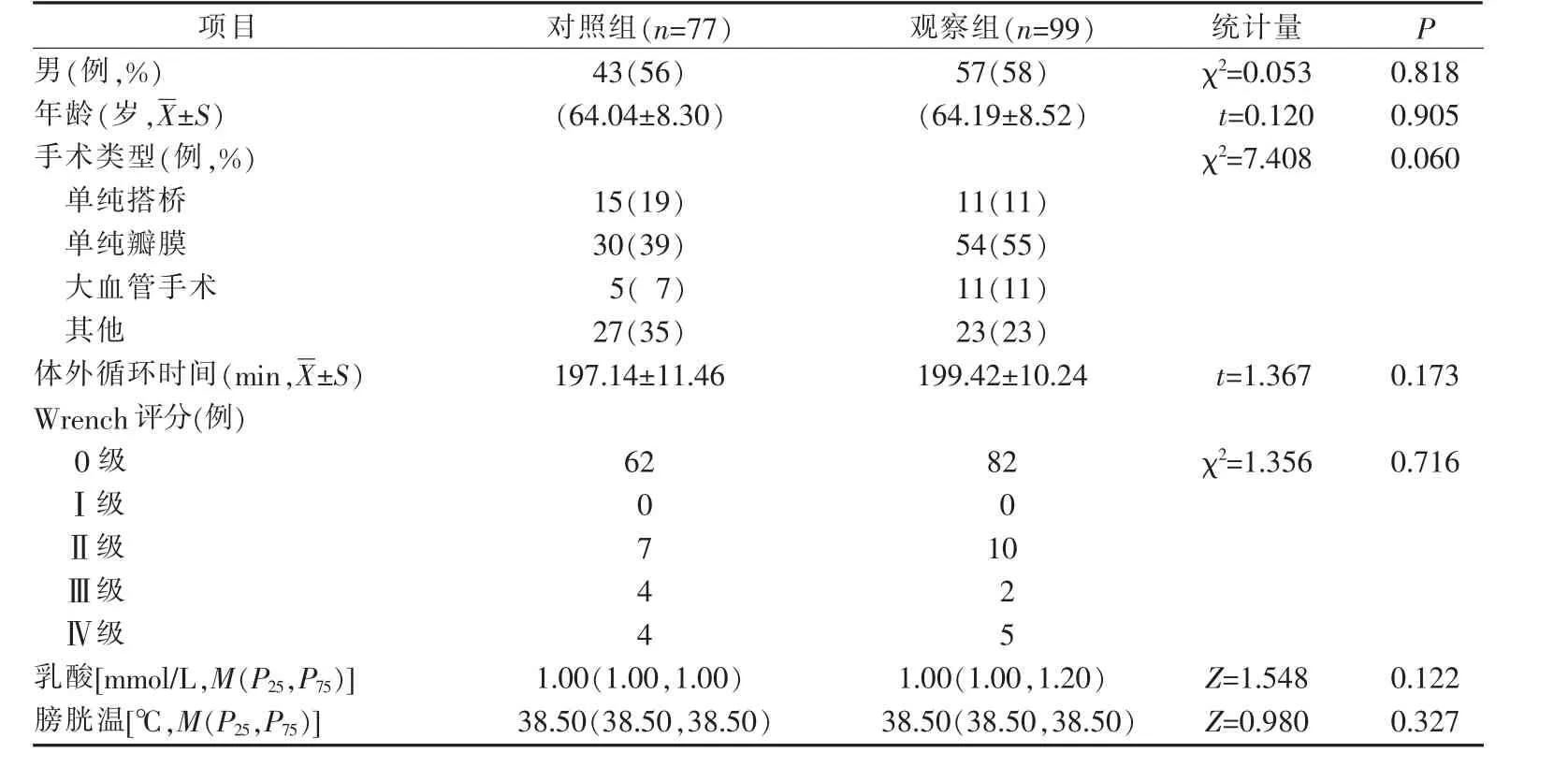
表1 2 组心脏外科术后患者一般资料
1.2 研究方法 2 组心脏外科术后患者物理降温操作者为10 名在心胸外科工作3 年以上的执业护士,均为本科学历, 操作前由医用变温治疗仪厂家的技术人员对护士进行仪器使用培训, 并由护士长和1 名危重症专科护士进行考核,考核合格后进行本研究的干预。
1.2.1 试验设备 使用同一品牌的医用变温治疗仪和与其配套的变温毯及测温导线。 为测量患者核心温度, 所有患者术中均留置同种型号测温型硅胶导尿管, 术毕回室后将末端接缆线连接至监护仪以持续显示膀胱温度。
1.2.2 干预方法
1.2.2.1 降温毯应用时机 (1)心脏外科患者术后当天(术后返回心胸外科监护室12 h 内),当体温在37.3℃~38.5℃, 对照组和观察组均予以传统物理降温(如减少盖被、冰袋冷敷)先减少盖被,30 min 后膀胱温无下降或持续升高,加以冰袋冷敷腋窝、股动脉和腘动脉,避开术中伤口;(2)患者术后当天(术后返回心胸外科监护室12 h 内),当体温≥38.5℃,对照组与观察组均停止传统物理降温,撤去冰袋,予以降温毯进行物理降温。 (3)设置预设水温:对照组为10℃,观察组为20℃。 (4)控制降温速度在0.5~1.0℃/h[11]左右,当患者体温≤37℃时或降温速度>1.0℃/h 时,即终止物理降温。
1.2.2.2 降温毯铺垫方式 心脏外科患者术后返回心胸外科监护室12 h 内,当体温≥38.5℃时,即由护士铺垫降温毯进行降温,本研究采用“三明治”法将变温毯包裹于被单中间以减轻患者降温过程中的不适:首先将纯棉被单对折,接着将变温毯放于被单中间,随后将其置于患者背部,这种方法一方面能够提高患者舒适度, 另一方面可以在为患者进行翻身的同时,避免降温毯移位,确保降温效果。 铺好降温毯后,将测温导线置于患者腋下并妥善固定后,连接至医用变温治疗仪,调节体温上限为39℃,体温下限为36℃。每2 h 协助患者翻身,翻身后确认测温导线在位,降温毯正常运作。
1.2.2.3 预设温度 本研究中使用的医用变温治疗仪采用二次水循环制冷技术, 通过温度传感器自动调节水温,液晶屏幕实时显示水温,使得降温毯表面温度误差≤±0.2 ℃,可提供持续恒温的降温效果。通过设定体温上下限,确保在降温过程中不会引起患者低体温。
1.2.2.4 体温监测方式 根据2017 年美国神经重症监护学会目标温度管理指南推荐[12],在没有肺动脉导管的情况下,可以使用膀胱温作为可靠的体温监测方式。将测温型硅胶导尿管上的测温探头连接监护仪后,膀胱温度将持续动态显示在监护仪上,且膀胱温度不易受外界温度影响,测量误差值≤±0.1 ℃[13]。
1.3 观察指标 由经过培训的管床护士记录干预后患者的各项指标,包括:寒颤强度、血乳酸、膀胱温及并发症。 (1)寒颤强度采用Wrench 寒颤评分[14]进行分级:0 级,无寒战;1 级,束毛和(或)周围血管收缩和(或)外周青紫,但无肌颤;2 级,仅一组肌群肌颤;3 级,肌颤超过一组肌群肌;4 级,全身肌颤。 Wrench 评分≥3 级定义为寒颤发生。 由管床护士记录患者使用降温毯前(Wrench 评分1),并在使用降温毯后每小时评估寒颤强度, 取使用降温毯4 h 内寒颤评分的最高值(Wrench 评分2)。 (2)血乳酸:由管床护士在使用降温毯前、后进行血气分析,记录使用降温毯前乳酸(Lac),使用降温毯后每2 h复查血气分析,病情变化时及时复查,取使用降温毯4 h 内乳酸最高值(Lacmax)(3)膀胱温:由管床护士记录使用降温毯前膀胱温(T0)和使用降温毯后4 h 内每小时膀胱温(T1、T2、T3、T4)。 干预过程中,若患者T≤37℃时,则终止物理降温,继续记录使用降温毯后4 h 内膀胱温。 (4)并发症:记录使用降温毯后4 h 内的寒颤发生率、胃肠功能紊乱、冻伤、心律失常。 胃肠功能紊乱包括:恶心呕吐、腹痛、腹泻;皮肤青紫发红纳入冻伤记录范围。
1.4 统计学方法 将所测得数据整理录入SPSS 22.0 进行分析,计数资料采用频数、百分比描述,计量资料采用±S 或中位数表示,其中T1、T2、T3、T4及体外循环时间满足正态分布采用独立样本t 检验,手术类型、寒颤评分及并发症采用χ2检验,乳酸、T0及属于非正态分布资料采用Mann-Whitney U 检验,比较组间差异,以P<0.05 表示差异具有统计学意义。
2 结果
2.1 2 组心脏外科术后患者使用降温毯后的寒颤评分、血乳酸、膀胱温比较 使用降温毯后,2 组4 h内Wrench 评分最高值(Wrench 评分2)、血乳酸最高值(Lacmax)和第1 小时、第2 小时膀胱温差异有统计学意义(P<0.05),第3 小时和第4 小时膀胱温差异无统计学意义(P>0.05),见表2。

表2 2 组心脏外科术后患者使用降温毯后寒颤评分、血乳酸和膀胱温比较
2.2 2 组心脏外科术后患者并发症发生率比较 使用降温毯后,2 组4 h 内寒颤发生率差异有统计学意义(P<0.05),胃肠功能紊乱、冻伤及心律失常发生率差异无统计学意义(P>0.05),见表3。
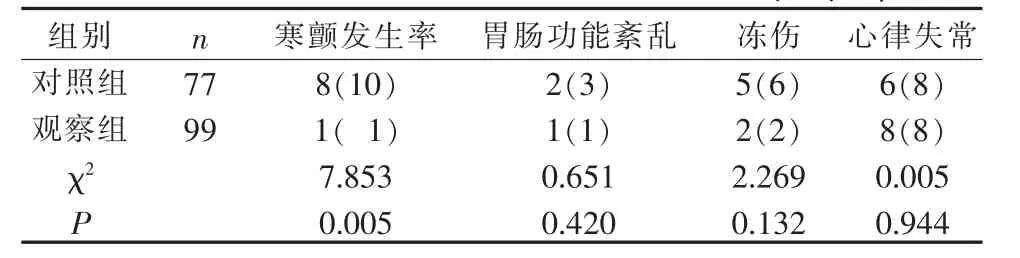
表3 2 组心脏外科术后患者并发症比较(例,%)
3 讨论
3.1 降温毯不同预设温度对于心脏外科术后发热患者具有相同的目标降温效果 2 组患者膀胱温均在使用降温毯后的第4 小时达到37 ℃左右。在使用降温毯后的第1 小时内, 观察组降温速度低于对照组,这与后者设置的降温毯预设温度低有关,设定预设水温后,降温毯存在水温下降的过程,此过程人体与降温毯传导散热效果逐渐增强,因此第1 小时内对照组降温速度较快。在第2 小时内,观察组降温速度高于对照组, 这与对照组寒颤发生率比观察组高有关,寒颤发生时人体骨骼肌及皮肤血管收缩,产热增加,散热减少,进而导致对照组患者降温速率减缓。在第3 小时至第4 小时内, 观察组和对照组的降温速度差异无统计学意义,这与陈丽等[6]研究是一致的。这提示在对心脏外科术后患者使用降温毯进行物理降温时,可以适当调高降温毯预设温度(20 ℃),以获得稳定的降温效果并提高患者舒适度。
3.2 较低的降温毯预设温度会增加心脏外科术后发热患者降温期寒颤的发生率 在进行干预后,观察组寒颤发生率明显低于对照组, 同时乳酸也较对照组低。陈丽[6]、刘桂英等[6,10]研究指出较低的降温毯预设温度(10 ℃)会导致患者降温期寒颤的发生,与本研究结果一致,分析原因,可能与降温毯预设温度低,体表温度高导致骨骼肌战栗有关,体温上升期由于血管扩张易出现血压下降, 且镇静镇痛药物会增加心脏术后患者循环系统和呼吸系统风险[15-16],故在物理降温的同时,患者较难获得充分的镇静镇痛。这难免会增加患者降温期不适感, 尤其当预设温度较低时,降温毯温度和体表温度差异较大,进而诱发降温期寒颤。寒颤会瞬时增加4~5 倍的机体耗氧量[17],引起乳酸增高,同时加重心脏负担,增加心肌缺血的发生率。 尽管预设较低的降温毯温度, 在降温期前1 h 降温效果较好,但由于降温期寒颤的发生,使得整体降温效果并不突出, 同时可能会增加心肌缺血的风险。而降温期寒颤的发生,有可能增加患者恐惧焦虑心理[18],这对于麻醉苏醒期的心脏外科患者是极其不利的。 因此,调高降温毯预设温度(20 ℃),一方面既可以保证降温效果, 又可以减少寒颤的发生,同时避免寒颤给机体带来乳酸升高等诸多并发症[19];另一方面可以提高患者舒适度。
3.3 2 种预设温度对心脏外科术后降温期患者并发症的影响 本研究结果显示在干预后,2 组患者胃肠道并发症无差异,分析原因,可能与患者术前禁食禁饮,术毕麻醉医师予以欧贝止吐有关;护士每2 h协助患者翻身,避免冻伤引起的压力性损伤[20],同时也减少局部皮肤受冷时间,故2 组患者冻伤并发症差异无统计学意义,但提示对照组冻伤并发症比例较高,这与对照组预设温度低于观察组有关。 心脏外科术后心律失常极其常见[21],手术打击、电解质异常以及氧合不足等因素均可引发心律失常[22],并不仅仅受单一体温因素影响,因此2 组患者心律失常并发症差异无统计学意义。陈丽[6]、刘桂英等[10]的研究中,降温毯预设温度最低5 ℃,最高25 ℃,推荐预设温度为15~20 ℃,当预设温度为5~9 ℃时,患者并发症显著增高,因此本研究中剔除了10 ℃以下的降温毯预设温度,加之护士每小时评估体温变化并通过设定体温上下限等方式,确保患者降温过程安全,若患者提前达到目标体温(体温<37 ℃),则终止物理降温,避免低体温的发生,仍记录应用降温毯后4 h 内的各项指标,进而可以比较2 组患者降温后反跳情况, 本研究中2 组患者平均降温速度在0.2~0.5 ℃/h,均在第4 小时体温达到37℃左右,减少了患者降温期并发症发生的可能,而2 组患者降温期寒颤的发生率仍有显著差异, 提示可以进一步提高降温毯预设温度的范围,减少患者降温期寒颤的发生。
4 结论
较高的降温毯预设温度(20 ℃),在兼顾稳定的降温效果的同时,可以减少心脏外科术后患者降温期寒颤的发生率,进而避免乳酸增高所带来的一系列风险,这对于心脏术后患者至关重要。因此,知晓寒冷刺激对患者造成的不良后果, 如降温期寒颤的发生、乳酸增加及负面心理,对于规范临床护士合理使用降温毯,减轻患者痛苦,是非常具有临床意义的。本研究对心脏外科术后降温毯的不同预设温度的降温效果进行了研究讨论,预设温度对患者的血流动力学是否有影响还需要进一步研究。 同时,本研究受到包括患者个体差异, 仪器设备及技术水平等诸多因素影响,需要结合其他中心的相关研究,总结出更加精准的降温方案,进而为心脏外科术后患者的降温提供指导。
[致谢] 感谢南京鼓楼医院叶家欣博士后及朱悉煜博士对本文统计学方面的指导!
