MicroRNA在肠易激综合征中的研究现状
2021-12-13楷宋玮廖晨希侯雨君杨雨晴李瑛周思远
王 楷宋 玮廖晨希侯雨君杨雨晴李 瑛周思远*
(1.成都中医药大学 针灸推拿学院,成都 610075;2.成都中医药大学 基础医学院,成都 610075)
肠易激综合征(irritable bowel syndrome,IBS)是一种常见的功能性胃肠道疾病,表现为反复发作的腹痛,与排便相关或伴随排便习惯改变,典型的排便习惯异常表现为便秘和(或)腹泻。其诊断主要依靠临床症状,并排除其他器质性病变。在临床上主要分为四型:便秘型肠易激综合征(IBS-C)、腹泻型肠易激综合征(IBS-D)、混合型肠易激综合征(IBS-M),不定型肠易激综合征(IBS-U)[1-3]。MicroRNA(miRNA)参与调控多种生理过程,研究发现在IBS患者的结肠组织、外周血中相关miRNA表达异常,研究证实miRNA对IBS的肠道微态[4]、内脏高敏反应、肠道免疫功能有关。miRNA参与调节肠黏膜的通透性,如miR-212[5]、miR-29a[6];miRNA参与IBS内脏高敏反应,如miR-24通过抑制5-HT选择性再摄取蛋白(SERT)表达,降低肠道5-羟色胺再摄取,加重内脏高敏反应[7]。
1 miRNA的形成、结构和功能
miRNA是一类长度约20~22个核苷酸组成的小分子单链RNA,属于非编码基因,以序列特异性的方式调控基因转录后的表达。第一个miRNA于1993年在秀丽隐杆线虫中发现[8],然而miRNA的一般调控功能直到2001年才得到充分认识[9-11]。大多数miRNA基因首先在细胞核内被RNA聚合酶Ⅱ(Pol II)转录成初期miRNA(pri-miRNA)。在细胞核内,RNA结合蛋白DGCR8结合Drosha(核糖核酸酶Ⅲ)形成微处理器复合物,pri-miRNA被加工成前体miRNA(pre-miRNA),一种长60~70 nt的含茎环的发夹状结构。pre-miRNA由exportin-5(XPO5)从细胞核主动转运到细胞质中,再由核糖核酸酶Dicer1加工去除茎环,形成短的双链miRNA。成熟双链miRNA的一条导向链被载入miRNA诱导的沉默复合体(miRISC),通过序列互补结合引导miRISC靶向mRNAs,另一条链则被降解。成熟的miRNA通过与靶mRNA的3’-非编码区(3’-UTR)完全或部分序列互补结合,靶向mRNA翻译障碍或某种程度的降解[12],参与调控关键生物学过程,包括发育、分化、凋亡和增殖等。研究发现至少有30%的哺乳动物的蛋白质编码基因受到miRNA的调控[13]。
2 miRNA与肠道稳态
肠道稳态是宿主(肠道粘膜和免疫屏障)、肠道内环境(包括肠道菌群)、营养和代谢产物等相互作用所构成的动态平衡状态,受到环境因素、饮食习惯等影响[14]。IBS患者的肠道稳态失调与肠道菌群、粘膜屏障、免疫屏障的调控有关。表1总结了部分miRNA参与调节肠道稳态的方式。

表1 部分miRNA与IBS肠道稳态的关系Table 1 Relationship between some miRNAs and intestinal homeostasis of IBS
2.1 miRNA与IBS肠道菌群
肠道菌群的定性或定量变化导致微生态失衡,这有助于病原菌的进入并附着在肠上皮细胞壁上[15]。肠道菌群失调影响miRNA表达,研究者分别选取了20名IBS-C、18名IBS-D、32名IBS-M共70例IBS患者,20例健康者作为对照组,对比各组的血清miR-199b和肠道菌群数量,发现大肠菌群计数增加,不同亚型患者血清miR-199b表达水平均明显下降,腹泻型IBS最低,结果显示IBS患者的肠道菌群计数与血清miR-199b表达水平呈负相关[4]。
2.2 miRNA与IBS肠黏膜通透性
肠道粘膜屏障属于物理屏障,是肠道屏障的第一道防线,其主要是由上皮细胞以及细胞间的紧密连接(TJs)构成。肠黏膜屏障的完整性受到破坏导致通透性增加,会促进食物或微生物抗原进入肠粘膜,从而刺激粘膜免疫系统。患有IBS的人群显示出更高数目的粘膜免疫细胞,特别是活化的肥大细胞增加。这些细胞释放的生物活性介质(包括蛋白酶,组胺和类前列腺素)加重通透性功能障碍,并导致感觉神经元的激活和敏化,从而导致异常的腹痛和肠道习惯的改变[16]。谷氨酰胺在动物和人的肠道屏障功能维护中起着至关重要的作用,其缺失会导致绒毛萎缩、TJs蛋白表达减少和肠道通透性增加。Zhou等[6]的研究发现miR-29a可以通过翻译抑制下调谷氨酰胺合成酶(GLUL)来调节肠道通透性。miR-29a和GLUL的3’-UTR之间具有良好的互补性,二者结合后抑制GLUL的表达,谷氨酰胺合成减少,最终导致肠粘膜通透性增加。Martinez等[17]研究发现,IBS-D患者小肠组织中的miR-125b-5p和miR-16表达下调,通过靶向TJs基因CGN(cingulin)和CLDN2(claudin-2),使CGN和CLDN2蛋白高表达,调节TJs结构从而导致肠粘膜通透性增加。Hou等[18]在IBS-D大鼠模型中鉴定出8个上调的miRNA和18个下调的miRNA。其中,miR-144明显上调并导致紧密链接蛋白occludin(OCLN)和闭锁小带蛋白1(ZO1)表达下调。表明miR-144通过靶向OCLN和ZO1增加IBS-D大鼠的肠通透性。
2.3 miRNA参与IBS内脏高敏
Zhou等[19-20]通过研究表明IBS伴内脏痛的患者结肠miR-199a/b降低,并与结肠辣椒素受体(TRPV1)表达增加和内脏痛评分直接相关[21-22],TRPV1是启动并保持IBS内脏高敏感性的关键因子[23],辣椒素、H+、伤害性热刺激(>43℃)可以激活TRPV1,使机体产生痛觉过敏和病理性疼痛。5-羟色胺(5-HT)与胃肠道功能及内脏感觉关系密切,人体内约90%的5-HT是肠嗜铬细胞(EC)合成,通过与不同的5-HT受体相互作用发挥不同的功能。5-HT通过刺激位于内脏和迷走神经纤维两者的初级传入神经元上的5-HT受体,调节运动和感觉,从而参与内脏敏感性的调节[24];5-HT选择性再摄取蛋白(SERT)是一种跨膜转运蛋白,对5-HT有高度亲和力,可以从细胞外重摄取5-HT进入细胞内,起到降低肠腔内5-HT浓度的作用。研究发现miR-24在IBS患者及大鼠模型中上调[25],SERT表达降低。SERT是miR-24的潜在靶基因,miR-24通过抑制SERT表达,达到5-HT再摄取降低,从而使肠道5-HT水平升高,导致IBS的发生和加重。使用miR-24抑制剂治疗IBS大鼠,发现SERT表达增加,大鼠的近端结肠疼痛阈和伤害性阈值增高,骨髓过氧化酶活性降低,确定了miR-24参与了内脏超敏反应。Hou等[26]测定了IBS-D大鼠模型结肠远端的miRNA的表达,发现miR-200a的上调最显著,同时伴有大麻素受体1(CNR1)和SERT表达下调,miR-200a模拟物能够显著抑制CNR1和SERT的表达,该研究提示miR-200a可能是通过抑制CNR1和SERT的表达而引起内脏高敏反应。另有研究表明,miR-510参与调节5-HT3受体基因中的亚型HTR3E的表达,首次证实了女性IBS-D患者可能与miR-510调控HTR3E有关,HTR3E的表达增加可能会影响神经信号或诱发一些女性IBS-D相关的症状[7]。研究表明,miR-29a可能通过靶向5-HT7受体(HTR7)调节IBS的内脏痛觉过敏。通过对比IBS患者与健康人对比发现miR-29a在IBS中显著上调,HTR7水平降低,而通过避水应激诱导的内脏高敏IBS小鼠中观察到同样的现象,再敲除内脏高敏小鼠的miR-29a,发现HTR7显著上调及内脏高敏减弱[27]。表2总结了部分miRNA与IBS内脏高敏的关系。
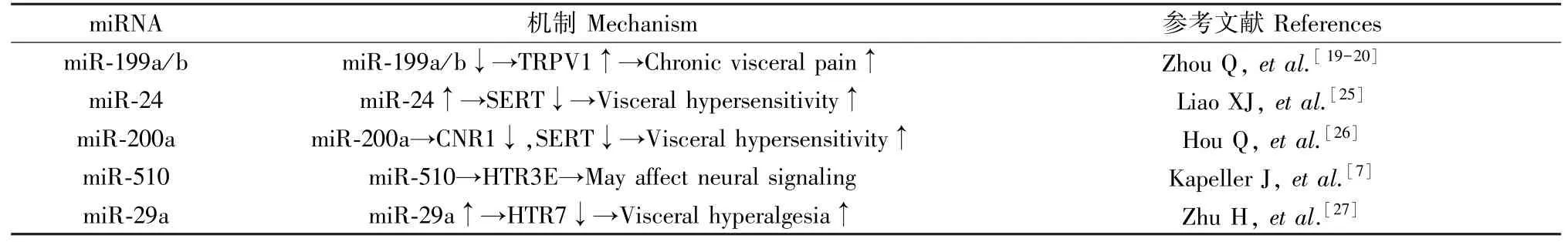
表2 部分miRNA与IBS内脏高敏的关系Table 2 Relationship between partial miRNA and visceral hypersensitivity of IBS
2.4 miRNA调控IBS肠道低度炎症
肠道低度炎症既是IBS的常见病理改变,又是引起肠粘膜通透性增加、肠道免疫激活的原因。感染性胃肠炎是IBS的常见诱因,一项系统评价与荟萃分析报告中显示,由于胃肠道感染后肠道存在慢性低度炎症,感染性胃肠炎后IBS的发生风险增加了6倍[28],对IBS患者临床调研发现,约1/3的患者有过胃肠道感染史。研究人员发现,在IBS大鼠中miR-181c-5p降低而IL-1α升高,miR-181c-5p可以靶向并抑制IL-1α的表达,同时模型大鼠的AWR和Bristol粪便等级升高,随着miR-181c-5p的过表达或IL-1α的降低,TNF-α,IL-2和IL-6的表达降低。这项研究表明,过度表达的miR-181c-5p可以抑制IL-1α生成,从而降低IBS肠粘膜的炎症分级。miR-181c-5p/IL-1α有 望 成 为 治 疗IBS的 新靶标[29]。
3 miRNA在IBS诊断与治疗中的研究
miRNA的异常表达可以作为疾病诊断的生物标记物。有研究者发现在肠粘膜通透性增加的患者中,外泌体和小肠、结肠组织中miR-29a的表达高于正常对照组3倍以上[30];外泌体是大多数细胞在凋亡或活化过程中释放的被膜覆盖的细胞碎片[31],是细胞与细胞间传递信息的一种物质,也是循环miRNA的重要载体。外泌体膜保护作用可有效减少miRNA被降解,因此外泌体miRNA成为新的研究热点,这可能是未来诊断和治疗IBS的新途径,以期推动该病研究的的发展[32]。Zhou等[33]发现IBS-D患者的肠组织的miR-29a/b水平升高,但CLDN1和核因子-κB抑制因子(NKRF)水平降低,通过敲除大鼠的miR-29族基因,发现肠道通透性增加得到逆转,因此认为,通过沉默miR-29族基因上调了CLDN1和核因子κB抑制因子(NKRF)从而恢复肠道通透性,这可能成为改善慢性胃肠道症状的创新靶点和治疗方法。基于PKIB是miR-495的靶基因,并在IBS-D大鼠中高表达,Fei等[34]发现miR-495的过表达可以通过下调PKIB抑制PI3K/AKT信号通路,从而降低IBS-D的内脏敏感性,这表明miR-495是治疗IBS-D的潜在靶标。现有研究对人类基因组的单核苷酸多态性的分析证实miRNA结合位点具有多态性[35];调节位点的非编码变异比编码区域变异更可能与疾病相关[36];与疾病相关的变异也可能会干扰miRNA的功能[37]。这说明了非编码区可能是病理学的热点,其表现出来的个体差异,可用于量身定制治疗方案。研究人员通过实验证明压力等急性应激可以引起健康人发生类似IBS的反应,并诱导miR-125b-5p和miR-145-5p显著下降,与IBS患者发生类似但不相同的miRNA介导的肠道屏障功能的调节[38],这个发现有望应用在IBS的预防上。
4 展望
IBS是常见的功能性胃肠疾病,以反复发作的腹痛为主要临床特征,严重影响患者的生活质量及心理状态。IBS是在环境、社会、心理、遗传等多因素作用引起的一种功能失调性胃肠病。IBS的机制较复杂,目前多数专家认为IBS的发病是多种因素导致“脑-肠轴”功能异常,从而导致不同的病理改变,产生相应的临床症状。由此引起的病理机制包括肠道微态的改变、肠粘膜通透性增加、内脏高敏反应等[39],且各个病理机制之间可以互为因果,这就造成患者体内的病理机制不是单一的。
随着研究的深入,miRNA在IBS中的机制将得到进一步阐明。IBS是一种以临床症状为诊断基础的疾病,加上该病与多种疾病症状表现的重叠,这会导致一部分患者漏诊、误诊。一项研究表明,约50%的符合罗马Ⅲ标准的IBS患者不能完全符合罗马Ⅳ的标准诊断,提示罗马Ⅳ标准对IBS的诊断率明显降低[40]。目前IBS的诊断缺乏客观的诊断标准。以miRNA作为IBS的特异性标志物具有诊断IBS的前景。miRNA在IBS的发生发展过程中起着不同程度的影响,部分治疗措施可能通过靶向miRNA调节肠道通透性、肠道菌群等达到治疗IBS的效果。现有医学方法的局限性多表现为一种药物应用于多个个体表现出来的不良反应,miRNA的多样性为个体化治疗指明了方向[41],以miRNA为载体或靶点的新药物有望成为治疗IBS的特效药物,并且可以根据个体定制。目前的研究虽然在IBS大鼠及人体内均发现表达异常的miRNA,但是是否能通过调节相应的miRNA获得更大的临床益处还无定论,且单一靶点的药物可能无法同时缓解IBS排便异常和/或腹痛症状。
