H3F3A基因突变及H3.3 G34W蛋白表达在骨巨细胞瘤中的诊断意义
2021-12-13杨宣涛徐艳琼王晚璞郑青青
杨宣涛,徐艳琼,杨 慧,王晚璞,郑青青,刘 涛
骨巨细胞瘤(giant cell tumor of bone, GCTB)系一种中间型骨肿瘤,组织学上由肿瘤性单核细胞和均匀分布的破骨细胞样巨细胞构成。但几乎所有的骨病变均可以有破骨样巨细胞,如非骨化性纤维瘤、软骨母细胞瘤、动脉瘤样骨囊肿等,这常常给准确诊断GCTB带来很大的干扰,尤其是较小组织的活组织检查,有时极具挑战性。近年来,随着RANKL抑制剂(denosumab)的应用,GCTB的治疗取得较好的疗效[1],但同时治疗后的GCTB形态学特征与治疗前的差异可以较大,有时完全无破骨样巨细胞,若在无临床病史的情况下,诊断尤其困难。
H3.3由1号染色体上的H3F3A基因和17号染色体上的H3F3B基因共同编码,在许多肿瘤的发生、发展中扮演着重要角色。近年研究发现GCTB中存在H3F3A基因突变,90%以上为p.G34W突变,并且可以采用免疫组化法检测H3.3 G34W蛋白表达鉴别诊断GCTB[2-5],但这类研究多以国外为主,国内仅有少量文献报道,且基因突变与蛋白阳性率多低于国外研究[6-8]。本实验采用荧光PCR-毛细管电泳测序法和免疫组化法探讨H3F3A基因突变和H3.3 G34W突变蛋白在GCTB中的表达及诊断意义。
1 材料与方法
1.1 临床资料收集云南省第一人民医院2014年1月~2020年8月具有典型的影像学、组织学特点,且标本未经脱钙处理的GCTB 34例(其中原发性30例,复发性2例,经denosumab治疗后2例),并收集其它富含破骨样巨细胞的肿瘤40例(其中软骨母细胞瘤10例,富于巨细胞骨肉瘤3例,甲状旁腺功能亢进2例,动脉瘤样骨囊肿10例,非骨化性纤维瘤15例)。所有病例均有完整的病历资料,样本来源包括穿刺活检、病灶刮出和局部手术切除组织。
1.2 试剂H3.3 G34W一抗购于北京中杉金桥生物公司(兔单克隆抗体,即用型,克隆号RM263),石蜡包埋组织DNA试剂提取盒购于厦门艾德生物公司。紫外分光光度计SMA4000为AMOY DIAGNOSTICS公司制造,ABI 7500 PCR仪器及ABI 3500Dx基因分析仪为Life Technologies Holdings Pte Ltd公司制造,H3F3A基因第2外显子突变检测试剂盒由北京旌准医疗公司提供(SS-129-24)。
1.3 方法
1.3.1免疫组化 所有标本均经10%中性福尔马林固定,常规石蜡包埋、4 μm厚切片,HE染色,镜下观察。所有病例均按WHO(2020)骨和软组织肿瘤分类的诊断标准[9],由2位副主任病理医师诊断。免疫组化染色采用EnVision两步法。判读标准:≥10%核中等强度着色为阳性,≥10%核弱~中等强度着色为部分阳性,<10%核弱着色为阴性。
1.3.2荧光PCR-毛细管电泳测序法 蜡块5 μm厚连续切片10张,放入灭菌EP管中,组织经二甲苯脱蜡后,按照石蜡包埋组织DNA试剂提取盒说明书进行操作,提取样本DNA,并使用紫外分光光度计测定DNA浓度和纯度。PCR反应体系为25 μL,H3F3A PCR反应液为12.5 μL,引物混合液为10.5 μL,DNA模板为2.0 μL。扩增条件:37 ℃ UDG酶防污染反应10 min 95 ℃预变性10 min,95 ℃变性15 s,62 ℃退火20 s,72 ℃延伸30 s,合计40个循环,然后进行熔解曲线分析,根据(87.5±1.5) ℃处是否出现熔解峰来判断是否有目的产物。酶解纯化:3 μL的PCR扩增产物和2 μL的酶解混合液混匀后于37 ℃反应60 min,然后80 ℃孵育15 min进行酶变性。测序反应体系配置:酶解后的扩增产物2.0 μL,测序引物3.0 μL,测序试剂1.0 μL,合计6.0 μL测序反应体系。测序反应条件:96 ℃预变性1 min。 96 ℃变性10 s,50 ℃退火5 s,60 ℃延伸2 min,合计30个循环。测序产物采用醋酸钠-乙醇沉淀法进行纯化后,于ABI 3500Dx基因分析仪进行测序分析。测序结果与基因组序列进行比对,参考序列为NM_002107.4。
1.4 统计学分析采用SPSS 19.0软件进行统计学分析,统计结果组间率的比较采用χ2检验,P<0.05为差异有统计学意义。标志物的诊断指标按下列公式计算:灵敏度=真阳性/(真阳性+假阴性),特异度=真阴性/(真阴性+假阳性)。
2 结果
2.1 临床特征34例GCTB中,男性16例,女性18例,年龄13~71岁,平均34岁,中位年龄31岁。位于长骨30例(占88.6%),其中股骨15例,胫骨8例,腓骨1例,桡骨5例,肱骨1例;非长骨4例(占11.4%),其中掌骨、骶骨、胸椎及髌骨各1例。所有病例均有典型的影像学资料,表现为骨端偏心性、膨胀性溶骨性骨质破坏,边界较清,无周边骨硬化,其中1例突破关节囊,累及皮下(图1)。

图1 肿瘤位于胫骨上段,体积巨大,突破关节囊,累及皮下
2.2 GCTB中H3.3 G34W的表达34例GCTB中32例H3.3 G34W阳性(占94.1%),均呈强阳性,表现为肿瘤性单核细胞胞核弥漫强着色(图2);2例阴性(占5.9%)。其中2例复发病例亦呈阳性。2例经denosumab治疗后的组织学形态表现为显著的纤维化、巨细胞数量显著减少,伴大量的未成熟骨化(图3)。免疫组化结果显示,梭形单核细胞和骨样基质中的瘤细胞H3.3 G34W蛋白均阳性(图4、5)。
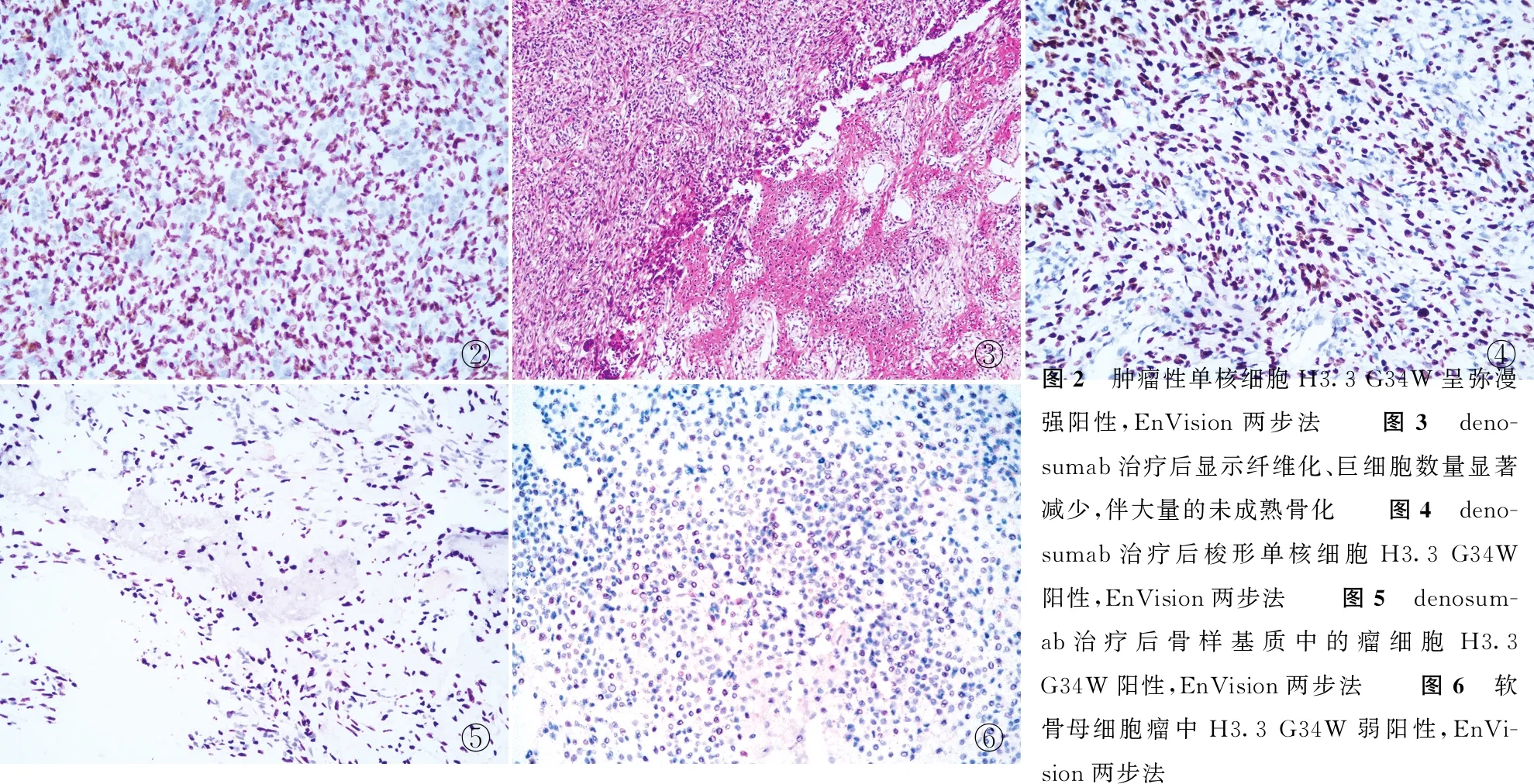
图2 肿瘤性单核细胞H3.3 G34W呈弥漫强阳性,EnVision两步法 图3 deno-sumab治疗后显示纤维化、巨细胞数量显著减少,伴大量的未成熟骨化 图4 deno-sumab治疗后梭形单核细胞H3.3 G34W阳性,EnVision两步法 图5 denosum-ab治疗后骨样基质中的瘤细胞H3.3 G34W阳性,EnVision两步法 图6 软骨母细胞瘤中H3.3 G34W弱阳性,EnVi-sion两步法
2.3 非GCTB中H3.3 G34W的表达40例富含破骨样巨细胞的肿瘤中仅1例软骨母细胞瘤H3.3 G34W部分阳性(2.5%)(图6),表现为肿瘤性单核细胞胞核弱阳性;其余病例均为阴性。H3.3 G34W在GCTB的阳性率高于非GCTB(P<0.05,表1)。
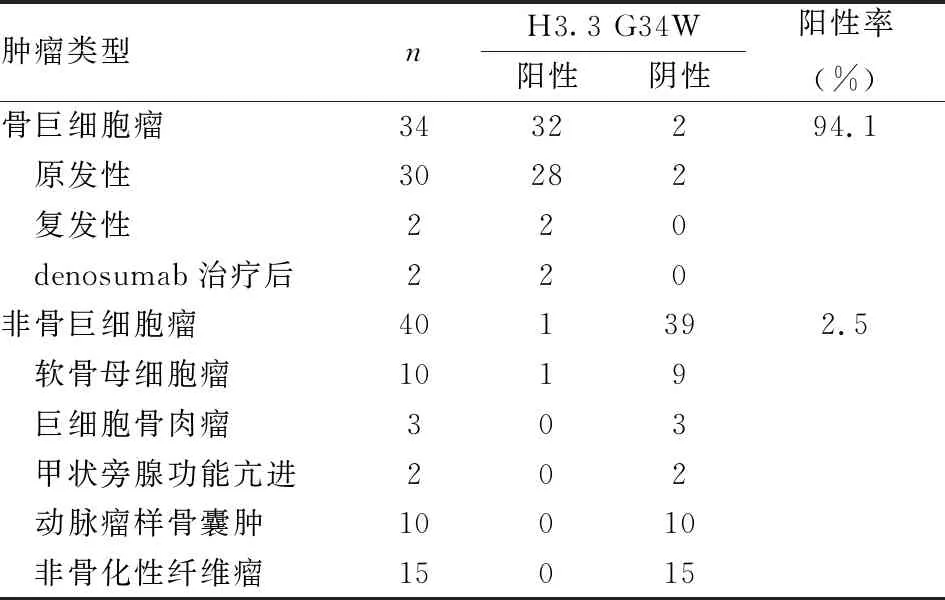
表1 骨巨细胞瘤和非骨巨细胞瘤中H3.3 G34W的表达
2.4 H3F3A基因测序结果34例GCTB均行荧光PCR-毛细管电泳测序检测,其中1例因蜡块时间较久(2014年)、DNA质量不佳,未能检出H3F3A突变,其余33例(97.1%)均检测出H3F3A突变,包括2例复发病例和2例经denosumab治疗后的病例。其中31例(91.2%)为p.G34W突变(图7),1例(2.9%)为p.G34V突变,1例(2.9%)为p.G34L突变。40例非GCTB均未发现有H3F3A基因突变。
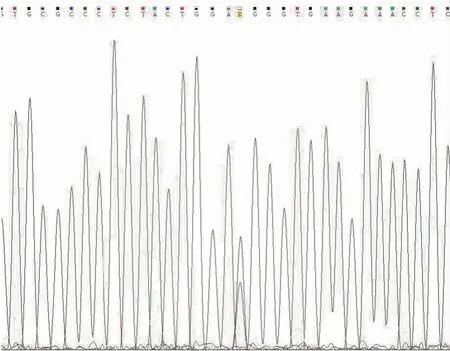
图7 荧光PCR-毛细管电泳测序法检测显示
2.5 H3.3 G34W蛋白和H3F3A基因突变分析在GCBT诊断中的特异性和敏感性对比分析34例GCTB中,32例H3.3 G34W阳性,H3.3 G34W诊断敏感性为94.1%;33例有H3F3A基因突变,H3F3A基因突变检测诊断敏感性为97.1%。40例富含破骨样巨细胞的非GCTB中,仅1例软骨母细胞瘤H3.3 G34W为部分阳性,特异性为98%;40例非GCTB均未检测出H3F3A突变,特异性为100%。基因突变检测在特异性和敏感性上均略高于免疫组化法。两种方法均与病理诊断具有较好的一致性(P<0.01)。
3 讨论
组蛋白H3包括经典的H3.2、H3.1及组蛋白变体H3.3。虽然H3.3与H3.2、H3.1在氨基酸序列上仅有个别氨基酸残基不同,但H3.3在基因转录调控及细胞发育分化过程中却显得更加重要。研究表明,H3.3的编码基因H3F3A和H3F3B错义点突变与中枢神经系统及骨与软组织肿瘤的发生密切相关[10-11]。
GCTB常伴继发性改变,包括动脉瘤样骨囊肿样改变,广泛的梗死、纤维母细胞增生、泡沫细胞浸润,需与其它富含巨细胞的肿瘤鉴别,如非骨化性纤维瘤、软骨母细胞瘤、动脉瘤样骨囊肿、甲状旁腺功能亢进、腱鞘巨细胞瘤瘤等。近年来研究发现GCTB中存在H3F3A基因p.G34W/L/V/R突变,>90%为p.G34W突变,并且已经开发出特异性抗体可用于GCTB的诊断和鉴别诊断[3-5]。
本组免疫组化结果显示,34例GCTB中,32例H3.3 G34W蛋白阳性,阳性率为94.1%,40例非GCTB中仅1例软骨母细胞瘤呈弱阳性。34例GCTB中33例(97.1%)存在H3F3A突变,其中31例(91.2%)为p.G34W突变,1例为p.G34V突变(2.9%),1例为p.G34L突变(2.9%)。2例非p.G34W突变者,其相应的H3.3 G34W蛋白表达亦为阴性。本组的H3.3 G34W阳性率及H3F3A突变检出率与国外文献报道结果较一致,高于部分国内相关研究[6-8],可能是因为本组样本剔除了经脱钙处理的组织标本。本组1例H3.3 G34W蛋白呈阳性,但未检测出p.G34W突变,经仔细核对,是由于蜡块年代较久,DNA质量不佳所致。Gong等[12]对180例GCTB进行测序发现,171例(95%)检出H3F3A突变,其中163例(90.56%)为p.G34W突变,并表达H3.3 G34W蛋白;作者同时发现2例H3.3 G34W蛋白表达,但p.G34W突变为野生型。Lüke等[13]亦发现1例H3.3 G34W蛋白表达,但p.G34W突变为野生型。分析两者不一致的原因可能包含了以下几种因素:(1)脱钙导致DNA破坏;(2)蜡块年份较久或保存不当,导致DNA质量不佳;(3)组织标本过少,这也是术前穿刺活检中可能遇到的问题;(4)肿瘤的继发性改变明显,如伴出血、梗死、含有较多泡沫状组织细胞或纤维成分过多等,导致可供检测的肿瘤细胞数量过少。但由于基因测序可以检测出少见的突变类型,故在GCTB诊断中总的敏感性要略高于免疫组化法。
少数骨肉瘤(包括富于巨细胞的骨肉瘤)与恶性GCTB的鉴别诊断由于H3F3A的检出而成为一个有争议的问题。目前,国内外对此研究结果不一。Amary等[3]报道385骨肉瘤中13例存在H3.3 G34突变,13例患者平均年龄34岁(范围19~64岁),11例有影像学资料,除1例外均位于关节下。故作者认为具有H3.3突变的关节下原发恶性骨肿瘤,即使无良性GCTB的组织学成分,也可能是真正原发恶性GCTB。该观点亦得到了Koelsche等[14]的部分认同。Koelsch等发现约5.7%(6/106)骨肉瘤检出H3F3A突变,并且这些患者平均年龄超过30岁,中位年龄65岁,仅从H3F3A突变状态、年龄和部位特点看,作者推测这6例很可能是恶性GCTB。但这组病例的影像学、组织学和核型上均与普通型骨肉瘤无明显差异。作者同时进行了甲基化检测,发现具有H3F3A突变的这组病例甲基化谱明显不同于H3F3A野生型骨肉瘤,而与GCTB更为密切。最终,作者提出具有H3F3A突变的骨肉瘤可能是骨肉瘤中的一种特殊亚型。Yoshida等[15]发现5例缺乏H3F3A突变的恶性GCTB,FISH分析表明可能与H3F3A基因的缺失有关。作者主张将缺乏H3F3A突变的恶性GCTB作为一种特殊亚型。国内学者王璇等[6]发现3例富于巨细胞的骨肉瘤存在H3.3 G34W蛋白表达,而白岳青等[8]报道的3例富于巨细胞的骨肉瘤在蛋白水平及Gong等[12]报道的18例骨肉瘤在基因水平均未检出H3.3 G34突变。本组3例巨细胞骨肉瘤在蛋白及基因水平检测结果均为阴性,复习其放射学及组织学仍归属于骨肉瘤。因此,目前骨肉瘤中的H3.3 G34偶然突变成为了一个潜在的诊断难题,究竟是原发性恶性GCTB,还是属于骨肉瘤的一个特殊亚型,尚无统一认识。鉴于骨肉瘤中H3.3 G34突变率低,作者建议国内学者可以采取多中心合作研究模式来共同探讨骨肉瘤尤其是富于巨细胞的骨肉瘤与恶性GCTB间的关系。
Denosumab是RANKLE抑制剂,通过RANKL/RANKLE通路抑制肿瘤的溶骨性破坏。越来越多的文献报道,经过denosumab治疗后,可能会增加刮除术后患者的局部复发风险,这可能是由于denosumab治疗后引起肿瘤边缘硬化,导致硬化带里的肿瘤细胞不能被完全刮出所致[1]。本组2例经denosumab治疗的病例,组织学显示大量未成熟骨化组织呈长条索状、分枝状排列或相互吻合,似低度恶性中央型骨肉瘤;破骨样巨细胞显著减少甚至消失;梭形细胞增生伴显著纤维化,似非骨化性纤维瘤。2例H3.3 G34W蛋白均呈阳性,表现为肿瘤性单核细胞核弥漫强阳性。同时观察到位于骨样基质中的瘤细胞也呈核阳性,提示经denosumab治疗后的肿瘤基质细胞仍然存活并且具有成骨功能。这也从组织学角度证实了denosumab治疗后的潜在复发风险。
关于H3.3 G34W/L/R/V突变的作用机制尚无共识。在一项新近的研究中,Khazaei等[16]分析了细胞模型的表观基因组、转录组和蛋白质组,并在单细胞分辨率下生成了GCTB原发性肿瘤和原位异种移植物的转录组数据。结果发现H3.3 G34W通过异常的表观遗传重塑,改变了间充质祖细胞的分化轨迹,使SPP1+(骨桥蛋白)的成骨样祖细胞群向ACTA2+(平滑肌肌动蛋白)的肌纤维母细胞群转化,并分泌细胞外基质配体,募集并激活破骨细胞,导致GCTB的发生。并提示这些表观遗传变化可能对GCTB的靶向治疗起到重要作用。
关于H3F3A罕见突变类型是否与肿瘤生物学相关,由于病例少,目前尚无具有统计学意义的相关报道。Schaefer等[4]对一组病例研究发现,其中第34例患者3年前空心针穿刺活检,组织学呈经典的GCTB形态,H3.3 G34W蛋白呈阴性;3年后手术标本,组织学呈梭形细胞肉瘤形态,核异型明显,核分裂易见,免疫组化检测H3.3 G34W蛋白仍为阴性,基因检测发现存在p.G34L突变,诊断为GCTB伴恶性转化。本组发现1例p.G34L突变,系25岁女性患者,第1次在当地医院经空心针穿刺诊断GCTB后,由于经济原因,放弃治疗。4年后就诊于我院,肿瘤位于左胫骨近端,体积巨大,大小25 cm×25 cm×20 cm,突破骨质,累及肌肉及皮下脂肪组织,临床考虑恶性。组织学上显示破骨样巨细胞数量减少,但并无明显的恶变征象,免疫组化检测H3.3 G34W蛋白为阴性,基因检测为p.G34L突变。经肿瘤切除并关节置换术治疗,随访近4年,至今未复发。本例与Schaefer等[4]报道的第34例患者具有一定的相似性:第1次经空心针穿刺获得诊断,3~4年后手术治疗,免疫组化检测H3.3 G34W蛋白为阴性,基因检测为p.G34L突变,临床表现为恶性征象。p.G34L突变是否与更具侵袭性的生物学行为相关,尚需大样本的研究。
本组免疫组化检测H3.3 G34W的敏感性为94.1%,特异性为98%,H3F3A基因突变检测敏感性为97.1%,特异性为100%。32例H3.3 G34W蛋白阳性者,其中31例(91.2%)检出p.G34W突变,显示H3.3 G34W蛋白表达与H3F3A测序间具有很好的相关性。因此,基于经济成本和时间成本考虑,建议日常诊断工作中,首选H3.3 G34W免疫组化检测,但对于一些特殊病例,如具有不典型的临床放射学表现和(或)组织形态学特征不典型病例,可以加做基因检测,避免因罕见基因突变类型所致H3.3 G34W蛋白阴性而造成的漏诊。另一方面,鉴于H3F3A的高突变率,并且H3.3 G34W突变具有驱动GCTB发生的作用,这也为潜在的基因靶向治疗提供了依据。
