桦木酸对胃癌SGC-7901细胞凋亡的影响*
2021-12-10邵淑丽何孟奇张伟伟张珍珠
丁 璐, 邵淑丽,2△, 何孟奇, 黄 鑫,2, 张伟伟,2, 张珍珠,2
(1. 齐齐哈尔大学生命科学与农林学院, 2. 抗性基因工程与寒地生物多样性保护黑龙江省重点实验室, 黑龙江 齐齐哈尔 161006)
全球每年有超过100万人死于胃癌,其病死率位居全球肿瘤死亡率的第二位[1]。由于大多部分胃癌患者病情发现时已至中晚期,无法接受手术治疗,所以临床上通常使用化疗手段治疗中晚期患者[2]。目前,对于胃癌中晚期患者主要使用多西他赛、紫杉醇、替吉奥、伊立替康等化疗药物,但有研究显示,此类药物具有较大的毒副作用,可促使肿瘤细胞耐药性增强,降低部分患者的生存率[3]。近年来发现一些天然药物成分可通过促进细胞凋亡达到治疗肿瘤的效果,并且这些药物具有毒副作用小,治疗效果明显等优点。据报道,川楝素、白花蛇舌草等天然药物具有抗肿瘤细胞增殖与促肿瘤细胞凋亡的能力[4,5]。桦木酸作为一种天然存在的三萜类化合物,广泛分布于多种植物中,具有抗炎、抗微生物等生物活性,并且可用于治疗心脑血管以及动脉硬化等方面的疾病[6]。研究表明,桦木酸能够通过使癌细胞自然死亡从而实现抗癌的作用[7],其可通过抑制Wnt/β-catenin信号通路来抑制胰腺癌细胞PANC-1的增殖,并使其细胞周期停滞于G0/G1期[8]。此外,桦木酸可以促进结直肠癌细胞HCT116的凋亡,并且抑制结直肠癌细胞的转移[9]。然而桦木酸对人胃癌SGC-7901细胞凋亡的相关研究尚鲜有报道。本实验以人胃癌SGC-7901细胞为研究对象,用不同浓度桦木酸处理人胃癌SGC-7901细胞48 h后对其凋亡情况进行检测,探讨桦木酸是否诱导人胃癌SGC-7901细胞凋亡,为天然药物桦木酸在胃癌临床治疗中的应用提供理论依据。
1 材料与方法
1.1 细胞及主要试剂
人胃癌SGC-7901细胞购于中国医学科学院肿瘤研究所;胎牛血清购自以色列Biological Iudustries公司;RPMI-1640培养基干粉购自美国Gibico公司;RNA提取试剂盒以及蛋白提取试剂盒购自上海生工有限公司;Bax、Bcl-2与Caspase-3一抗购自北京博奥森生物技术有限公司;二抗购自美国LI-COR有限公司;Power 2×SYBR real-time PCR premixture试剂盒购自北京百泰克生物技术有限公司;IP细胞裂解液盒购自上海碧云天有限公司;桦木酸购自北京汉博生物有限公司;吖啶橙购自上海伊卡生物有限公司。
1.2 细胞培养及药物处理
将购自于中国医学科学院肿瘤研究所的人胃癌SGC-7901细胞放入含有10%胎牛血清的1640培养基中培养,每500 ml培养基中加入0.05 g青霉素0.06 g与链霉素,将其置于CO2浓度为5%的37℃恒温培养箱中培养。用孔径为0.02 μm的滤器过滤桦木酸溶液,分别配置成浓度为 10 mg/L、20 mg/L及30 mg/L 的桦木酸溶液,分装并保存在4℃冰箱中。在人胃癌SGC-7901细胞达到对数生长期时,将其分为4组,每组设置3个复孔,对照组未加入桦木酸,而三组实验组分别加入浓度为10 mg/L、20 mg/L及30 mg/L的桦木酸,将各组细胞放入5%的CO2培养箱中培养48 h。
1.3 激光共聚焦显微镜观察人胃癌SGC-7901细胞形态
在人胃癌SGC-7901细胞汇合度达到80%~90%后,将爬片置于六孔板中并接种人胃癌SGC-7901细胞,在细胞达到对数生长期时,分别加入终浓度为0 mg/L、10 mg/L、20 mg/L及30 mg/L的桦木酸,在含有5%的CO2培养箱中培养48 h后。用2 ml 的PBS洗涤爬片,再用1 ml的4%多聚甲醛固定人胃癌SGC-7901细胞20 min,PBS洗涤爬片,向爬片中央滴加500 μl 吖啶橙,孵育10 min,PBS洗涤爬片,在激光共聚焦显微镜下检测细胞凋亡情况并且拍照。
1.4 AnnexinV-FITC/PI检测细胞凋亡率
将用浓度为0 mg/L、10 mg/L、20 mg/L、30 mg/L的桦木酸处理48 h后的人胃癌SGC-7901细胞用不含EDTA的胰酶消化后4℃离心5 min,收集细胞,再用预冷的PBS洗涤细胞两次,每次洗涤后4℃离心5 min,用1× Binding Buffer悬浮细胞成浓度为1× 106细胞悬液,在细胞悬液中加入5 μl Annexin VEGFP,轻轻混匀后避光孵育15 min,再加入10 μl PI混匀后避光孵育5 min,在1 h内用流式细胞仪检测,每组设三个重复。
1.5 流式细胞术检测线粒体膜电位
收集用0 mg/L、10 mg/L、20 mg/L、30 mg/L的桦木酸处理48 h后的人胃癌SGC-7901细胞于0.5 ml的细胞培养液中,加入0.5 ml JC-1染色工作液,颠倒混合数次,将其置于含有5%的 CO2细胞培养箱中37℃孵育30 min,同时将5× JC-1染色缓冲液稀释为1× JC-1染色缓冲液,放置于冰上,孵育结束后,将细胞悬液1 500 r/min离心3 min,弃上清,用1× Incubation Buffer洗涤细胞2次,最后用500 μl的1× Incubation Buffer重悬,通过流式细胞仪检测细胞线粒体膜电位变化。
1.6 qRT-PCR检测凋亡相关基因的mRNA水平
将对照组以及用10 mg/L、20 mg/L、30 mg/L的桦木酸处理过的人胃癌SGC-7901细胞培养48 h后,用Trizol吹下,提取总RNA,逆转录为cDNA。分别设计Bcl-2、Bax和Caspase-3的PCR引物(表1),内参为β-actin,每组设置三组重复,依据荧光定量染料法试剂盒说明书配制反应体系,进行荧光定量PCR反应。最后得到的Ct值采用2-△△ct计算,分别计算Bcl-2、Bax和Caspase-3的mRNA相对表达量。

Tab. 1 Primers for qRT-PCR analysis
1.7 Western blot检测凋亡相关基因的蛋白水平
将未用桦木酸处理过以及用10 mg/L、20 mg/L、30 mg/L的桦木酸处理过的人胃癌SGC-7901细胞培养48 h后,用胰酶将细胞消化,加裂解液,离心,取沉淀,并提取总蛋白。SDS-PAGE凝胶电泳后,电转到PVDF膜上,用5%的脱脂奶粉进行封闭,4℃一抗孵育过夜,用PBST缓冲液将PVDF膜洗涤3遍,二抗避光孵育2 h后,用PBST洗涤3遍后用ECL显色,曝光。使用Image J软件对条带进行分析,以β-actin蛋白水平作为参照,计算凋亡相关蛋白的相对表达水平。
1.8 统计学处理
2 结果
2.1 不同浓度桦木酸对人胃癌SGC-7901细胞形态的影响
用吖啶橙染色正常人胃癌SGC-7901细胞,在激光共聚焦显微镜下观察细胞形态。如图1(A)呈现均匀一致的绿色荧光,大小均匀一致,细胞核呈圆形,细胞膜完整以及分裂状态正常。而用不同浓度桦木酸(10、20、30 mg/L)处理人胃癌SGC-7901细胞48 h后,细胞形态如图1(B、C、D)所示,出现细胞皱缩,染色质凝集,细胞核裂解的情况,并且胞膜上有小泡状形成,并且随着药物浓度的增加,细胞核裂解情况越明显。

Fig. 1 Cell morphology of SGC-7901 cells treated with betulinic acid for 48 h under a laser confocal microscope(acridine orange ×200, n=3)A: 0 mg/L; B: 10 mg/L; C: 20 mg/L; D: 30 mg/L
2.2 不同浓度桦木酸对人胃癌SGC-7901细胞凋亡率的影响
不同浓度的桦木酸作用于人胃癌SGC-7901细胞48 h后,流式细胞术检测细胞凋亡率,对照组细胞早期凋亡率为5.5%±0.3%,而当桦木酸浓度为10 mg/L,20 mg/L,30 mg/L时,细胞早期凋亡率分别为36.1%±0.5%,54.7%±0.7%和30.1%± 0.4%。与对照组相比,随着桦木酸浓度的增加,人胃癌SGC-7901细胞均有不同程度的凋亡现象(P< 0.05,P<0.01),而20 mg/L的处理组与10 mg/L和30 mg/L相比,细胞凋亡程度更为明显(P<0.05,表2)。
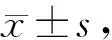
Tab. 2 Detection of apoptosis rate of SGC-7901 cells (%, n=3)
2.3 不同浓度桦木酸对人胃癌SGC-7901细胞线粒体膜电位的影响
用不同浓度桦木酸作用于人胃癌SGC-7901细胞48 h后,用流式细胞术检测其对线粒体膜电位的影响,结果如图2所示,对照组细胞线粒体膜电位为99.80±0.02,而用浓度为10、20、30 mg/L的桦木酸处理人胃癌SGC-7901细胞48 h后,细胞的线粒体膜电位分别为81.80±1.12 、13.00±0.94 、70.00±1.03,与对照组相比,随着桦木酸浓度的增加,线粒体膜电位均有不同程度的降低(P<0.05,P<0.01),与药物浓度为10 mg/L 、30 mg/L的处理组相比,当桦木酸浓度为20 mg/L时,线粒体膜电位降低较为显著(P<0.01,表3)。

Tab. 3 Detection of mitochondrial membrane potential and Bcl-2,Bax and Caspase-3 mRNA expressions in SGC-7901 cells n=3)
2.4 不同浓度桦木酸对人胃癌SGC-7901细胞凋亡相关基因mRNA表达的影响
qRT-PCR检测不同浓度桦木酸作用于人胃癌SGC-7901细胞48 h后,凋亡相关基因Bcl-2、Bax、Caspase-3的mRNA表达水平。结果如图4所示,与对照组相比,用浓度为10 mg/L、20 mg/L、30 mg/L的桦木酸处理人胃癌SGC-7901细胞48 h后,Bcl-2基因的 mRNA表达均有不同程度的下降(P< 0.01),在桦木酸浓度为 20 mg/L 时其mRNA表达最低,而Bax、Caspase-3基因的mRNA表达均有不同程度的上升(P<0.01),在桦木酸浓度为 20 mg/L 时,Bax、Caspase-3 mRNA表达最高(图2,表2)。

Fig. 2 Effect of betulinic acid on mRNA expressions of apoptosis-related genes in human gastric cancer SGC-7901 cells (n=3)A: Relative mRNA expression of Bcl-2; B: Relative mRNA expression of Bax; C: Relative mRNA expression of Caspase-3**P<0.01 vs 0 mg/L; #P<0.05,##P<0.01 vs 10 mg/L; △P<0.05,△△P<0.01 vs 30 mg/L
2.5 不同浓度桦木酸对人胃癌SGC-7901细胞凋亡相关基因蛋白表达的影响
Western blot检测不同浓度桦木酸作用于人胃癌SGC-7901细胞48 h后,其凋亡相关基因Bcl-2、Bax、Caspase-3的蛋白表达。结果如图5所示,与对照组相比,当桦木酸浓度为10 mg/L、20 mg/L、30 mg/L时, Bcl-2蛋白表达均有不同程度的降低(P<0.01),在药物浓度为20 mg/L时,Bcl-2蛋白表达最低,而Bax、Caspase-3的蛋白表达均有不同程度的升高(P<0.01),在药物浓度为20 mg/L时,Bax、Caspase-3蛋白表达最高(图3,表4)。

Fig. 3 Effect of betulinic acid on protein expressions of apoptosis-related genes in human gastric cancer SGC-7901 cells (n=3)A: Relative protein expression of Bcl-2; B: Relative protein expression of Bax; C: Relative protein expression of Caspase-3**P<0.01 vs 0 mg/L; #P<0.05,##P<0.01 vs 10 mg/L; △P<0.05,△△P<0.01 vs 30 mg/L

Tab. 4 The effects of betulinic acid on protein levels of Bcl-2, Bax and Caspase-3 n=3)
3 讨论
胃癌是起源于胃黏膜上皮的恶性肿瘤,是临床最常见的恶性肿瘤之一[10],临床上常用顺铂,五氟尿嘧啶等化学药物进行化疗,但往往会产生较大的毒副作用[11],因此寻找有效且毒副作用小的化疗药物是改进胃癌治疗现状的迫切需要。许多天然物质具有抗肿瘤的能力,可抑制肿瘤细胞增殖并促进其凋亡。尽管这些天然药物在临床使用上取得进展,但目前临床上仍面临着缺少毒副作用小且治疗效率高的化疗药物的问题。桦木酸又名白桦脂酸,主要存在于桦木属植物当中,同时也存在于其他多种植物中,其在白桦树树皮当中的含量最高。研究表明,桦木酸具有抗感染,增强血管生成,减轻细胞凋亡,减轻氧化应激和激活自噬等作用[12,13]。同时,桦木酸又具有抗肿瘤的能力,Ye等人发现桦木酸以及其衍生物对黑色素瘤、胃癌、卵巢癌以及宫颈癌具有明显的抑制作用,用不同浓度的桦木酸衍生物处理黑色素瘤细胞,肿瘤细胞均受到不同程度的抑制,随着浓度的增加,细胞凋亡情况越明显,呈现一定的剂量依赖性[14]。与传统细胞毒性药物相比,桦木酸较绝大多数化疗法更为有效,尤其是在肿瘤复发治疗中具有显著效果,且桦木酸不会对人体正常细胞造成伤害,也不会与其他药物产生交叉耐药性[15]。本研究使用0 mg/L、10 mg/L、20 mg/L、30 mg/L浓度的桦木酸处理人胃癌SGC-7901细胞48 h后并检测其凋亡情况,探讨桦木酸是否可诱导人胃癌SGC-7901细胞凋亡,结果显示,与对照组相比,各处理组细胞凋亡程度均较为明显,且当药物浓度为20 mg/L时,细胞凋亡情况最为明显。
细胞凋亡属于细胞的程序性死亡[16],作为最早已知的调节细胞死亡的形式,细胞凋亡可通过两种不同的途径发生,即Caspase 无关途径和Caspase 依赖途径。Caspase 无关途径包括两个主要因素,即凋亡诱导因子(AIF)和内切酶G(EndoG):前者在进入细胞核后促进染色质凝聚和细胞核碎裂,后者通过直接消化细胞核内的DNA从而起到诱导细胞凋亡的作用。Caspase 依赖途径可以通过内在发生线粒体途径和外源性死亡受体途径,分别以Caspase-9和Caspase-8的激活为标志[17]。有研究表明,Bcl-2、Bax作为Caspase-3的上游调控机制,可调节线粒体的通透性,Bcl-2过表达后可阻断Cyt-C的释放,抑制Caspase 的活性,从而抑制细胞凋亡,而Bax的作用则与Bcl-2相反[18]。在本研究中,用浓度为10 mg/L、20 mg/L和30 mg/L的桦木酸处理人胃癌SGC-7901细胞48 h后,与对照组相比,线粒体膜电位均有不同程度的降低且细胞凋亡率明显增加,同时qRT-PCR 与Western blot结果显示,用不同浓度桦木酸处理48 h后,与对照组相比,Bax与Caspase-3的表达量均有不同程度升高,而Bcl-2则呈现相反趋势。以上结果提示当桦木酸药物浓度增加后,可能会激活Bcl-2/Bax与Caspase-3凋亡相关途径,进而诱导细胞凋亡,这与增加Bax/Bcl-2比值和上调Caspase-3可促进胰腺癌细胞PANC-1凋亡的结果相一致[19]。
综上所述,桦木酸可上调Bax与Caspase-3表达,下调Bcl-2表达,从而促进胃癌SGC-7901细胞凋亡。由于桦木酸相对于其他天然药物更容易通过化学方法合成,价格又较为低廉,所以本研究结果可为其在肿瘤临床中的应用提供实验依据。
