RPA1低表达对辐射抵抗人鼻咽癌CNE-2R细胞侵袭迁移及细胞周期的影响*
2021-12-10张自新陆海洋杨治花刘长虎詹文华
张自新, 陆海洋, 杨治花, 刘长虎, 詹文华, 折 虹, 赵 仁
(宁夏医科大学总医院放疗科, 银川 宁夏 750004)
鼻咽癌是我国南方常见的一种恶性肿瘤,放射治疗仍然是鼻咽癌首选的治疗方式[1]。 虽然放疗效果有了很大的提高,但仍然有15%~30%鼻咽癌患者发生转移[2]。肿瘤的侵袭转移是一个多基因参与的过程,寻找引起鼻咽癌转移的基因,对控制鼻咽癌转移,延长患者生存意义重大。有研究表明[3],抗辐射细胞的存在与肿瘤放疗后失败关系密切。复制蛋白A1(replication protein A1, RPA1)作为同源重组修复通路中的一员,它在DNA损伤修复和维持染色体稳定性等方面起着重要的作用。N. Givalos等的研究显示[4],RPA1在转移病灶中高表达,而在原发灶中低表达。本课题组之前的研究发现[5],RPA1在放射抵抗的鼻咽癌患者的组织中高表达。因此推测RPA1可能参与鼻咽癌的转移过程。慢病毒转染技术是目前常用的生物学技术,它通过将特异性同源双链RNA导入到细胞内,使目的基因不表达或低表达,是研究该基因功能的一种方法。 本研究旨在探讨RPA1低表达对辐射抗拒的人鼻咽癌CNE-2R细胞侵袭、迁移及细胞周期的影响,并对其可能的机制进行探索。
1 材料与方法
1.1 材料
人鼻咽癌CNE-2R细胞株由重庆医科大学分子肿瘤实验室胡国华教授课题组馈赠,是由人鼻咽癌CNE-2细胞经过X线照射60 Gy后仍然存活的细胞。RPA1-shRNA慢病毒由汉恒生物(上海)科技有限公司构建,胎牛血清购自美国Hyclone公司,Trizol试剂购自美国Invitrogen公司,反转录试剂盒及实时荧光定量检测试剂盒购自大连(TaKaRa)公司,RPA1抗体购自英国Abcam公司,Chk2、Cdc25C均购自Santa Clause公司,p-Chk2、p-cdc25c购自CST公司,RPA1和GAPDH引物由上海生工生物工程有限公司合成,Matrigel胶购自美国BD公司,CCK8试剂盒购于碧云天生物科技公司,Transwell小室购自北京中杉金桥生物有限公司。
1.2 细胞培养
将1×105个CNE-2R细胞种植于培养瓶中,加入10%胎牛血清培养液,置于37℃ 5%CO2的细胞培养箱中,观察细胞贴壁情况,待细胞融合度达到75%时进行后续实验。
1.3 慢病毒的转染
取1 ml CNE-2R细胞悬液(含5×104cells/ml)分别接种到六孔板中,分为四组,慢病毒转染组(RPA1-shRNA)、阴性对照组(NC-shRNA)、加药对照组、空白对照组(CNE-2R)。细胞贴壁后,慢病毒转染组、阴性对照组分别加入含有RPA1-shRNA、NC-shRNA序列的病毒颗粒20 μl(含有8×106个病毒)。48 h后,在慢病毒转染组、阴性对照组、加药对照组中分别加入浓度为10 μg/ml含有嘌呤霉素的完全培养液2 ml,直至加药对照组的细胞完全死亡后,慢病毒转染组、阴性对照组继续加药培养5代,分别提取慢病毒转染组(RPA1-shRNA group)、阴性对照组(NC-shRNA group)及空白对照组(CNE-2R group)细胞的总RNA和蛋白质检测转染效果,并选用这三组细胞完成后续实验。RPA1-shRNA序列为:5’-CCCTAGAACTGGTTGACGAAA-3’; NC-shRNA序列为:5’-GATTGATTGACCTGTCCAT-3’。
1.4 聚合酶链反应(RT-PCR)检测RPA1 mRNA的表达
取对数期生长的细胞,以Trizol法提取总RNA,紫外分光光度仪测RNA纯度。反转录试剂盒合成cDNA,RT-PCR按照Takara说明书进行,以GAPDH为内参。以2-ΔΔCt计算RPA1的表达量。引物序列见表1。

Tab. 1 Primer sequences of RPA1 and GAPDH
1.5 Western blot法检测蛋白质的表达
取对数期生长的各组细胞,以试剂盒提取总蛋白,按照BCA法测定RPA1蛋白浓度。SDS-PAGE凝胶电泳,PVDF转模,20%脱脂牛奶封闭2 h,加一抗过夜(RPA1 1∶2 000),清洗,加相应的二抗孵育2 h,ECL显像并照相。
1.6 CCK8法检测细胞增殖
取对数期生长的各组细胞,96孔板内每孔种植100 μl细胞悬液(含2×103个细胞),每组设3 个复孔, 每组加入10 μl CCK8溶液后,连续4 d测定450 nm处的吸光度。
1.7 克隆形成试验检测细胞增殖
取对数生长期的各组细胞,分别将200个细胞种入6孔板中,每组设3个平行孔,培养14 d,固定20 min后染色,室温下干燥。显微镜下计数大于等于50个细胞数的克隆数,实验重复3次。
1.8 Transwell法检测细胞侵袭
将Matrigel胶与无血清培养液按1∶8的体积比混合,取30 μl混合液加入Transwell小室的上室中,均匀涂布于基底膜上,过夜。取对数生长期的细胞,消化后用无血清培养液调整细胞浓度至2×105cells/ml,在24孔板内的Transwell小室中加入100 μl细胞悬液,在小室外加入含10%胎牛血清的培养液,培养48 h,取出小室,冲洗上室,甲醇固定风干,染色,擦掉上层迁移细胞。拍照,细胞计数。
1.9 划痕实验检测细胞迁移
取对数生长期的两组细胞,分别将1 ml细胞悬液(含5×105cells/ml)种入6孔板中,待细胞爬满孔底后用10 μl枪头垂直划痕形成无细胞区,分别于0 h、48 h后倒置显微镜下观察、拍照,测量划痕宽度,根据文献计算划痕愈合率[6]。实验重复3次。
1.10 流式细胞技术检测细胞周期
取对数生长期的各组细胞,制成单细胞悬液,将1 ml(含1×105cells/ml)各组细胞分别接种在6 孔培养板中,96 h后收集各组细胞,离心,每组细胞加入500 pl细胞周期检测试剂重悬细胞,室温下避光反应15 min,用流式细胞仪检测各组细胞细胞周期。实验重复3 次。
1.11 统计学处理

2 结果
2.1 RPA1低表达CNE-2R细胞株的建立
采用RT-PCR和Western blot技术分别检测RPA1 mRNA和蛋白质的表达RPA1-shRNA组细胞RPA1 mRNA(0.02645±0.0007)明显低于CNE-2R组(0.02716±0.0005)和NC-shRNA组(0.08409± 0.0009),与CNE-2R组和NC-shRNA组比较差异具有统计学意义(图1a);与CNE-2R组(0.7436± 0.0006)和NC-shRNA组(0.9335±0.0010)比较,RPA1-shRNA组(0.3374±0.0009)的RPA1蛋白表达明显减低,差异有统计学意义(P<0.05, 图1b)。

Fig. 1 Establishment of CNE-2R cell with silencing RPA1a: RPA1 mRNA was detected by RT-PCR assay; b: Protein of RPA1 was detected by Western blot assay##P<0.01 vs CNE-2R group; **P<0.01 vs NC-shRNA
2.2 RPA1低表达对CNE-2R细胞增殖的影响。
与CNE-2R和NC-shRNA组相比,RPA1-shRNA组细胞增殖能力明显下降,差异具有统计学意义(P<0.01,图2a)。CNE-2R、NC-shRNA、RPA1-shRNA组形成克隆数分别为(175.33±11.50)、(186.33±74)、(138.33±4.51),RPA1-shRNA组与其它两组比较差异具有统计学意义(P<0.05,图2b、c)。说明RPA1低表达降低了CNE-2R细胞的增殖能力。

Fig. 2 Effect of knock-down RPA1 on the proliferation of CNE-2R cellA: CCK8 assay; b: Colony formation assay*P<0.05,**P<0.01 vs CNE-2R group; #P<0.05,##P< 0.01 vs NC-shRNA group
2.3 RPA1低表达对CNE-2R细胞迁移的影响
RPA1-shRNA组细胞划痕愈合率为[(0.56± 0.28)%]显著低于CNE-2R组[(0.79±0.02)%]及NC-shRNA组[( 0.74±0.55)%] (P<0.05,图3)。说明RPA1低表达后CNE-2R细胞的迁移能力下降。

Fig. 3 Effect of knock-down RPA1 on the migration of CNE-2R cell using Scratch test(×200)
2.4 RPA1低表达对CNE-2R细胞侵袭的影响
实验结果表明,RPA1-shRNA组侵袭细胞数为(90.00±4.00)个,分别与CNE-2R组[(97.30± 4.50)个]和NC-shRNA组[(43.00±7.20)个]比较,差异具有统计学意义(P<0.05,图4)。说明RPA1低表达后CNE-2R细胞侵袭能力降低。

Fig. 4 Effect of RPA1 down-regulation on invasion of CNE-2R cell with the use ofTranswell assay(×200)*P<0.05 vs CNE-2R group; #P<0.05 vs NC-shRNA
2.5 RPA1低表达对CNE-2R细胞周期的影响
RPA1-shRNA组G2/M期细胞的比率明显高于CNE-2R、NC-shRNA组,RPA1-shRNA组与其它两组比较差异具有统计学意义(P<0.01,表2)。说明RPA1低表达导致CNE-2R细胞G2/M期阻滞。
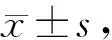
Tab. 2 Effect of RPA1 silence on cell cycle distribution of CNE-2R cells(%, n=3)
2.6 RPA1低表达对CNE-2R细胞周期相关蛋白的影响
Western blot检测结果显示:Chk2在RPA1-shRNA组的表达明显低于CNE-2R组和NC-shRNA组,差异具有统计学意义(P<0.05), 而p-Chk2在RPA1-shRNA组的表达显著高于其它两组(P< 0.05);细胞周期节点调控蛋白Cdc25c在RPA1-shRNA组的表达显著低于CNE-2R组和NC-shRNA组(P<0.05,P<0.01), 而p-cdc25c在RPA1-shRNA组的表达显著高于其它两组(P<0.05, 图5)。

Fig. 5 Effect of RPA1 silence on the expressions of proteins associated with cell cycle of CNE-2R cells*P<0.05 vs CNE-2R group; #P<0.05,##P<0.01 vs NC-shRNA group
3 讨论
远处转移是鼻咽癌治疗失败的主要原因之一,目前尚缺乏预测鼻咽癌转移的分子指标。同源重组修复是DNA损伤修复主要通路之一。复制蛋白A(RPA1)是DNA损伤修复过程中的主要蛋白之一,它不仅在DNA损伤后修复过程中发挥关键作用,而且在减数分裂中维持全基因组稳定性方面也起着重要的作用。人类RPA(hsRPA)是由三个亚型组成的复合体,即RPA1、RPA2、RPA3。每个亚基含有一个或多个结构域,不同的结构域其功能都是不相同的[7]。由于RPA1结构域多,被认为是该异源三聚体中最重要的亚基。已有多项研究发现,RPA在多个肿瘤组织中高表达,而且高表达的患者局部控制率及生存率都差,食管癌组织中RPA1的表达水平与肿瘤的浸润深度以及淋巴结转移明显相关[8];晚期浸润性膀胱癌患者中,RPA1和RPA2低表达者愈后差[9];结肠癌中,RPA1在转移病灶中高表达,而在原发灶中低表达[4]。我们的前期研究也发现[5],RPA1在放射敏感的鼻咽癌组织中低表达,而在放射抗拒的组织中高表达。因此笔者推测RPA1可能参与了鼻咽癌的远处转移。慢病毒介导的RNA干扰技术是由双链RNA诱发的基因沉默现象,当细胞中导入与内源性mRNA编码区同源的双链RNA时,该mRNA发生降解而导致基因表达降低。近年来这一技术被广泛应用于各类疾病的研究中[10-12]。 本研究采用慢病毒介导的RNA干扰技术,将携带有RPA1的慢病毒转染辐射抗拒的人鼻咽癌CNE-2R细胞,通过RT-PCR和Western blot技术检测RPA1 mRNA及蛋白质的表达,研究发现RPA1-shRNA组细胞中RPA1 mRNA和蛋白质的表达均低于CNE-2R组和NC-shRNA组(P<0.05), 表明RPA1低表达CNE-2R细胞模型建立成功。
RPA在DNA损伤修复过程中起着关键作用,它可以使双联DNA解旋,并且招募聚合酶将三磷酸核苷整合到新合成DNA链,保持基因组的完整性。RPA1缺陷将导致DNA自发性损伤,启动DNA复制检查点,抑制细胞有丝分裂甚至导致细胞死亡[13]。 Wang等[14]的研究表明,RPA1低表达SK-HEP-1细胞的增殖能力减退,RPA1高表达HuH-7细胞增殖能力增加。Zou等[15]分别在胃癌细胞和卵巢癌细胞中发现,RPA1低表达阻滞了DNA的复制和细胞的增殖。本研究发现,RPA1低表达对放射抵抗的人鼻咽癌CNE-2R细胞的增殖能力下降,提示RPA1可能参与鼻咽癌细胞的增殖。
重组同源修复通路中的多个蛋白参与了肿瘤的侵袭和迁移。Wang等[16]发现BRCA1下调增加了胶质瘤细胞的迁移。Chiu等[17]发现,RAD51上调使食管癌细胞的侵袭和迁移能力增加。卢其腾等[18]发现,激活的PARP-1可以促进鼻咽癌CNE2细胞的侵袭和迁移。RPA1是否参与了肿瘤的转移目前尚无相关的报道。本研究发现,RPA1被敲低后,CNE-2R细胞的侵袭及迁移能力降低。表明RPA1可能参与了鼻咽癌细胞的侵袭和迁移。这还有待于进一步研究。
细胞周期检查点激酶2(Chk2)在维护基困组稳定性及准确传代过程中起重要作用[19]。既往研究显示[20],Cdc25C是Chk1和Chk2作用的下游分子, 活化的Chk2可作用于Cdc25C参与细胞周期调节。放射治疗可以激活Chk2在Thr68位点的磷酸化,Chk2参与了DNA损伤信号通路[21]。该研究发现,RPA1低表达使CNE-2R细胞周期阻滞于G2/M期。进一步通过Western blot实验检测了与细胞周期调控相关蛋白的表达。结果表明,在RPA1-shRNA组中Chk2、Cdc25c低于对照组,而p-Chk2、p-cdc25c高于对照组。这可能为RPA1敲减后阻碍了CNE-2R细胞染色体的复制,导致了染色体结构的不稳定,其结构最终发生了改变,从而诱导ATM自身磷酸化后被激活,活化的ATM再进一步磷酸化细胞周期检查点激酶2(Chk2),磷酸化的Chk2再磷酸化Cdc25c磷酸酯酶,最终导致了细胞周期停止在G2/M期[19]。
综上所述,本研究表明RPA1低表达抑制了辐射抵抗人鼻咽癌CNE-2R细胞增殖、迁移,导致细胞周期阻滞于G2/M期。这可能为鼻咽癌的预后判断和治疗提供了新的靶点。
