Tg及TSGF在甲状腺癌诊断中的应用价值分析
2021-12-10杨春媚
杨春媚 梁 涛
广东省茂名市人民医院检验科,广东茂名 525000
近年来,甲状腺癌在全球范围内的发病率迅速增长,据相关研究机构数据统计显示,甲状腺癌在我国的发病率呈每年15%的速度持续增长,现已成为发病率增长速度最快的实体恶性肿瘤[1-2]。甲状腺癌是起源于甲状腺滤泡上皮或滤泡旁上皮细胞的恶性肿瘤,是临床上非常常见的一种头颈部恶性肿瘤,在所有头颈部恶性肿瘤中大约可占有35%。甲状腺癌患者常表现出无痛性颈部肿块或结节,且在早期患病阶段也常无明显症状,但当发现有颈部肿块进行性增大或出现呼吸困难、吞咽困难、颈静脉怒张、声音嘶哑等表现时,说明已出现有甲状腺癌的可能[3-4]。因此,早诊断、早治疗才是治疗疾病、改善预后的关键。肿瘤特异性生长因子(tumor specific growth fanctor,TSGF)是一种新型的肿瘤标志物,与恶性肿瘤血管增殖密切相关,在对肿瘤性质进行鉴别时,敏感性和特异性均比较高;而甲状腺球蛋白(thyroglobulin,Tg)则是诊断甲状腺癌的另一标志物[5]。临床研究表明,对患者的Tg、TSGF水平进行检测,可提高甲状腺癌的临床诊断价值。在此,本研究就Tg和TSGF在甲状腺癌诊断中的意义进行探讨研究,现报道如下。
1 资料与方法
1.1 一般资料
选取2019年1月至2020年12月茂名市人民医院(我院)收治的良性甲状腺病变患者150例(良性组)和甲状腺癌患者150例(恶性组),所有患者均因甲状腺肿块或者颈部不适或体检就诊时发现,经超声检查、病理证实确诊。另选取同一时期于我院进行检查的150名健康受检者(对照组)。其中,良性组男70例,女80例,年龄42~79岁,平均(54.9±3.3)岁,包括有结节性甲状腺肿90例,慢性甲状腺炎38例,甲状腺腺瘤22例;恶性组男101例,女49例,年龄41~76岁,平均(54.3±3.7)岁,包括甲状腺乳头状癌99例,滤泡状癌30例,髓样癌15例,未分化癌6例,伴有颈部淋巴结转移85例,无颈部淋巴结转移65例;对照组男96例,女54例,年龄39~71岁,平均(53.7±4.1)岁。三组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究已得到医院医学伦理委员会的批准。
1.2 纳入及排除标准
1.2.1 纳入标准 恶性组:纳入经临床病理学检测后被确诊为甲状腺癌,并且认知清晰、配合度高、临床资料齐全,自愿接受本研究的患者。良性组:纳入患有甲状腺结节,且经甲状腺超声诊断报告表现为结节较小、质地较韧、活动度较好,提示为良性病变并且自愿加入本研究的患者。对照组:纳入同时期来我院进行健康体检未发现任何异常,并自愿接受本研究的人员。
1.2.2 排除标准 ①合并有精神障碍、严重肝肾功能障碍及其他恶性肿瘤者;②配合度低者;③孕妇以及肾上腺疾病等容易导致研究结果出现偏差者。
1.3 检测方法
所有患者在采血前12 h禁食水,并停用所有药物,第二日清晨于空腹状态下抽取3 ml肘部静脉血,在将血清离心分离后作为备用。
1.3.1 Tg检测 检测患者血清Tg水平时采用瑞士罗氏EIecsys 2010全自动电化学发光免疫分析仪及罗氏公司配套Tg试剂盒进行测定,在测定过程中要严格按照试剂盒上的操作说明书进行,以Tg水平超过78 ng/ml作为判定阳性的标准[3]。
1.3.2 TSGF检测 检测患者血清TSGF水平时通过日立7600 020ISE全自动生化仪及TSGF试剂盒(福建新大陆生物技术有限公司)进行测定,测定过程严格按照说明书进行操作,OD值通过生化比色法读取,标准曲线将根据试剂盒提供的标准来进行制作,从中得出TSGF值,以TSGF水平超过72 U/ml作为判定阳性的标准。
1.4 观察指标
比较三组血清Tg、TSGF水平;按照病理学检测结果将恶性组患者分为Ⅰ期(44例)、Ⅱ期(39例)、Ⅲ期(40例)、Ⅳ期(27例),比较不同分期甲状腺癌患者的血清Tg、TSGF水平。
1.5 统计学处理
采用SPSS 22.0统计学软件进行数据分析,计量资料以()表示,多组间比较采用F检验,各组间分别比较采用LSD-t检验,计数资料以[n(%)]表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 三组血清Tg、TSGF水平比较
对照组血清Tg、TSGF水平均明显低于良性组(t=3.861,P=0.005;t=4.322,P=0.001),而良性组的血清Tg、TSGF水平均明显低于恶性组(t=5.733,P=0.000;t=7.214,P=0.000),见表1。
表1 三组血清Tg、TSGF水平比较(± s)

表1 三组血清Tg、TSGF水平比较(± s)
组别 n Tg(ng/ml) TSGF(U/ml)良性组 150 53.27±6.32 62.42±5.72恶性组 150 81.53±13.01 124.31±59.61对照组 150 20.11±2.14 18.31±15.03 F值 14.617 28.177 P值 0.000 0.000
2.2 不同分期甲状腺癌患者的血清Tg、TSGF水平比较
Ⅰ期和Ⅱ期血清Tg、TSGF水平比较,差异无统计学意义(t=0.784,P=0.446;t=0.811,P=0.177);Ⅳ期患者的血清Tg与TSGF水平显著高于Ⅰ期、Ⅱ期、Ⅲ期患者(Tg:t=16.258,P=0.000;t=13.642,P=0.000;t=11.318,P=0.000;TSGF:t=17.624,P=0.000;t=14.721,P=0.000;t=10.334,P=0.000);Ⅲ期患者的血清Tg与TSGF水平显著高于Ⅰ期、Ⅱ期患者(Tg:t=9.221,P=0.000;t=7.448,P=0.000;TSGF:t=8.463,P=0.000;t=4.339,P=0.000)。见表2。
表2 不同分期甲状腺癌患者的血清Tg、TSGF水平比较(± s)
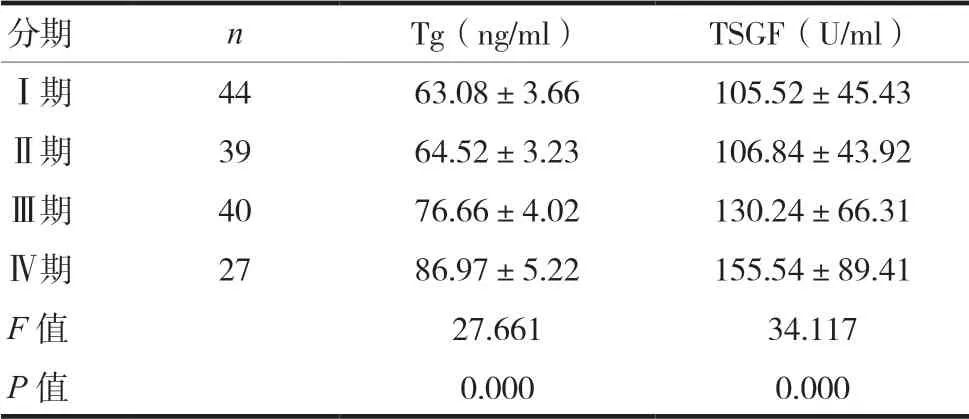
表2 不同分期甲状腺癌患者的血清Tg、TSGF水平比较(± s)
分期 n Tg(ng/ml) TSGF(U/ml)Ⅰ期 44 63.08±3.66 105.52±45.43Ⅱ期 39 64.52±3.23 106.84±43.92Ⅲ期 40 76.66±4.02 130.24±66.31Ⅳ期 27 86.97±5.22 155.54±89.41 F值 27.661 34.117 P值 0.000 0.000
2.3 血清TSGF、Tg阳性率与颈部淋巴结转移的关系
与无颈部淋巴结转移的甲状腺癌患者相比,伴有颈部淋巴结转移的甲状腺癌患者血清TSGF、Tg阳性率更高,差异有统计学意义(P<0.05),见表3。
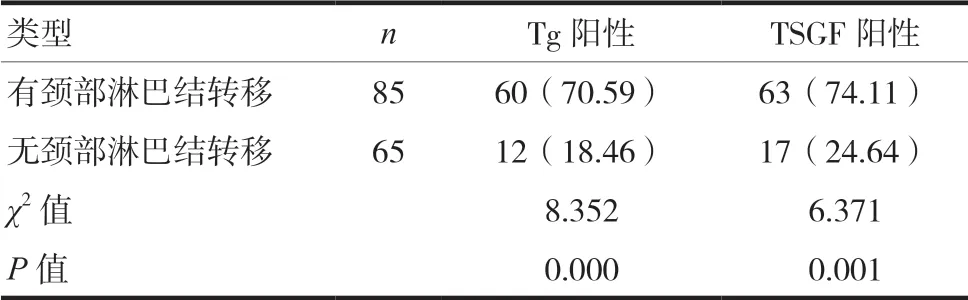
表3 血清TSGF、Tg阳性率与颈部淋巴结转移的关系[n(%)]
3 讨论
甲状腺是位于喉结下前方的内分泌腺体,能够分泌出甲状腺素和降钙素,并以此来控制机体的代谢平衡。而甲状腺癌则是一种起源于甲状腺滤泡上皮或者滤泡旁上皮细胞的恶性肿瘤,目前,临床上对于该病的确切病因尚且不能完全确定,但认为与癌基因、生长因子、碘摄入情况、电力辐射、性别、遗传等因素息息相关[5-7]。大多数甲状腺癌患者在患病初期是无任何临床症状,通常都在体检就诊、甲状腺触诊或超声检查中发现甲状腺肿块,甲状腺肿块质地较硬,且发展迅速,可会累及表面皮肤并呈现出暗红色,病情发展至晚期阶段时,会出现局部肿块疼痛,并出现气管压迫、食管移位等压迫症状,严重威胁患者的生命健康安全。因此,为使甲状腺癌患者获得早期治疗及提高治愈率,关键在于早发现、早诊断、早治疗[8]。目前,临床方面对于甲状腺癌的诊断方法主要有物理学、组织细胞学及化学方法三种,前两种方法包括有颈部彩超、CT、细针穿刺细胞学检查、甲状腺核素扫描等,但这主要是用于甲状腺癌患者的晚期诊断中,并且操作复杂、费用较高,误诊率也较高,并不适用于甲状腺癌的早期临床诊断中。而化学方法则是对肿瘤标志物的检测,操作简单,价格便宜,且具有较高的敏感性和特异性,是目前甲状腺癌早期临床诊断的重要方法之一[9-10]。
Tg水平是由甲状腺滤泡上皮细胞合成的一种大分子糖蛋白,是判断体内是否有功能性甲状腺组织存在的重要肿瘤标志物[11-12]。甲状腺分化癌手术前血清Tg值对诊断没有意义,因为非甲状腺癌的甲状腺疾病患者血Tg也可以升高,而甲状腺癌患者的血Tg也可以正常。甲状腺分化癌手术前血Tg水平和肿瘤大小成正相关[13]。一般情况下,在正常人血清中,Tg水平是以微量存在的,但在发生甲状腺癌变时,Tg会因正常甲状腺组织遭到破坏而释放并进入血液中,从而使血液中的Tg水平逐渐升高,此外,肿瘤本身也会释放出Tg,进而会使血清Tg水平明显升高。因此,对血清中的Tg水平进行检测,可以有助于甲状腺癌的早期临床诊断,同时还可作为诊断和监测分化型甲状腺癌复发或转移的重要指标。
TSGF是恶性肿瘤在形成和生长过程中,由于肿瘤及周边毛细血管大量增殖而释放到外周血液中的因子,是恶性肿瘤及周边毛细血管大量扩增的表现[14]。TSGF是一种新型的、具有较高敏感性的广谱肿瘤标志物,对正常组织的血管增生无明显作用,是鉴别良性和恶性肿瘤的重要指标,在癌肿形成的最初时期,TSGF会释放到血液中并达到一定的浓度,从而使血液中TSGF水平明显升高,到癌肿形成晚期,血液中TSGF浓度会更高。一般情况下,TSGF会在临床症状体征发生前的3~6个月即可被检测出来,因此,TSGF常被广泛应用于甲状腺癌患者的早期诊断中。
本研究对150例良性甲状腺病变患者和150例甲状腺癌患者及150名健康人员的血清Tg、TSGF水平进行比较,发现甲状腺癌患者的血清Tg、TSGF水平及阳性率均明显高于良性甲状腺病变患者,且良性甲状腺病变患者明显高于健康受检者(P<0.05),表明在对甲状腺癌的临床诊断中,对血清Tg、TSGF水平进行检测具有较高的特异性和敏感性,其临床诊断意义明显。此外,在对150例甲状腺癌患者进行研究还发现,随着甲状腺癌患者病程的加重,其血清Tg、TSGF水平也呈现出逐步上升的趋势,说明病情的加重会促使Tg水平和TSGF水平升高,说明其与甲状腺癌的病程具有一定的相关性。对恶性组的患者中是否出现颈部淋巴结转移进行分析,结果显示伴有颈部淋巴结转移的甲状腺癌患者的血清TSGF、Tg阳性率高达70.59%、74.11%,与无颈部淋巴结转移组间比较差异有统计学意义(P<0.05),说明血清TSGF、Tg对判断患者是否伴有颈部淋巴结转移具有一定的参考价值,该检测结果与李小民[15]所报道的伴有颈部淋巴结转移的甲状腺癌患者的血清TSGFg阳性率为70%、Tg阳性率为75%基本相符。本研究未对恶性组患者进行相关的治疗后的血清TSGF、Tg进行分析,尚有不足,仍需广大医学工作者参与到此类研究中。
综上所述,Tg、TSGF在甲状腺癌的早期临床诊断中具有非常重要的意义,有助于甲状腺癌的早期发现,并且还能为甲状腺癌的病情程度、是否出现颈部淋巴结转移提供判定依据,此外,再加上Tg、TSGF检测操作简单、价格便宜、结果稳定,可作为甲状腺癌早期诊断的重要手段之一。
