磁珠法与分离法在人乳头瘤病毒基因分型检测中的比较
2021-12-10陈晓佳方炳雄洪妙玲庄蓓丽
刘 琪 陈晓佳 方炳雄 洪妙玲 庄蓓丽
广东省普宁市人民医院精准医学中心,广东普宁 515300
人乳头瘤病毒(human papillomavirus,HPV)是一种球形无包膜环状双链DNA病毒,主要通过性传播感染人皮肤和黏膜上皮。宫颈癌是目前女性最常见的生殖道恶性肿瘤,极大地威胁着女性的生命和生殖健康,HPV持续感染是宫颈癌发病的主要原因[1]。当前随着磁珠法在病毒核酸检测中的普及应用,全自动核酸提取仪利用磁珠法提取核酸,提高了核酸的提取效率,降低了人工操作误差,实现了病毒核酸的高灵敏与高通量检测[2-4]。但是在新试剂和新仪器应用前,需进行相关性能验证。D'Souza等[5]也指出前处理方法的不同也会影响HPV的分型结果。因此本研究通过比较磁珠法与传统手工法(分离法)两种提取核酸的方法在HPV分型结果的一致性,利用室间质评来评价准确度,比较两种提取方法的DNA浓度与A260/A280比值,从这三个方面来评价全自动核酸提取仪在HPV分型检测中的应用,为实验室实现HPV全自动核酸提取提供依据。
1 资料与方法
1.1 一般资料
收集普宁市人民医院门诊妇产科和性病科2020年12月至2021年1月114份女性宫颈脱落细胞标本和21份男性下生殖道分泌物标本。纳入标准:适合用阴道张开器暴露宫颈取材,错开月经期的成年女性;取材顺利的成年男性;愿意参与本实验室研究,临床资料完整的患者。排除标准:严重疾病;行宫颈切除术后的女性患者;不能完成本研究全过程的患者。
1.2 仪器与试剂
磁珠法的提取试剂、分离法的提取试剂、HPV核酸扩增试剂、HPV杂交检测试剂盒以及宫颈脱落细胞保存液均来自潮州凯普生物化学有限公司。仪器主要有全自动核酸提取仪(潮州凯普生物化学有限公司HBNP-4801A)、超微量分光光度计(赛默飞NanoDrop2000)、PCR扩 增 仪(东 胜ETC811)、AutoMax全自动核酸分子杂交仪(潮州凯普生物化学有限公司HBHM-900A)、干式恒温器(杭州奥盛仪器有限公司)等。
1.3 检测方法
1.3.1 样本采集 所有标本采集均经过医生征得患者知情同意。女性宫颈脱落细胞由医生以阴道张开器暴露宫颈,在宫颈口轻轻搓动,宫颈刷使其顺时针旋转几周,确保取得足够量的脱落细胞,取出宫颈刷,将其放入取样管中。男性用细小棉拭子伸入尿道2~5 cm,捻动拭子采集脱落细胞。2020年广东省临床检验中心发放的10份室间质评DNA标本。
1.3.2 HPV DNA的提取 ①磁珠法:将标本充分混匀,转移300 μl标本到96深孔板,按照试剂说明书加入相应的试剂,置于全自动核酸提取仪HBNP-4801A中。通过破裂细胞以释放DNA,利用磁珠吸附原理,通过磁棒吸附、转移和释放磁珠,实现自动完成核酸的提取,60 μl TE溶液溶解DNA。②分离法:将标本振荡混匀,转移800 μl到EP管中,10 000 g离心5 min,去上清。加入溶液Ⅰ400 μl充分振荡混匀,在干式恒温器上100℃加热15 min。瞬时离心后,加入400 μl异丙醇,振荡混匀后,室温静置2 min,10 000 g离心5 min,去尽上清液。室温静置10 min后,加入60 μl TE溶液溶解DNA,静置10 min后,10 000g离心5 min,上清液即可用于PCR扩增。③DNA浓度比较的时候,磁珠法提取DNA浓度值/3×8校正之后,再与分离法比较,使得两种方法的初始标本量一致。
1.3.3 HPV DNA扩增 取1 μl的HPV DNA模板加入到扩增试剂体系中,按下列PCR扩增程序进行基因扩增:20℃ 10 min;预变性95℃ 9 min;变性95℃ 20 s,退火55℃ 30 s,延伸72℃ 30 s,40个循环;72℃ 5 min;4℃ HOLD。
1.3.4 杂交 采用基因扩增技术及导流杂交原理,杂交膜上包被有基因型别特异性探针与变性扩增产物(单链DNA)进行杂交,采用碱性磷酸酶系统定性检测,从而对21种HPV基因亚型[高危型:16、18、31、33、35、39、45、51、52、53、56、58、59、66和68亚型;低危型:6、11、42、43、44和CP8304(81)亚型]进行分型检测。
1.3.5 准确度 通过分析2020年广东省临床检验中心室间的质评结果,从室间质评结果比对实验室定性检测结果的一致性,从而评价和判断利用两种不同提取方法的DNA对实验室定性检测结果的影响。
1.4 统计学分析
应用SPSS 20.0统计学软件进行统计分析。比较DNA浓度,使用箱式图绘制,进行Mann-Whitney检验分析;比较A260/A280比值,采用配对t检验,P<0.05为差异有统计学意义。两种核酸提取方法对114份女性宫颈脱落细胞样本的检测结果进行一致性检验,当kappa值≥0.75时,认为一致性较好;0.4<kappa值<0.75时,认为一致性一般;当kappa值≤0.4时,认为一致性较差。
2 结果
2.1 两种核酸提取方法的结果比较
2.1.1 女性宫颈脱落细胞标本的检测结果 将114份女性宫颈脱落细胞标本充分混合后,利用磁珠法和分离法进行核酸提取。对两种核酸提取方法的检测结果进行一致性检验,kappa值为0.950,认为磁珠法和分离法进行核酸提取在HPV分析中的检测结果一致性较好,见表1。

表1 女性宫颈脱落细胞标本的检测结果
2.1.2 男性脱落细胞标本的检测结果 在21份男性脱落细胞标本中加入1000 ml的生理盐水,充分振荡后,利用磁珠法和分离法进行核酸提取。其中磁珠法的基因扩增反应质量控制点(IC点)和杂交显色质量控制点均显色,检测成功率为100.00%(21/21);分离法的21份标本中有2份IC质量控制点失控,检测失败,检测成功率为90.47%(19/21),见表2。

表2 男性脱落细胞标本的检测结果
2.2 准确度比较
10份室间质评样本分别利用磁珠法和分离法进行DNA提取,两种提取方法的HPV分型检测结果与省室间质控结果均一致,结果一致率为100.00%(10/10)。两种提取方法的HPV分型结果准确度符合要求,见表3。
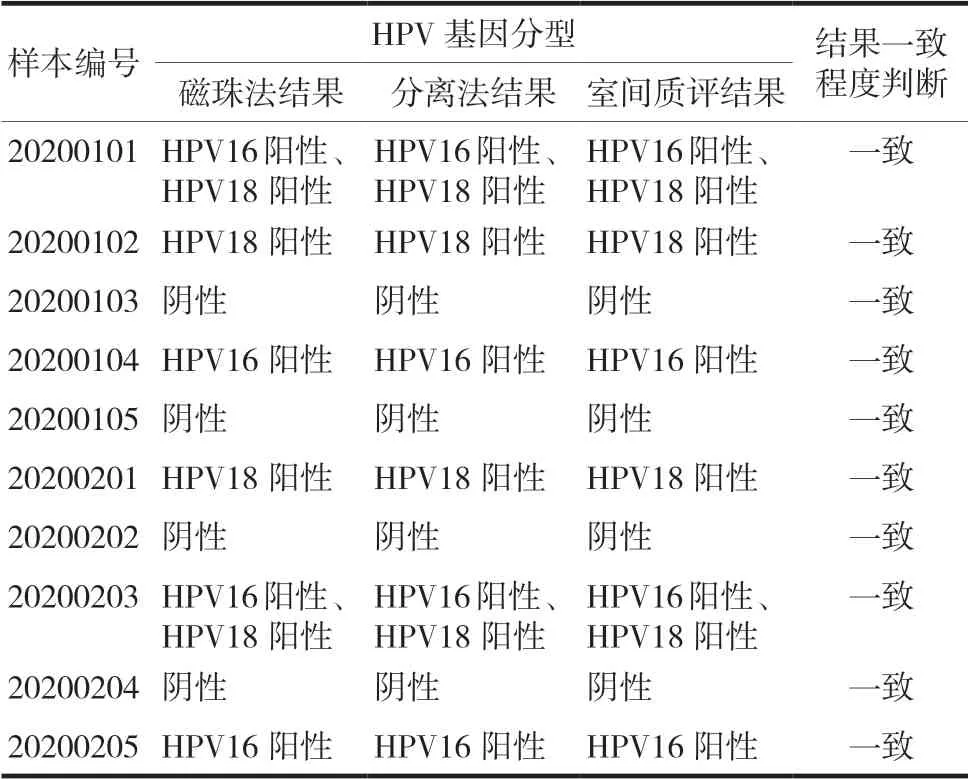
表3 两种核酸提取方法的准确度实验结果
2.3 DNA浓度与A260/A280比值比较
由于磁珠法和分离法提取时,加入的样本量不一致,其中磁珠法是用300 μl样本进行提取,分离法是用800 μl样本进行提取。为了更好地比较两种提取方法对DNA浓度的影响,本研究磁珠法提取DNA浓度值/3×8进行校正后,再与分离法比较,使得两种方法的初始标本量一致。磁珠法提取的DNA浓度箱式图显示中位数为20.53 μg/ml,四分位数为(12.53,44.00)μg/ml;分离法提取的DNA浓度箱式图显示中位数为11.30 μg/ml,四分位数为(3.60,30.10)μg/ml,磁珠法提取DNA的浓度比分离法高,差异有统计学意义(Z=-3.600,P=0.001),见图1。
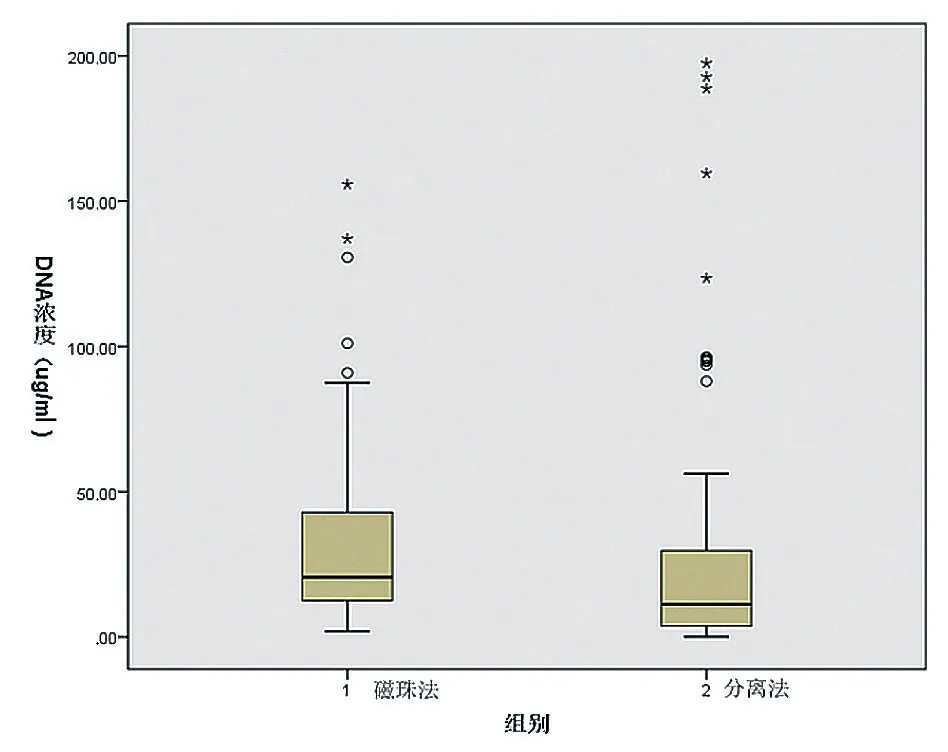
图1 两组提取方法的DNA浓度的比对
磁珠法提取的DNA A260/A280比值为(1.60±0.06),分离法为(1.27±0.12),磁珠法提取DNA的纯度比分离法高,差异有统计学意义(t=5.972,P=0.001),见图2。
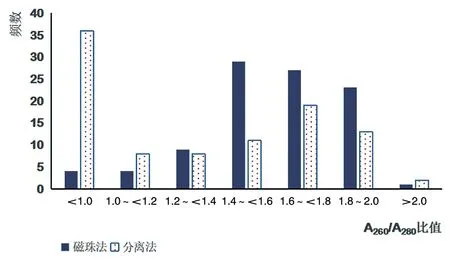
图2 两种提取方法的DNA A260/A280比值的比对
3 讨论
随着HPV疫苗的推广以及宫颈癌防治知识的不断普及,广大女性对宫颈癌认知程度逐渐提高。但是调查表明,中国大学女性HPV疫苗知晓率和接种率普遍较低,需要加强相关宣传和疫苗接种工作[6]。HPV感染率在普遍人群中并不低,方炳雄等[7]前期研究结果显示,本地区19 178例女性样本HPV感染率为16.94%,并且以高危型HPV感染为主(81.55%)。深圳市罗湖区HPV女性感染率为19.77%[8]。高危型人乳头瘤病毒(HR-HPV)感染,可引起阴道微生态异常,导致宫颈病变[9]。宫颈癌的发生,主要由高危型HPV持续感染导致,对HR-HPV进行分型检测,实施高危人群的分层管理对降低宫颈癌和癌前病变发生具有重要意义[10]。在日常工作中发现,女性宫颈脱落细胞标本中血性标本和多黏液样本还是占有一定比例的,血性样本可能与采样时间或者采样部位有病变有关系。许琼等[11]指出血性样本在高血红蛋白的情况下,会抑制PCR反应,干扰HPV分型检测的结果。而多黏液样本中存在大量的黏液蛋白,影响DNA的提取质量。在分离法试剂说明书中提及针对多血液样本和多黏液样本的前处理,针对多血液样本要先利用已灭菌的纯化水进行一次或多次漂洗;针对多黏液样本需要充分振荡混匀,必要时需取出取样刷来吸取底部样本,增加了工作步骤而且也增加交叉污染的可能性。因此,寻求一种高效率、高质量的HPV核酸提取方法能更好地服务临床。
本研究共收集114份女性宫颈脱落细胞标本、21份男性脱落细胞标本以及10份室间质控品来评价磁珠法与分离法在HPV分型检测中的应用,结果显示,磁珠法与分离法在HPV分型检测中结果一致性较好(kappa值为0.950),室间质评检测结果的一致率为100.00%。提示两种核酸提取方法的检测结果差异无统计学意义。
影响DNA浓度的因素很多,除了初始样本量、提取方法外,还受提取后加入的溶解DNA溶液量的影响。磁珠法按试剂说明书中加入300 μl的振荡混合后的样本进行提取的,而分离法则是加入800 μl的振荡混合后的样本进行提取的;两种方法都是使用60 μl TE溶液溶解DNA;本研究在DNA浓度比较的时候,磁珠法提取DNA浓度值校正之后,再与分离法比较,使得两种方法的初始标本量一致。比较两种提取方法,磁珠法提取DNA的浓度比分离法高,差异有统计学意义(P<0.05)。
女性宫颈脱落细胞样本中存在部分血性样本和多黏液样本。血性样本中含有血红蛋白,多黏液样本中含有大量的蛋白质,分离法无法完全去除,使得分离法提取的DNA中残存有蛋白质,A260/A280的比值偏低。A260/A280的比值是核酸纯度的指标,判定有无蛋白质污染。而磁珠法是将游离的核酸分子特异地吸附到磁性颗粒表面,经过两次洗涤,能较好地将样本中的黏液蛋白等杂质有效去除,从而保证提取核酸溶液的高纯度。
男性HPV阳性感染率不低,多重感染患者中,以高低危亚型混合感染为主[12]。男性HPV混合亚型的增加,尤其是高危HPV感染的增加,由于男性高危HPV感染者可以通过性传播感染女性,因此对男性HPV感染者基因型检测并进行积极治疗,对预防和减少女性HPV高危感染以及预防宫颈癌的发生具有重要意义[13-14]。但是由于男性脱落细胞样本因为取样量小,在临床工作中提取失败的可能性较大。在本研究中,同时利用磁珠法与分离法对同一男性脱落细胞标本进行DNA提取,结果显示分离法在21份样本中有2份检测失败,分析原因发现这2份样本的DNA浓度两种核酸提取方法均小于5 μg/ml,利用磁珠法提取的DNA纯度在1.5左右,而分离法在0.5左右。表明磁珠法在样本量较少的情况下,仍能保持较高的DNA纯度,提高检测的灵敏度。
有学者对采用基质辅助激光解吸电离飞行时间质谱检测系统检测18种HR-HPV进行性能验证,性能良好,能达到科研和临床的要求[15]。基于二代测序的宏基因组高通量测序平台也为HPV分型检测提供新的思路。但因质谱检测系统、高通量测序平台价格昂贵、技术操作难度较高,尚未能在临床上广泛应用[16]。
综上所述,磁珠法提取的HPV-DNA浓度和纯度更高,能达到下游检测的检测限,在取样量较少的男性脱落细胞中有明显优势。而且全自动核酸提取仪具有操作简便、减少人工失误、能实现大通量检测等优点,更适合临床应用。
