多核和双核丝核菌侵染水稻过程中细胞超微结构变化及细胞壁降解酶活性的差异
2021-12-09魏松红张照茹李昕洋王海宁
魏松红,段 淯,张 优,张照茹,李昕洋,刘 伟,王海宁
(沈阳农业大学植物保护学院,沈阳110161)
丝核菌属(Rhi zoctonia)真菌隶属于担子菌门(Basidiomycota),根据细胞核数量,该属真菌可分为单核丝核菌、双核丝核菌和多核丝核菌[1-2]。丝核菌属真菌大多数种类为植物病原菌,常导致多种农作物病害,如水稻纹枯病、小麦纹枯病、马铃薯黑痣病以及烟草靶斑病等。其中水稻纹枯病是我国水稻三大病害之一,水稻纹枯病优势病原菌为多核丝核菌——立枯丝核菌(Rhizoct oni a solani),而双核丝核菌——水稻丝核菌(Rh izoctonia oryzae-sativae)也可侵染水稻,但致病力较弱[3]。张照茹等[4]利用不同丝核菌属真菌的特异性引物对分离自我国东北地区的214株水稻纹枯病菌进行病原菌种类鉴定,结果表明:供试菌株分属于立枯丝核菌和水稻丝核菌,占比分别为92.52%和7.48%。张优等[5]利用水稻品种辽星1号对分离自我国东北地区的112株立枯丝核菌(多核菌株)和20株水稻丝核菌(双核菌株)进行致病性测定,结果表明:多核菌株和双核菌株间致病力差异明显,多核菌株均属强或中等致病型,双核菌株均属中等或弱致病型。
丝核菌属植物病原菌具有典型的死体营养型病原菌侵染特征,死体营养型植物病原真菌在侵入寄主时主要有三大致病因子:机械侵入、细胞壁降解酶和毒素[6]。丝核菌属植物病原菌机械侵入方式主要是以菌丝直接穿透水稻表面细胞和形成侵染垫和附着胞等侵染结构进行侵染。MATSUURA[7]通过扫描电子显微镜观察了立枯丝核菌侵染水稻的侵染过程,结果表明:病原菌菌丝体首先在寄主表面扩展,之后形成初级分枝和侧枝,侧枝顶端膨大形成附着胞或侧枝聚集在一起形成侵染垫,附着胞和侵染垫再形成侵染钉侵入水稻组织。多数植物病原真菌可分泌多种细胞壁降解酶,能够破坏寄主细胞壁结构。陈夕军等[8]利用3,5-二硝基水杨酸法对接种至Marcus培养液和水稻叶鞘的立枯丝核菌产生的细胞壁降解酶种类及酶活性进行了测定,结果表明:立枯丝核菌在人工培养和活体接种条件下可产生PG酶、PMG酶、Cx酶、PGTE酶和PMTE酶,其中PG酶、Cx酶和PMG酶活性较高,而PGTE酶和PMTE酶活性很低。毒素是植物病原菌代谢过程中产生的对寄主有害的非酶类化合物,能在很低的浓度下破坏植物的正常生理功能[9]。陈夕军等[10]利用薄层色谱、高效液相色谱、红外光谱和气质联用对立枯丝核菌(R.solani)毒素组分进行了测定,结果表明:立枯丝核菌毒素中含有葡萄糖、N-乙酰氨基甘露糖和蔗糖,不含苯甲酸、苯乙酸及其衍生物。
本研究选取3株立枯丝核菌(多核菌株)和2株水稻丝核菌(双核菌株),利用扫描电子显微镜和透射电子显微镜对两者侵染水稻叶片的超微结构进行观察;利用3,5-二硝基水杨酸法对病原菌产生的细胞壁降解酶种类及活性进行测定,明确不同种类及核相的丝核菌对水稻叶片致病过程中主要细胞壁降解酶种类,探究菌株致病力与细胞壁降解酶种类及活性间的相关性;利用实时荧光定量PCR技术对多核菌株与双核菌株在侵染过程中PG基因的表达情况进行分析,研究结果可为丝核菌属植物病原菌致病机制、水稻纹枯病抗病育种以及综合防控奠定理论基础。
1 材料与方法
1.1 材料
供试多核菌株为立枯丝核菌(R.solaniAG1-IA)LND06、LND18和LND21,双核菌株为水稻丝核菌(R.oryzae-sativaeAG-Bb)JLS07和JLS10,均保存于沈阳农业大学植物保护学院水稻病害研究室。供试水稻品种为辽星1号,由辽宁省农业科学院提供。供试Trizol提取试剂盒(B511321)和反转录试剂盒(B639277)购自生工生物工程(上海)股份有限公司。
供试PDA培养基用于供试菌株活化[11];Marcus培养基用于诱导供试菌株产生细胞壁降解酶;诱导供试菌株产生PG、PMG、PGTE和PMTE酶时,以柑橘果胶为底物;诱导供试菌株产生Cx酶时,以羧甲基纤维素钠为底物[12]。
1.2 方法
1.2.1 病原菌侵染结构的显微观察 将供试菌株LND06和JLS10分别于PDA培养基活化2d和5d,待供试水稻生长至4叶期时,打取直径5mm的菌饼接种至稻苗第2叶中央,分别于接种后0,12,24,48,72h时进行取样。
与不同接种时间的接种样品病健交界处切取1 mm2作为观察样品,根据日立Regulus 8100冷场发射扫描电镜和蔡司LSM 510透射电子显微镜操作说明进行样品制备、观察和拍照。
1.2.2 病原菌细胞壁降解酶的提取与活性测定 将供试菌株LND06、LND18、LND21、JLS07和JLS10于PDA培养基活化后,打取5块直径5mm菌饼接种至100mL Marcus培养液中,28℃静置培养6d,过滤后4℃、15000r·min-1离心20min,保留上清液(粗酶液)备用。
用3,5-二硝基水杨酸法制作葡萄糖标准曲线和半乳糖醛酸标准曲线,按BRADFORD法[13]制作牛血清蛋白标准曲线。
Cx活性测定参考胡长志等[14]报道的方法进行;PG和PMG活性测定参考王丹等[15]和DOUAIBER等[16]报道的方法进行;PGTE和PMTE活性测定参考高增贵等[17]报道的方法进行。
1.2.3 病原菌PG基因的表达差异 将供试菌株LND06、LND18、LND21、JLS07和JLS10于PDA培养基活化,待供试水稻生长至4叶期时,打取直径5mm的菌饼接种至稻苗第2叶中央,分别于接种后0,12,24,36,48,72h时取样,液氮速冻后-80℃保存,每个处理3次重复。
利用DNAMAN软件设计供试菌株LND06、LND18、LND21、JLS07和JLS10P G基因及内参基因引物(表1)。多核菌株(LND06、LND18和LND21)PG基因序列为NCBI网站下载序列(登录号为KP896519),双核菌株(JLS07和JLS10)P G基因序列为对菌株JLS07进行高通量测序所得。

表1 水稻纹枯病菌多核菌株与双核菌株P G基因荧光定量PCR引物序列Table 1 Fluorescent quantitative PCR primer sequence of multinucleate isolates and binucleate isolates
将水稻叶片样品在Trizol中充分研磨,50mg样品使用0.5mL Trizol,按Trizol提取试剂盒(B511321)提取方法提取总RNA,用反转录试剂盒(B639277)进行cDNA合成。
利用TB GreenPremix Ex Ta qTMⅡ(Tli RNaseH Plus)荧光定量PCR试剂盒(RR820Q,Takara公司)进行荧光定量PCR反应。
1.2.4 数据分析 试验所得数据结果采用SPSS 17.0软件进行显著性差异分析。
2 结果与分析
2.1 丝核菌多核菌株与双核菌株侵染过程中菌丝及水稻叶片细胞结构的显微观察
2.1.1 多核菌株与双核菌株侵染过程中菌丝结构的扫描电镜观察 由图1可知,多核菌株LND06在侵染12h时,菌丝已生长至水稻叶片表面,已有侵染垫形成;在侵染24h时,菌丝丰富、侵染垫数量达到最多;在侵染48h和72h时,侵染垫数量并没有显著增加。双核菌株JLS10在侵染12h时,菌丝未生长至水稻叶片表面,在侵染24h时,水稻叶片表面形成少量侵染垫,在48h和72h时,菌丝密集程度及侵染垫的数量逐渐增多但显著少于多核菌株LND06。

图1 丝核菌多核(LND06)与双核菌株(JLS10)侵染过程的扫描电镜观察Figure 1 Scanning electron microscopic observation on the infection process of multinucleate isolates(LND06)and binucleate isolates(JLS10)of Rhi zoctini a spp.
2.1.2 多核菌株与双核菌株侵染过程中水稻叶片细胞结构的透射电镜观察 由图2可知,病原菌侵染水稻叶片前,水稻细胞核清晰,叶绿体结构完整,被膜清晰,线粒体膜清晰,嵴明显。多核菌株LND06侵染水稻叶片12h时,水稻叶绿体膨胀、形状不规则;侵染24h时,水稻叶绿体膜消解;侵染48h时,叶绿体内部结构解体,可观察到菌丝。双核菌株JLS10在侵染水稻叶片12h和48h时,水稻叶肉细胞内的细胞器均无明显变化;在侵染48h时,可观察到菌丝。

图2 丝核菌多核(LND06)与双核菌株(JLS10)侵染过程的透射电镜观察Figure 2 Transmission electron microscopic observation on the infection process of multinucleate isolates(LND06)and binucleate isolates(JLS10)of Rh izoct inia spp.
2.2 丝核菌多核与双核菌株细胞壁降解酶的活性差异
由图3可知,供试多核菌株5种细胞壁降解酶活性显著高于双核菌株,供试多核菌株(LND06、LND18和LND21)PG、PMG、Cx、PGTE和PMTE活性平均值分别为677.06,457.43,279.91,27.07,22.10U·mg-1。供试双核菌株(JLS07和JLS10)PG、PMG、Cx、PGTE和PMTE活性平均值分别为46.07,32.64,42.64,11.12,8.42U·mg-1。供试多核菌株间5种细胞壁降解酶活性具有显著性差异,其中供试多核菌株LND06产生的5种细胞壁降解酶活性最高,其PG、PMG、Cx、PGTE和PMTE活性分别为860.46,567.89,336.94,35.65,24.67U·mg-1。供试双核菌株间差异较小,仅在PGTE和PMTE活性具有显著性差异。
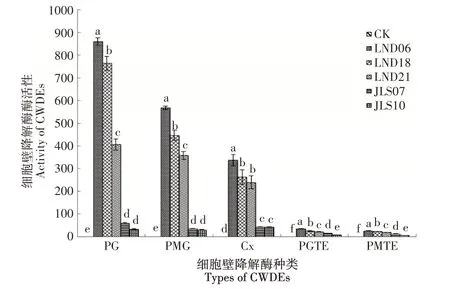
图3 丝核菌多核与双核菌株细胞壁降解酶活性差异Figure 3 Difference of activity of CWDEs of multinucleate isolates and binucleate isolates of Rhi zoctini a spp.
2.3 丝核菌多核与双核菌株染水稻过程中PG基因表达量的差异分析
由图4可知,多核菌株(LND06、LND18和LND21)和双核菌株(JLS07和JLS10)在侵染水稻过程中P G基因表达均呈先上升后下降的趋势,供试多核菌株在侵染水稻过程中不同时间点P G基因的表达量均高于双核菌株。供试多核菌株LND06、LND18和LND21的P G基因表达量均在侵染第24h达到最高,其相对表达量分别为6.33,5.09,3.66;供试双核菌株JLS07和JLS10的PG基因表达量均在侵染第48h达到最高,其相对表达量分别为0.77和0.48。
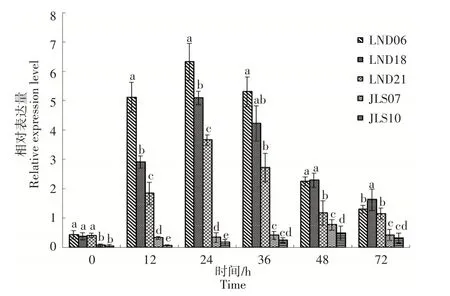
图4 丝核菌多核菌株与双核菌株侵染水稻叶片过程中PG基因表达情况Figure 4 Expression of PG gene in rice leaves infected by multinucleate isolates and binucleate isolates of Rh izoct inia spp.
3 讨论与结论
丝核菌属真菌可导致多种农作物病害的发生,可侵染水稻的丝核菌属病原菌种类及融合群主要为多核丝核菌立枯丝核菌的AG1-IA、AG1-IB、AG1-IC、AG4-HGⅠ、AG4-HGⅡ、AG5、AG6-GW融合群、水稻斑枯丝核菌(R.or yzae)和双核丝核菌的水稻丝核菌AG-Bb融合群[18-19],其中立枯丝核菌AG1-IA融合群是水稻纹枯病的优势病原菌。多核丝核菌和双核丝核菌在生物学特性、致病力和药剂敏感性等方面均存在较大差异[20-21]。分析菌株间致病力差异对于研究丝核菌属病原菌导致的水稻病害的发生流行以及种群动态具有重要意义。本研究结果表明:在侵染水稻叶片过程中,多核菌株菌丝密集程度及侵染垫的数量显著多于双核菌株。多核菌株在侵染24h时,可观察到水稻叶片内部器官开始分解。双核菌株在侵染48h时,仅观察到菌丝,未发现水稻叶片内部器官分解。多核菌株与双核菌株均可以产生PG、PMG、Cx、PGTE和PMTE,且PG酶活性均最高,多核菌株与双核菌株产生酶种类相同而活性不同,供试多核菌株的细胞壁降解酶活性显著高于双核菌株。P G基因在多核菌株与双核菌株侵染过程中均上调表达,多核菌株在24h时表达量最高,双核菌株在48h时表达量最高,其后下降,多核菌株的表达量明显高于双核菌株。
在自然环境中,丝核菌属真菌常存在致病力分化现象,这种致病力分化主要是由于菌丝融合产生的异核现象或有性繁殖产生担孢子提高了基因重组的频率[22-23]。LIU等[24]认为立枯丝核菌中dsRNA的存在减弱了菌株的致病力。周梦琳等[25]对立枯丝核菌不致病菌株Rs3和野生型菌株侵染水稻时的侵染结构进行观察,发现Rs3不能正常形成侵染垫和附着胞结构。进一步的重测序结果表明:与野生型菌株相比,Rs3菌株的基因组存在大量的SNP和Indel,主要涉及菌丝生长相关的Actin基因,致病相关的cAMP通路、MAPK通路、钙离子信号通路以及效应因子等。DORRANCE等[26]认为立枯丝核菌致病力与其生存环境和营养环境有关。曾泉等[27]研究结果表明以蛋白胨、硫酸铵、硝酸钠、氯化铵、硝酸钾为氮源培养的立枯丝核菌均表现出较强的致病力,而以甘氨酸和尿素为氮源培养的立枯丝核菌致病力相对较弱。本研究以2种可侵染水稻的不同核相的丝核菌属真菌为研究对象,初步明确了二者间致病力差异的产生原因是由于侵染过程中菌丝扩展速度、侵染垫形成数量、细胞壁降解酶活性以及PG基因表达量,研究结果可为进一步了解丝核菌属真菌和水稻纹枯病菌的致病机制奠定理论基础。
