自然状态下油松感染松材线虫后的生理响应
2021-12-09秦世杰祁金玉刘仁军陈凤毛郝德君李治鑫孙守慧
秦世杰,祁金玉,刘仁军,陈凤毛,郝德君,李治鑫,孙守慧
(1.沈阳农业大学林学院,沈阳110161;2.沈阳市森林资源监测中心,沈阳110136;3.南京林业大学林学院,南京210037)
松材线虫病(Pine wilt disease)是一种由松材线虫(Bursaphel enchus x yloph ilus)引起的松科植物毁灭性的世界性森林病害。我国自1982年首次在南京中山陵发现以来,该病不断扩散蔓延,造成大量的松树死亡,成为近几十年来我国发生和危害最为严重的林业病害[1]。截止到2020年,该病害已在我国18个省的666个县级行政区发生[2],累计致死松树10亿多株,造成经济损失达1000亿元[3]。短短几十年间,该病由南向北快速扩散,从热带和亚热带地区逐步入侵至暖温带,突破了10℃年均温度线,最北端已到辽宁北部多个县区,直接对我国东北地区大量的松林资源和景区造成了严重的威胁[4,5]。
植物受害虫或病原菌侵染后体内活性氧(ROS)迸发是植物对外界生物刺激应答的早期反应之一,在植物防卫反应中起着重要作用[6]。SOD、CAT、POD作为植物体重要的保护酶,可以通过清除多余的ROS来保护植物细胞免遭氧化损伤[7]。植物苯丙烷类代谢途径生成抗病次生物质木质素、植保素和酚类化合物等[8],是植物抗病反应中重要的代谢途径之一。研究表明,剑麻苯丙氨酸解氨酶(PAL)基因广泛参与调控纤维发育和逆境胁迫应答[9],也有研究证明PAL参与了黑米(black rice)对水稻黄单胞菌(Xanthomonas oryzaepv.oryzae)的抗性[10]。逆境条件下,植物通过大量积累甜菜碱、升高可溶性蛋白含量从而提高植物适应不良环境的能力[11-12]。植物防御反应的诱导是由多种信号物质共同调控的,SA、JA等内源激素是植物抗虫和病原菌中的重要信号转导分子[13],其受生物或非生物等外源信号刺激后可迅速发生变化,进而促使植物体形成防御性物质。
目前,我国自然感染松材线虫病的松树种类有16种。其中,辽宁地区主要以油松(P.t abulae formi s)、红松(P.k oraiensis)和落叶松(Larixspp.)为主[14-16]。油松做为沈阳市的市树,是沈阳市油松栎林群落中的主要树种,同时在辽宁西北地区的水土保持中发挥着重要作用[17]。国内对松材线虫病的致病机理研究多以试验室接种松树幼苗为主,胡凯基等[18]研究发现,油松苗接种松材线虫后有较高的致死率,2009年陕西省也曾发现自然状态下油松也可感染松材线虫病[14]。徐华潮[19]对黑松和马尾松被松材线虫自然侵染后不同感病阶段针叶光合作用、针叶光谱特征、含水量、色素、抗氧化酶活性、还原糖与矿质营养元素的变化以及对各阶段松树组织的影响进行过研究。但油松大树自然状态下感染松材线虫后其生理指标的变化规律尚未见报道。本研究以沈阳市东陵公园内70年生的油松为研究对象,测定受害油松与健康油松生理生化指标的变化,探讨寄主树木对松材线虫入侵的生理反应,以期为进一步深入研究松材线虫致病机制奠定基础。
1 材料与方法
1.1 材料
试验地设置在沈阳市东陵公园,位于市区东北部丘陵地带,海拔约90m(41°49′52.37″N~41°51′18.11″N,123°35′2.00″E~123°37′42.40″E)。林分组成以油松(P.tab ul ae f or mis)为主,占75%;落叶松(Lari x gmelinii)次之,占15%;另外,樟子松(P.sylvestr i s.var.mongol i ca)、榆树(Ulmus pumila)、蒙古栎(Quer cus mongoli ca)和皂荚(Gl ed i tsia s inensis)等阔叶树占10%。油松为林分主要乔木树种,树龄约70年,胸径27.48~44.55cm。
通过流脂法和定期取样法来确定自然状况下受害的样株,同时在未发病区域设置取样对照区。本文根据徐华潮[19]的划分标准,参照其感病早期和感病后期的症状划分标准确定本研究中的受害前期和受害后期两个阶段。受害前期小枝针叶为灰绿色并稍微下垂,但1年生针叶为绿色;受害后期小枝针叶发白、变黄,下垂程度更为严重,1年生针叶开始变为灰绿色并稍微下垂;健康对照小枝上针叶全部为绿色。于2019年10月分别选取受害前期、受害后期、健康(对照组)油松样树各3株,每株上各剪取3个枝条,摘取其1a生针叶立即放入液氮中冷冻保存备用。在测定时将每株树上3个枝条的针叶混合为1个样本,重复3次。
1.2 生理指标测定
1.2.1 酶活性测定 过氧化物酶(POD)活性采用POD试剂盒(试剂盒购自南京建成公司,下同)测定。将各处理针叶0.1g加入1.0mL提取液进行冰浴匀浆,4℃冷冻离心(8000g)10min,取上清,置冰上待测。分光光度计预热30min以上,调节波长至470nm,蒸馏水调零。POD检测工作液(在试剂1中加入14μL试剂2和9.5μL试剂3,混匀)在25℃水浴10min以上。加入10μL待测液和190μL工作液于微量石英比色皿中,在分光光度计470nm下测定吸光值,每隔1min读数1次,共测4min,取平均值,以每分钟A470变化0.01为1个酶活单位(U)。
超氧化物歧化酶(SOD)活性采用SOD试剂盒测定。将各处理针叶0.1g加入1.0mL提取液进行冰浴匀浆,4℃冷冻离心(8000g)10min,取上清,置冰上待测。分光光度计预热30min以上,调节波长至450nm。将试剂1和试剂2按照200∶1的比例混匀配制为工作液,试剂3蒸馏水稀释50倍,试剂45mL蒸馏水溶解。依次在微量石英比色皿中加入10μL待测液(测定管,对照管内加入10μL蒸馏水)、10μL试剂3、160μL工作液、20μL试剂4。充分混匀,室温静置30min后,450nm处测定各管吸光值。
过氧化氢酶(CAT)活性采用CAT试剂盒测定。将各处理针叶0.1g加入1.0mL提取液进行冰浴匀浆,4℃冷冻离心(8000g)10min,取上清,置冰上待测。分光光度计预热30min以上,调节波长至240nm,蒸馏水调零。CAT检测工作液在25℃水浴10min以上,迅速加入10μL待测液和190μL工作液于微量石英比色皿中,在分光光度计240nm下测定吸光值,每隔1min读数1次,共测4min,取平均值,以每分钟A240变化0.01为1个酶活单位(U)。
脂氧合酶(LOX)活性采用LOX试剂盒测定。将各处理针叶0.1g加入1mL试剂1进行冰浴匀浆,4℃冷冻离心(16000g)20min,取上清,置冰上待测。分光光度计预热30min以上,调节波长到280nm,蒸馏水调零。CAT检测工作液(试剂3中加入10mL试剂2,振荡混匀1min)在30℃水浴10min以上。依次在微量石英比色皿中加入20μL待测液(测定管,对照管内加入20μL蒸馏水)和180μL工作液,30℃反应30min后,280nm处测定各管吸光值。
苯丙氨酸解氨酶(PAL)活性采用PAL试剂盒测定。将各处理针叶0.1g加入1mL提取液进行冰浴匀浆,4℃冷冻离心(10000g)10min,取上清,置冰上待测。分光光度计预热30min以上,调节波长至290nm,蒸馏水调零。试剂2加入4mL蒸馏水充分溶解待用。依次在测定管(96孔UV板)中加入5μL待测液、145μL试剂1、40μL试剂2,在对照管(96孔UV板)中加入150μL试剂1、40μL试剂2,混匀,30℃准确反应30min,再分别加入10μL试剂3,混匀,静置10min后,290nm处记录测定各管吸光值。
1.2.2 可溶性蛋白和丙二醛(MDA)含量测定 可溶性蛋白含量采用蛋白含量测定试剂盒测定。将各处理针叶0.1g加入1.0mL提取液进行冰浴匀浆,4℃冷冻离心(10000g)10min,取上清,置冰上待测。分光光度计预热30min,调节波长到562nm,蒸馏水调零。可溶性蛋白含量测定工作液(试剂A和B按照50∶1的比例混合,盖紧后充分混匀)置于60℃水浴预热30min。依次在微量石英比色皿中加入4μL待测液(测定管;对照管内加入4μL蒸馏水;标准管内加入4μL标准品)、200μL工作液。混匀后置于60℃保温30min,于562nm处测定各管吸光值。
MDA含量采用MDA含量试剂盒测定。将各处理针叶0.1g加入1.0mL提取液进行冰浴匀浆,4℃冷冻离心(8000g)10min,取上清,置冰上待测。将试剂170℃加热并振荡以促进溶解,吸取0.3mL试剂1于1.5mL离心管中,再加入0.1mL待测液,混匀。95℃水浴中保温30min,置于冰浴中冷却,25℃离心(10000g)10min。吸取200μL上清液于微量石英比色皿中,测定532nm和600nm处的吸光值。
1.2.3 类黄酮和甜菜碱含量测定 类黄酮含量采用植物类黄酮试剂盒测定。将各处理样本针叶烘干至恒重,粉碎,过40目筛之后,称取0.02g,加入2mL提取液,60℃振荡提取2h,25℃离心(10000g)10min,取上清待测。分光光度计预热30min以上,调节波长至510nm,蒸馏水调零。在微量石英比色皿中加入108μL待测液(测定管,空白管内加入108μL蒸馏水)、6μL试剂1,混匀,25℃静置6min,再加入6μL试剂2,混匀,25℃静置6min,再加入80μL试剂3,混匀,25℃静置15min,测定510nm处各管吸光值。
甜菜碱含量采用甜菜碱试剂盒测定。将各处理样本针叶烘干至恒重,粉碎,过40目筛之后,称取0.02g,加0.8mL水,置于60℃提取30min,期间不断震荡。再加入200μL提取液,混匀后25℃离心(10000g)10min,取上清液待测。分光光度计预热30min以上,调节波长至525nm。将试剂1每瓶加20mL蒸馏水溶解,加390μL浓盐酸调pH值为1。在测定管中加入300μL待测液,空白管内加入300μL蒸馏水,各加入500μL试剂1,充分混匀,4℃中反应2h,25℃离心(12000g)10min,弃上清液。各加入500μL 99%乙醚,混匀后25℃离心(12000g)10min,弃上清液。置于通风橱使残余乙醚自然挥发干净。再各加入300μL 70%丙酮,震荡使沉淀充分溶解,取200μL于96孔板,记录各管在525nm处吸光值。
1.2.4 游离水杨酸(SA)和茉莉酸(JA)含量测定 SA含量采用SA测定试剂盒测定:称取0.3g样本,放入研钵中磨碎,加入1.0mL预冷的90%甲醇水溶液,4℃浸提过夜。离心(8000g)10min,取上清液,残渣用0.5mL 90%甲醇水溶液浸提2h,离心后取出上清液,合并两次上清,40℃减压蒸发至不含有机相(0.3mL水溶液),加入20μL 1mg·mL-1三氯乙酸水溶液,混匀震荡1min。加入1mL的乙酸乙酯与环己烷的混合液[1∶1(v/v)]萃取两次,转移上层有机相至新的EP管,氮吹吹干,加入0.5mL流动相溶解,混匀,针头式过滤器过滤后待测,检测结果是植物样本中游离SA。开启电脑、检测器和泵,安装上色谱柱,打开软件,在方法组中设置进样量10μL,流速0.8mL·min-1,柱温30℃,保留时间40min,荧光检测器,激发波长294nm,发射波长426nm,设置完毕保存方法组。用流动相过柱子,待基线稳定后开始加样。
JA含量采用JA试剂盒测定。称取0.3g样本,加入1mL试剂1研磨成浆,加入1.0mL试剂2,震荡混匀后移入EP管内,超声提取30min,离心(8000g)10min,取出上清液,残渣中加入0.3mL提取液,复提1次,合并两次上清液,氮吹仪上冰浴吹至不含有机相,水相用试剂6萃取脱色3次,除去有机相调节pH值为2.5~3.0,试剂7萃取3次,氮气吹干。加入200μL试剂3复溶,加入20μL试剂4,混匀后25℃常温放置30min。加入20μL试剂5,混匀后25℃常温放置30min。冰水水浴中氮气吹干。加入0.5mL流动相复溶,取适量溶液用针头式过滤器过滤于带有内衬管的样品瓶内待测。HPLC液相条件:流动相A为乙腈,流动相B为0.1%磷酸水溶液,等度洗脱,(60%的A+40%的B)。开启电脑、检测器和泵,安装上色谱柱,打开软件,在方法组中设置进样量10μL,流速0.8mL·min-1,柱温30℃,走样时间为40min,紫外检测器波长为210nm,设置完毕保存方法组。用流动相过柱子,待基线稳定后开始加样。
1.3 数据处理
采用Excel 2016软件进行数据统计,SPSS 22.0软件做ANOVA单因素方差分析及差异显著性检验。
2 结果与分析
2.1 感染松材线虫不同发病时期的抗氧化酶活性变化
4种抗氧化酶在受害前期、受害后期和健康对照组的活性测定结果见图1。POD活性从小到大依次为:对照组[(43.05±5.23)U·g-1]、受害前期[(51.51±6.14)U·g-1]、受害后期[(86.30±9.38)U·g-1]。受害前期较对照组POD活性升高19.66%,但无显著性差异;受害后期较对照组升高100.46%,差异性极显著(p<0.01);受害后期较受害前期升高67.52%,差异性极显著(p<0.01)(图1A)。SOD活性从小到大依次为:受害前期[(700.31±76.50)U·g-1]、受害后期[(829.57±93.14)U·g-1]、对照组[(893.10±24.17)U·g-1]。受害前期较对照组下降21.58%,差异性显著(p<0.05);受害后期较受害前期升高18.45%,但无显著性差异;受害后期较对照组下降7.11%,亦无显著性差异;受害后期较受害前期升高18.45%,同样无显著性差异(图1B)。CAT活性从小到大依次为:受害前期[(44.67±4.37)U·g-1]、受害后期[(56.59±6.56)U·g-1]、对照组[(67.84±8.04)U·g-1]。受害前期较对照组下降34.15%,差异性极显著(p<0.01);受害后期较对照组下降16.58%,但无显著性差异;受害后期较受害前期升高26.68%,亦无显著性差异(图1C)。LOX活性从小到大依次为:受害前期[(10.59±1.36)U·g-1]、对照组[(11.46±0.85)U·g-1)、受害后期[(13.45±1.80)U·g-1)。受害前期较对照组下降7.64%,但无显著性差异;受害后期较对照组升高17.32%,亦无显著性差异;受害后期较受害前期升高27.04%,差异性显著(p<0.05)(图1D)。
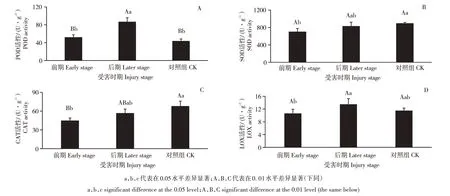
图1 油松针叶在不同受害时期抗氧化酶活性Figure 1 Antioxidant enzyme activity of Pinus tabulae formis needles at different injury stages
2.2 感染松材线虫不同发病时期的PAL活性
PAL在受害前期、受害后期和健康对照组的活性测定结果见图2。PAL活性从小到大依次为:受害后期[(41.31±5.28)U·g-1]、受害前期[(59.13±6.26)U·g-1]、对照组[(66.04±8.09)U·g-1]。受害前期较对照组下降10.47%,但无显著性差异;受害后期较对照组下降37.44%,差异性极显著(p<0.01);受害后期较受害前期下降30.13%,差异性显著(p<0.05)(图2)。
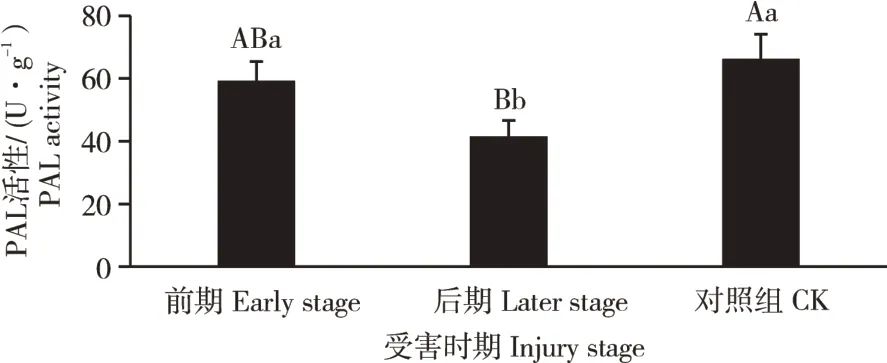
图2 油松针叶在不同受害时期PAL活性Figure 2 Activities of PAL in needles of Pinus tabulaeformis at different injury stages
2.3 感染松材线虫病不同时期的可溶性蛋白和MDA含量
可溶性蛋白和MDA在受害前期、受害后期和健康对照组的含量测定结果见图3。Spr含量从小到大依次为:对照组[(43.31±4.75)mg·g-1]、受害前期[(52.11±6.14)mg·g-1]、受害后期[(57.34±3.70)mg·g-1]。受害前期较对照组升高20.31%,但无显著性差异;受害后期较对照组升高32.39%,差异性显著(p<0.05);受害后期较受害前期升高10.04%,但无显著性差异(图3A)。MDA含量从小到大依次为:对照组[(14.30±1.71)nmol·g-1]、受害后期[(18.17±1.62)nmol·g-1]、受害前期[(23.74±2.78)nmol·g-1]。受害前期较对照组升高65.98%,差异性极显著(p<0.01);受害后期较对照组升高27.07%,但无显著性差异;受害后期较受害前期下降23.44%,差异性显著(p<0.05)(图3B)。
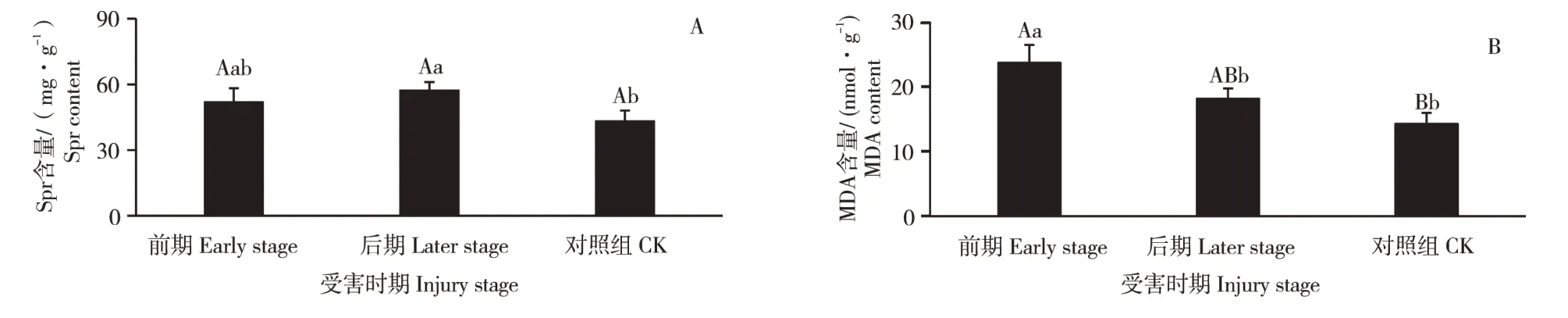
图3 油松针叶在不同受害时期Spr、MDA含量Figure 3 Content of Spr and MDA in needles of Pinus tabulae formis at different injury stages
2.4 感染松材线虫不同发病时期的类黄酮、甜菜碱含量
类黄酮和甜菜碱在受害前期、受害后期和健康对照组的含量测定结果见图4。类黄酮含量从小到大依次为:受害后期[(16.60±2.15)mg·g-1]、对照组[(19.23±1.96)mg·g-1]、受害前期[(26.34±3.33)mg·g-1]。受害前期较对照组升高37.01%,差异性显著(p<0.05);受害后期较对照组降低13.66%,但无显著性差异;受害后期较受害前期下降36.99%,差异性极显著(p<0.01)(图4A)。甜菜碱含量从小到大依次为:对照组[(4.71±0.58)mg·g-1]、受害后期[(5.41±0.68)mg·g-1]、受害前期[(6.54±0.84)mg·g-1]。受害前期较对照组升高38.87%,差异性显著(p<0.05);受害后期较对照组升高17.89%,但无显著性差异;受害后期较受害前期下降17.27%,亦无显著性差异(图4B)。
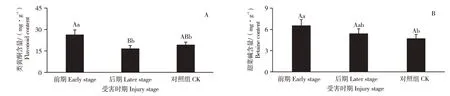
图4 油松针叶在不同受害时期类黄酮、甜菜碱含量Figure 4 Content of flavonoid and betaine in the needles of Pinus tabulae formis at different injury stages
2.5 感染松材线虫不同发病时期的SA和JA含量
SA和JA在受害前期、受害后期和健康对照组的含量测定结果见图5。SA含量从小到大依次为:对照组[(120.04±24.36)ng·g-1]、受害前期[(256.02±21.11)ng·g-1]、受害后期[(467.75±47.84)ng·g-1]。受害前期较对照组升高135.99%,差异性极显著(p<0.01);受害后期较对照组升高347.71%,差异性极显著(p<0.01);受害后期较受害前期升高211.73%,差异性极显著(p<0.01)(图5A)。JA含量从小到大依次为:对照组[(1.82±0.33)μg·g-1]、受害前期[(2.06±0.22)μg·g-1]、受害后期[(2.45±0.11)μg·g-1]。受害前期较对照组升高13.48%,但无显著性差异;受害后期较对照组升高34.97%,差异性显著(p<0.05)。受害后期较受害前期升高18.94%,亦无显著性差异(图5B)。

图5 油松针叶在不同受害时期SA、JA含量Figure 5 Content of SA and JA in needles of Pinus tabulaefor mis at different injury stages
3 讨论与结论
植物在逆境胁迫下体内会产生大量活性氧(ROS),如果在植物体内没有及时被清除,将会对植物体的生长发育产生极其严重的毒害作用,为维持正常的生长,植物将会通过抗氧化酶系统和抗氧化剂对其进行清除[20]。CAT、POD、SOD是植物体内主要的活性氧清除酶,它们的变化可以反映植物的抗逆性[21]。本试验中,油松大树受松材线虫感染后,在受害前期SOD、CAT含量均显著性下降,这与黑松及湿地松幼苗接种松材线虫后在12~72h的变化趋势一致[22]。此结果表明,油松大树受松材线虫感染后,SOD、CAT活性受到抑制,致使抗氧化酶活性降低。POD一般被认为是植物体重要的抗病酶,但研究表明,胁迫条件下POD活性快速升高,对植物自身有伤害作用[23]。油松大树受松材线虫感染后,POD活性持续上升,这与黑松、马尾松、火炬松幼苗上接种松材线虫后,48h 3种松树针叶内POD活性迅速上升,并在96h出现第2次高峰的结果一致[24]。严东辉等[25]发现松材线虫的体外酶有POD,因此,其活性的持续升高可能也与松材线虫数量的增多有关。MDA是膜脂质过氧化的主要产物之一,表示膜脂质过氧化的程度。本试验中油松大树受松材线虫感染后,受害前期MDA含量极显著性提高,与黑松幼苗接种松材线虫后,在12~72h的变化趋势一致[22]。MDA含量的增加表示着细胞膜脂质的过氧化程度加重,这可能是由于在受害前期SOD、CAT含量显著性下降所引起的。在受害后期虽然SOD、CAT含量有所升高,MDA含量有所下降,但膜脂过氧化已经导致薄壁细胞受损严重并大量死亡,油松小枝的生长势逐渐下降,趋于死亡。
渗透调节物质可溶性蛋白的增加和积累能提高植物细胞的保水能力,高浓度的可溶性蛋白能维持较低的渗透势,帮助植物抵抗环境胁迫,保护细胞的生命物质及生物膜活性[12]。本试验中油松大树受松材线虫感染后,可溶性蛋白含量持续增高,这与4~5年生黑松、马尾松在接种松材线虫后3~7d可溶性蛋白含量增高趋势一致[26]。在受害前期可能是由于松材线虫胁迫致使油松出现应激反应,可溶性蛋白含量陡然升高,用以增加细胞的渗透势来抵御不良环境。受害后期可溶性蛋白含量虽然有所增加但与受害前期没有显著性差异(p>0.05),这个结果和4~5年生黑松接种松材线虫7d后可溶性蛋白开始下降并于15d后低于对照[26]的结论不一致,原因可能是油松大树分泌可溶性蛋白的应激反应时间更长,但单纯通过提高可溶性蛋白的含量并不能有效地抵御松材线虫带来的伤害。植物体内类黄酮化合物有驱虫、抗病菌、抗氧化、视觉吸引等功效,谢佳璇[27]研究表明,叶片中总类黄酮含量与叶片提取物的抗氧化活性呈显著正相关。甜菜碱是一种广泛存在于动植物体内维持细胞稳定的重要渗透调节物质。在逆境条件下,植物体通过大量积累甜菜碱来降低渗透胁迫对细胞膜的损伤,保护三羧酸循环过程中主要酶的活性,稳定多肽在光合作用中的功能[11,28],从而提高植物适应不良环境的能力。叶施和根施外源甜菜碱均能减少叶片相对膜透性和MDA含量的升高,显著提高SOD、POD、CAT的活性[29]。本试验中,类黄酮和甜菜碱含量均表现为先上升后下降的趋势,这与湿地松、黑松幼苗接种松材线虫后类黄酮含量先增加后下降的趋势相同[30]。这样的变化趋势与SOD、CAT、LOX酶活性的变化趋势呈负相关,与MDA含量变化趋势呈正相关,表明松材线虫感染油松大树后,SOD、CAT、LOX等抗氧化酶活性受到了抑制,油松通过增加可溶性蛋白、类黄酮、甜菜碱等渗透调节物质和次生代谢物质来抵御松材线虫的造成的伤害。在受害后期,SOD、CAT、POD、LOX活性均有所增强以祛除多余的活性氧,可溶性蛋白虽有所增加,但和受害前期没有显著性差异,甜菜碱含量有所下降,类黄酮含量更是显著性下降。苯丙氨酸解氨酶(PAL)与植物次生物质木质素、黄酮类色素、异黄酮类植保素的合成相关,在植物抵御病虫侵害过程中起重要作用。编码转录因子MYB15的基因与JA应答松材线虫有关,MYB15通过调节木质素生物合成来调节对松材线虫的抗性[31]。SA和JA是植物体抗虫和病原菌的重要信号转导分子[13]。植物在受到生物或非生物刺激后,体内LOX活性剧增,JA含量也开始增加,诱导植物产生次生代谢物质,同时诱发植物产生生理生化上的变化,形成防御性结构[32-33]。JA信号在控制对松材线虫感染的防御反应中很重要,并且通过正调节剂和负调节剂的协调表达进行微调[31]。SA作为JA下游信号分子,与JA协调发挥作用,共同激发植物的抗性反应[34]。也有研究表明,松材线虫感染白皮松致使SA的含量升高,并导致整个树体的抗性反应[35]。本试验中,油松大树受到松材线虫感染后,针叶内SA、JA的含量均持续性升高,这与马尾松感病无性系接种松材线虫1~15d内SA、JA持续上升的变化趋势相同[36]。周文楠等[37]发现,JA衍生物水杨酸甲酯(MeJA)可以促进酚类物质和细胞壁的合成,激活防御和编码胁迫相关基因的表达,增强PAL、POD和其他抗病相关酶的活性。本试验中,SOD、CAT、LOX、PAL活性在受害前期都表现为下降趋势,SOD、CAT、LOX在受害后期都表现为上升趋势,但PAL却始终表现为下降趋势,这与马尾松接种松材线虫后PAL从植株出现症状后开始下降的结果一致[22,24]。导致松树最终死亡的原因是否与PAL活性持续下降有关,值得进一步探讨。
综上,松材线虫侵入油松,会抑制SOD、CAT、LOX等抗氧化酶活性的表达,产生对细胞有害的物质MDA等。油松自身也通过增加可溶性蛋白、类黄酮、甜菜碱等物质的含量抵御松材线虫的侵染。内源激素SA、JA持续性增加,协调发挥作用,共同激发油松的抗逆反应。在松树抵御松材线虫失败后,松材线虫突破寄主的防御系统,最终导致松树整株感病死亡。目前,在辽宁省防控松材线虫的严峻形势下,研究油松在感染松材线虫之后的相关抗性生理指标变化规律可以为进一步研究其抗病机理奠定基础。
