胡桃楸成花相关JmC O基因的克隆和表达分析
2021-12-09蔡佳友董天一傅靖棋范新蕊张丽杰
蔡佳友,董天一,傅靖棋,范新蕊,张丽杰
(沈阳农业大学林学院/辽宁省林木遗传育种重点实验室,沈阳110161)
高等植物成花是其生命周期的一个重要过程,植物在合适的时间开花保证了植物的正常授粉以及种子的正常发育。因此,成花与植物产量及品质密切相关,是植物生产的关键所在,也成为各国学者探索的热点问题。近年来,在对模式植物拟南芥成花的研究中发现,有4条主要的成花途径:光周期途径、春化途径、赤霉素途径、自主途径[1]。CO作为光周期途径中的关键基因,在植物开花中发挥着重要作用[2]。将光信号与生物钟信号进行整合,激活下游成花FT基因的表达,从而诱导植物开花[3]。PUTTERILL等[4]在1995年克隆得到拟南芥的CO基因,发现过表达CO基因的拟南芥植株可以实现提前开花。在此之后又相继在拟南芥中发现了16个CO-like基因,形成一个基因家族[5],该基因家族由保守的B-boxes锌指结构、CCT结构域以及不保守的中间结构域构成,其中B-boxes和CCT结构域在诱导植物开花中发挥着至关重要的作用[6]。CO基因作为植物成花过程中非常重要的一个转录因子,在光周期与开花过程中起到了重要的调控作用。RUIZ-GARCIA等[7-8]研究发现,CO基因可以激活SCO1基因进而启动花芽发育相关LFY基因进行表达以促进植物提早开花。
胡桃楸(Juglans mandshurica)为胡桃科(Juglandaceae)胡桃属(Juglans)落叶乔木[9],是我国东北地区珍贵的用材树种,同时也是我国重要木本粮油树种和果材兼用的经济林树种,集经济价值、营养价值和药用价值于一身。因此,胡桃楸的开发利用具有广阔发展前景。课题组在前期对胡桃楸生殖物候特征进行调查研究中发现,该物种由于具有雌雄同株异型异熟的生殖特性[9-10],导致其雌花与雄花发育不同步,同一植株花期不同,不同植株间雌雄花成熟先后有序,且十分稳定,这种生殖特性影响其授粉及坐果数量及质量。目前,对胡桃楸雌雄花芽发育及花期不同步等方面的研究较少,且对其雌雄性别分化过程中成花的分子机制尚未完全解析。因此,为更好地了解CO基因在光周期途径中调控胡桃楸花芽分化的分子机制,探究胡桃楸成花相关JmCO基因的功能和表达模式,本研究根据胡桃楸转录组数据库中筛选到CO基因片段,利用C O基因的差异片段设计上下游引物,利用PCR技术扩增克隆得到该基因的全长序列,并利用生物信息学软件对J mCO基因进行蛋白聚类及序列特征分析、系统进化分析等。利用荧光定量PCR技术分析JmC O基因在胡桃楸不同器官、组织中的表达量情况,为进一步研究胡桃楸成花的分子调控机制奠定基础。
1 材料与方法
1.1 材料
试验的植物材料为2020年5月取自辽宁省实验林场胡桃楸天然林幼嫩叶片、雌、雄花芽、果实等,经过液氮速冻,存于超低温冰箱-80℃中,保存备用。
1.2 引物设计
利用胡桃楸花芽转录组数据筛选的CO基因差异片段,利用Primer 5.0设计上下游引物,由赛百盛生物公司合成,用于扩增C O基因全长。其引物序列见表1。
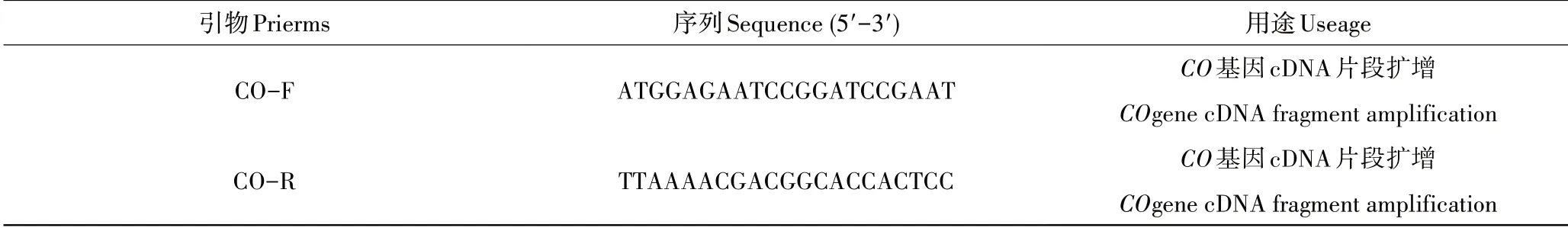
表1 胡桃楸C O基因片段和DNA全长扩增引物Table 1 Primers used for full-length DNA of the J u glans mands hurica CO gene
1.3 胡桃楸基因组DNA及RNA提取
利用DNAsecurePlantKit试剂盒(G-CLONE公司)提取胡桃楸基因组DNA,利用RNAsecurePlantKit提取试剂盒(天根公司)提取胡桃楸不同器官的RNA,具体操作步骤参照说明书进行。用核酸蛋白仪(Thermo)检测核酸质量及纯度。
1.4 RT-PCR
PCR采用LA Taq酶(TAKARA),依照LA Taq酶说明书冰上操作。
1.5 胡桃楸成花相关C O基因CDS序列的克隆
反应扩增程序:95℃5min;94℃30s,59℃30s,72℃1min,35个循环;72℃7min,4℃∞。PCR反应体系(25μL):11.9μL ddH2O,加入上游引物1μL,下游引物1μL,加入模板DNA3μL,加入LA Taq Mix 4.1μL,体系共20μL。用1%琼脂糖凝胶测试扩增产物。
1.6 目的片段回收纯化、连接、转化
用DNA胶回收试剂盒(TaKaRa公司)进行片段回收,并利用pGM-T克隆载体做连接载体,转化至TOP10大肠杆菌感受态细胞,蓝白斑筛选并进行PCR鉴定。摇菌后送金唯智生物公司测序分析。
1.7 qRT-PCR
利用上海生物工程公司反转录试剂盒(上海生工)合成胡桃楸不同组织cDNA,利用兰博利德荧光定量试剂盒进行qRT-PCR验证,具体操作按照说明书冰上进行。
2 结果与分析
2.1 胡桃楸核酸质量和浓度检测
将提取的胡桃楸基因组DNA和RNA用1.0%琼脂糖凝胶电泳检测。由图1可知,DNA条带清晰无杂带,位于DL2000 marker的上方,位置正确,DNA浓度为50.9ng·μL-1,达到要求满足后续试验要求;RNA条带检测到2条谱带,清晰明亮,说明RNA完整性较好,不同器官组织的RNA OD260/OD280比值均在1.85~1.93之间,满足后续试验要求。

图1 胡桃楸基因组DNA和RNA电泳图Figure 1 DNA and RNA electrophoresis of J u glans mands hurica
2.2 胡桃楸成花相关C O基因的CDS序列克隆
以胡桃楸基因组DNA为模板,进行PCR扩增,得到长度600bp左右的1条特异性条带(图2),将回收的目的基因连接到T载体并进行大肠杆菌转化,筛选阳性菌液并进行PCR检测,菌液PCR扩增结果如图3,得到一条长度582bp左右的特异性条带。测序结果表明,该基因序列长度为582 bp,DNAMAN软件可通顺的翻译成194个氨基酸,具有完整的开放阅读框(ORF),表明已克隆获得了胡桃楸C O基因CDS序列。

图2 PCR扩增C O基因结果Figure 2 Ju glans mandsh uri ca CO amplification results

图3 胡桃楸成花相关C O基因菌液PCR扩增结果Figure 3 Results of colony PCR amplification of Juglans mand shurica C O gene
2.3 胡桃楸成花相关J mC O基因生物信息学分析
2.3.1 胡桃楸成花相关J m C O基因同源性分析 将克隆得到的胡桃楸成花相关JmC O基因的CDS序列在NCBI数据库进行基因同源性比对。结果表明,Blast比对得到的胡桃楸C O同源基因与核桃(Ju glans regia)核苷酸同源性达到97%、板栗(Castanea mol lissima)核苷酸同源性达到80%,并且与杨梅(Morella rub ra)、白栎(Quercus l obat e)、千金榆(Car pinus f angiana)、栓皮栎(Quercus sub er)等物种的CO基因同源性均达到78%以上(表2)。因此,将胡桃楸成花相关CO基因命名为JmC O基因。2.3.2 胡桃楸成花相关JmCO基因编码的蛋白质结构及理化性质分析 用DNAMAN软件对氨基酸序列进行分析,氨基酸成分编码的蛋白质C O基因共编码192个氨基酸;通过ProtParamExPASy在线软件分析胡桃楸成花相关JmCO基因的氨基酸序列理化参数。结果表明,其蛋白质分子式为C927H1451N275O298S11,分子量为2962,理论等电点pI值为8.3。不稳定指数为31.56,为稳定蛋白质。利用ProtParam在线软件对胡桃楸JmCO蛋白氨基酸组成进行分析;JmCO氨基酸组成中丝氨酸(S)最多,为11.4%;缬氨酸(V)、精氨酸(A)和天冬氨酸Asp(D)次之,分别为9.3%、8.3%;并且,此蛋白质中不含色氨酸(W)、吡咯赖氨酸(O)和吡硒半胱氨酸(M)。其中带正电荷总数为27个,带负电荷酸性氨基酸为25个,即整个蛋白质带正电荷。

表2 胡桃楸成花相关JmCO同源基因氨基酸序列与其他物种同源性比较Table 2 Comparison of amino acid sequence of JmC O homologous gene between Juglans mandsh urica and other species
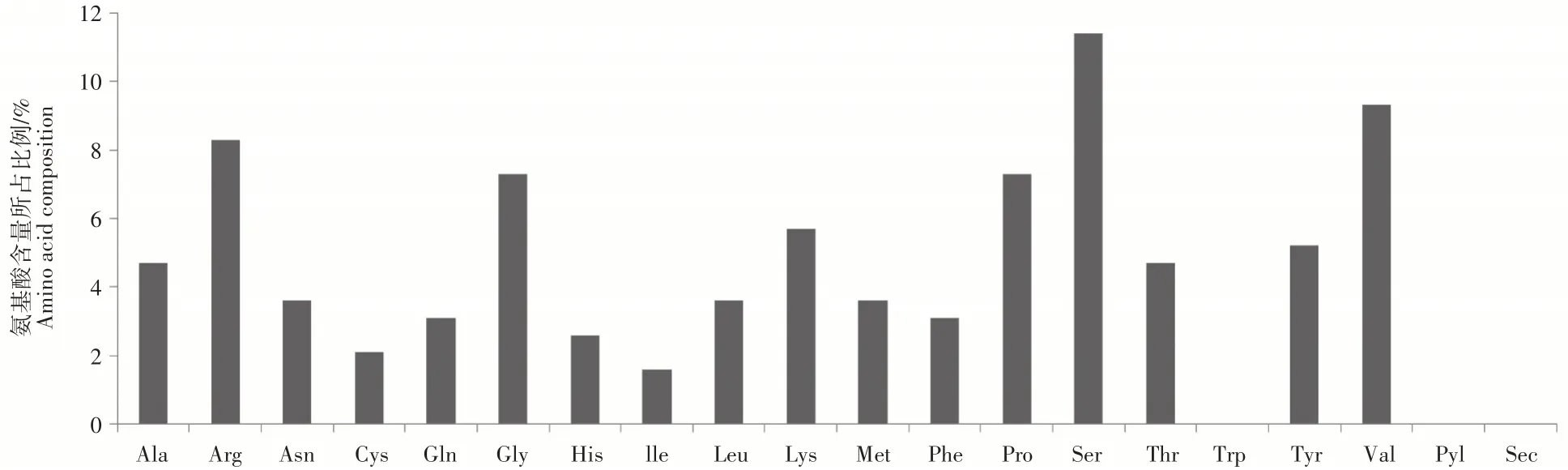
图4 胡桃楸成花相关JmCO基因所编码的蛋白质氨基酸组成Figure 4 The amino acid composition of J u glans mandh urica JmC O gene encoded protein
2.3.3 胡桃楸成花相关JmCO基因编码的蛋白质疏水性/亲水性及跨膜预测分析 通过在线软件ProtScale对胡桃楸成花相关JmC O基因编码的蛋白质进行亲疏水性预测分析(图5),可以看出,超一半图像位于负坐标处,这表明该JmCO蛋白属于亲水蛋白。

图5 胡桃楸成花相关J mC O基因所编码的蛋白质疏水性/亲水性Figure 5 Hydrophobic/hydrophilic of J u glans mands hurica JmCO gene encoded protein
跨膜结构能够准确了解蛋白质的特性。图6横坐标代表蛋白质各个氨基酸的位置,纵坐标为跨膜区域的可能性。若两者交换位置则表示此处经过了跨膜,通过在线分析软件SOPMA预测胡桃楸成花相关JmCO基因编码蛋白的跨膜结构。由图6可知,胡桃楸JmCO蛋白的1~192位氨基酸位于细胞膜外,且胡桃楸JmCO蛋白无跨膜功能。

图6 胡桃楸成花相关J mC O基因所编码的蛋白质跨膜预测Figure 6 Transmembrane prediction of the protein encoded by J mCO gene related to flower formation of Juglans mand shurica
2.3.4 胡桃楸成花相关JmC O基因编码的蛋白质保守结构域及亚细胞定位 通过在线软件Plant-mPLoc来预估胡桃楸成花相关JmCO蛋白在植物细胞内可能存在的位置,输入氨基酸序列后得到预测结果表明,胡桃楸成花相关JmCO基因编码蛋白存在于细胞核中(图7)。利用NCBI中的CDD数据库对JmCO蛋白保守区结构域进行预测,发现胡桃楸成花相关JmCO蛋白含有CCT和BBox保守结构域,隶属于CCT超家族。

图7 胡桃楸成花相关JmCO基因所编码的蛋白质亚细胞定位分析Figure 7 Subcellular localization analysis of the protein encoded by J u gl ans mandshur ica J mCO gene
2.3.5 胡桃楸成花相关JmCO基因编码蛋白聚类分析 为进一步了解胡桃楸成花相关JmCO基因的功能和特征,利用MEGA7.0生物软件对包含胡桃楸成花相关JmCO基因在内的21个物种的CO基因编码的氨基酸系统进化树。由图8可知,胡桃楸成花相关JmCO蛋白首先与核桃(J uglans r e gi a)JrCO的亲缘关系最近,然后与杨梅(Morella r ub ra)MrCO、白栎(Quercus lobate)QlCO、栓皮栎(Quer cus suber)QsCO聚在一个分支上,与巴旦木(Amygdalus communis)AcCO、红梅(Prunus mume)PmCO、秋子梨(Pyrus ussuriensis)PuCO、苹果(Malus pumila)MpCO、川桑(Morus notabilis)MnCO和枣树(Ziziphus jujuba)ZjCO的亲缘关系较近,与其他8种C O基因关系稍远,最后聚在一个大的分支上。

图8 胡桃楸成花相关JmCO基因所编码的蛋白质的系统进化树Figure 8 Phylogenetic tree of proteins encoded by J mC O gene related to flowering of J u glans mands hurica
将胡桃楸成花相关J mC O基因编码蛋白质的氨基酸序列与核桃、板栗、杨梅、白栎等其他物种CO蛋白氨基酸序列进行比对结果如图9所示,可以发现胡桃楸成花相关JmCO蛋白具有N端的缬氨酸富集区及CCT结构域。

图9 胡桃楸成花相关JmCO基因所编码的蛋白质与其他物种同源蛋白质氨基酸序列比对Figure 9 Amino acid sequence alignment of J mC O encoden protein related to flower formation of Ju gl ans mands hurica with CO homologous proteins in other species
2.3.6 胡桃楸成花相关JmCO基因编码的蛋白质二级结构的预测 预测蛋白质的二级结构可以帮助我们了解蛋白质的结构与功能的关系。因此,本研究通过在线分析软件SOPMA胡桃楸成花相关JmCO基因编码的蛋白质二级结构进行预测分析。胡桃楸JmCO蛋白由4种状态的二级结构组成,无规卷曲的氨基酸占整个蛋白的56.48%,延伸链占11.92%,β-折叠占5.92%,α螺旋占3.62%。
2.4 胡桃楸成花相关J mC O基因荧光定量表达分析
以Actin为内参基因,对胡桃楸不同器官中CO基因的表达进行了分析。由图10可知,胡桃楸成花相关Jm-C O基因在不同器官中均有表达,其相对表达量:雄花芽>雌花芽>茎>果实>叶片。胡桃楸成花相关基因J mC O在雌、雄花芽中表达量最高,而在叶片、果实和茎中表达量相对较低,说明胡桃楸成花相关JmCO基因参与了胡桃楸雌、雄花芽发育的整个过程,可以推测JmC O基因在胡桃楸的成花过程中发挥了重要作用。

图10 胡桃楸成花相关JmCO基因在不同组织中的表达Figure 10 Expression of Juglans mandsh urica JmCO in different tissues
3 讨论与结论
高等植物从营养生长转变为生殖生长,意味着植物的童期结束,因此,成花是植物生命周期非常重要的过程[10]。CO基因作为植物光周期途径中的关键基因,在植物成花过程中发挥了重要作用,可以诱导下游成花相关FT、LFY基因的表达,促进植物开花[11]。在长日照植物中,CO基因编码的蛋白质含B-BOX和CCT结构域,CCT结构域参与多种植物中参加成花诱导[12]。植物中不同的C O基因对开花时间的影响不同。在拟南芥中,过量表达C O L 1和COL2对开花时间不会产生显著的影响[13],而COL3则抑制开花,促进侧根和芽的发育,以及光形态建成[14],COL5在短日照条件下正调控开花[15]。CO基因在水稻[16]、小麦[17]、衣藻[18]中均有表达。陆地棉(Goss ypium h irsutum)GhCOL1参与了植物开花诱导[19],葡萄(Vitis vinifera)Vv CO L 1参与种子休眠调节[20],美洲黑杨(Populus deltoid es)的CO1和C O2基因参与了植物形态调节[21],拟南芥中的COL1基因、欧洲云杉(Picea abies)中的C O L 1基因与牵牛花(Ph arb i tis nil)中的C O L基因参与了植物昼夜节律调节[22-23]。赵志琴等[24]对草莓(Fra garia×ananassa)CO基因克隆和表达分析研究中发现Fa C O基因在草莓花芽发育过程中起着非常重要的调控作用[23]。由此可知,CO基因不仅可以调节植物开花,在种子休眠、植株形态调节、侧枝(根)分化、果实成熟、光形态建成、块茎发育等过程中也发挥着重要作用[25]。
本研究克隆获得胡桃楸成花相关J mC O基因CDS序列长为582bp,编码194个氨基酸。NCBI数据库Blast比对表明:胡桃楸成花相关JmCO基因与其他物种的CO基因同源性均在70%以上。胡桃楸JmCO蛋白分子式为C927H1451N275O298S11,分子量为21569.04Da;理论等电点8.3;对胡桃楸成花相关JmCO基因qRT-PCR进行表达分析,发现JmCO基因在胡桃楸雌、雄花芽中显著表达,推测该基因可能是胡桃楸雌、雄成花过程中的关键调控因子。这与赵志琴等[24,26]对水稻(Oryz a sativa)和草莓中CO基因的研究结果相一致。然而,目前对胡桃楸成花过程与CO基因之间的内在分子调控机制尚不清楚,且C O家族基因在胡桃楸中是否和其他物种中的C O基因一样参与光周期调节也尚不清楚,其功能需要进一步研究。因此,在后续研究中在本研究的基础上开展胡桃楸成花相关基因分子机理的研究,以期通过研究深入探讨L F Y、F T、C O、TF L、AP1等成花相关基因在胡桃楸成花过程中复杂的分子调控网络,探明胡桃楸成花的分子机理,为胡桃楸良种选育及优良基因资源保护奠定基础。
