发根农杆菌介导的白花草木樨毛状根转化体系的建立
2021-12-09王升升张吉宇
王升升, 段 珍, 张吉宇
(兰州大学草地农业生态系统国家重点实验室, 兰州大学草地农业科技学院, 甘肃 兰州 730020)
草木樨(Melilotusspp.) 是一年生或两年生的豆科(Leguminosae)草本植物[1-2],全世界共有 19 种,主要分布于欧亚大陆地中海区域、东欧和亚洲,白花草木樨是该属最广泛的栽培种之一[3-4]。草木樨适应环境能力强,可在许多牧草难以生长的盐碱等地区种植,且具有较强的抗逆性,其中抗盐和耐寒的能力在主要豆科牧草中尤其突出[5-6]。草木樨作为栽培面积仅次于紫花苜蓿的优良豆科牧草,营养价值十分丰富,其中粗蛋白质和粗脂肪的含量较高,并含有大量的胡萝卜素和矿物质等,是家畜的优良饲草[7-8]。草木樨根系发达,既能够固定空气中的氮气(N2),改善土壤肥力,又可以保持土壤,防治水土流失[9]。目前对于草木樨的研究主要集中在栽培技术研制[10]、化学成分鉴定[11]、分子标记开发[12]及草木樨属植物遗传多样性评价[13]等方面。骆凯等[14]从国内外引进了100份两年生的草木樨种质进行了农艺性状初步评价并分析了19份种质的品质性状;Di等[15]对草木樨属植物的形态学以及系统进化进行了研究;剡转转等[16]在白花草木樨中大规模开发设计了EST-SSR分子标记,进一步筛选了多态性高的标记;狄红艳等[17]分析了18个地理种群的黄花和白花草木樨的ITS序列和叶绿体trnL-trnF序列,研究了这两种草木樨之间的系统进化关系。但是,关于草木樨的突变体[18]和分子机制方面研究较少,Luo[19]和Wu[1]对草木樨的转录组和miRNAs进行了相关分析,但因为草木樨缺乏遗传转化方法,限制了对其基因功能的深入研究。
发根农杆菌(Agrobacteriumrhizogenes)是一种根瘤菌科的革兰氏阴性土壤杆菌,其携带的Ri质粒能够侵染几乎所有的双子叶植物和少数单子叶植物,诱导植物受伤部位长出毛状根,并产生大量有效的次生代谢产物[20]。目前,发根农杆菌介导的毛状根转化体系已成功应用到蒺藜苜蓿(Medicagotruncatula)[21]和大豆(Glycinemax)[22]等豆科植物中,用于验证结瘤等相关基因的功能。ROP6是小GTPases亚家族ROP基因家族的成员,已证实该基因在百脉根(Lotusjaponicus)[23]和蒺藜苜蓿[24]中正向参与共生固氮信号转导途径,但在草木樨中尚未研究。本研究以白花草木樨结瘤基因MaROP6为例,开发了一套高效的白花草木樨毛状根转化体系,为深入研究草木樨的基因功能奠定了基础。
1 材料与方法
1.1 试验材料
1.1.1植物材料 白花草木樨野生型Ma389(种子由加州大学洛杉矶分校的Hirsch教授友情提供)。
1.1.2菌株与质粒 发根农杆菌K599菌株(由中国科学院遗传与发育生物学研究所谢旗研究员课题组友情提供);DH5α大肠杆菌感受态(购自北京全式金生物公司);表达载体质粒pBI121-DsRed2,该载体带有DsRed2红色荧光蛋白标记基因(购自武汉淼灵生物公司)。
1.1.3培养基 LB培养基(1 L):蛋白胨10.0 g,酵母提取物5.0 g,NaCL10.0 g,PH=7.4(固体培养基加15.0 g琼脂);
0.85%琼脂的培养基(1 L):琼脂8.5 g;
1/2MS培养基(1 L):MS(Murashige & Skoog Basal Medium With Vitamins)2.22 g,蔗糖8.0 g,PH=5.8(固体培养基加7.0 g琼脂);
营养液(1 L)参考陈安乐[25]:25 mg FeSO4·7H20,33.5 mg EDTA-Na2,98.6 mg MgS04·7H20,69.7 mg K2SO4,117.6 mg CaCl2·2H2O,34.8 mg K2HPO4,0.711 mg H3BO3,0.445 mg MnCl2·4H2O,0.037 mg CuSO4·5H20,0.102 mg ZnCl2,0.012 mg Na2MoO4·2H20;
灭菌条件:121℃,30 min。
1.1.4实验引物 使用SnapGene软件和DNAMAN软件设计本实验所需的引物。MaROP6-1为MaROP6和pBI121-DsRed2的融合引物,上下游分别带有XbaI和BamH I酶(TaKaRa)切位点,用于克隆MaROP6全长片段。MaROP6-2为嵌合引物,上游取于表达载体pBI121-DsRed2,下游取于基因MaROP6,用于转基因毛状根的检测。MaROP6-3和Maβ-tubulin[1](内参基因)用于qR7-PCR检测。引物合成由北京擎科生物公司完成。
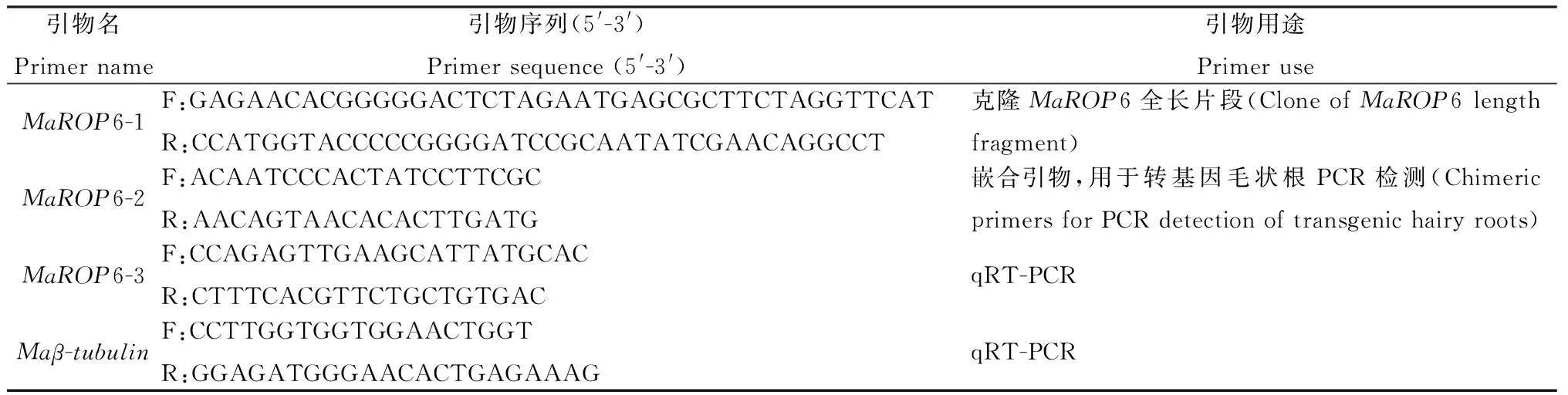
表1 PCR和qRT-PCR引物名称、序列和用途Table 1 PCR and qRT-PCR Primer name,sequence and use
1.2 试验方法
1.2.1RNA的提取与cDNA的合成 按照UNIQ-10柱式Trizol总RNA抽提试剂盒(生工生物公司)的说明书,提取白花草木樨野生型Ma389的根以及转MaROP6的毛状根总RNA,使用TIANScript II RT Kit反转录试剂盒(天根生化公司)进行cDNA的合成,分别用于MaROP6全长片段的克隆以及MaROP6表达量的测定。
1.2.2MaROP6全长片段的克隆与载体构建 根据本课题组前期完成的草木樨基因组数据(BioProject ID:PRJNA674670)获得MaROP6的CDS序列。使用融合引物MaROP6-1和Prime STAR HS高保真酶(TaKaRa)对MaROP6全长片段进行PCR扩增,使用限制性内切酶XbaI和BamHI对表达载体pBI121-DsRed2进行双酶切,将扩增产物和酶切产物用1.5%的琼脂糖凝胶电泳检测后,使用SanPrep柱式DNA胶回收试剂盒(生工生物公司)进行切胶回收。
用ClonExpress MultiS无缝克隆试剂盒(诺唯赞生物公司)将载体和MaROP6的回收产物连接在一起,使用大肠杆菌感受态细胞DH5α转化连接产物后,用50 mg L-1卡那霉素(Kan)的LB固体培养基涂板,37℃培养箱培养至过夜,挑选阳性单克隆后测序,测序正确后用SanPrep柱式质粒DNA小量抽提试剂盒(生工生物公司)进行质粒pBI121-DsRed2-MaROP6的提取。
1.2.3MaROP6基因序列的生物信息学分析 将MaROP6序列提交到Expasy(http://www.expasy.org/tools/),分析其氨基酸数目、分子量和等电点等理化性质。MaROP6基因的外显子-内含子结构在Gene structure display server(GSDS,http://gsds.cbi.pku.edu.cn/)上进行鉴定。利用DNAMAN软件对MaROP6基因的CDS和氨基酸序列进行比对。
1.2.4pBI121-DsRed2-MaROP6载体转化发根农杆菌K599 制备发根农杆菌K599感受态,使用电激转化法将构建的载体pBI121-DsRed2-MaROP6转入发根农杆菌K599感受态,在28℃摇床200 rpm复苏3 h后,使用50 mg·L-1Kan和50 mg·L-1链霉素(Stre)的LB固体培养基筛选阳性单克隆,使用50 mg·L-1Kan和50 mg·L-1Stre的LB液体培养基在28℃,200 rpm培养2 d后,OD=1.8左右,用50%的甘油保菌于—80℃备用,用于白花草木樨毛状根转化。
1.2.5切根侵染法诱导白花草木樨毛状根 农杆菌活化及培养。取保存于—80℃分别含有pBI121-DsRed2载体和pBI121-DsRed2-MaROP6载体的K599菌液200 uL,均匀涂板于含50 mg·L-1Kan,50 mg L-1Stre的LB固体培养基中,28℃倒置培养2 d(图1A)备用。
种子处理。将白花草木樨Ma389种子,用浓硫酸处理3 min后,使用灭菌水清洗五次,用75%的乙醇处理30 s,5%的次氯酸钠溶液处理5 min后,使用灭菌水清洗五次,在超净工作台中均匀的点在0.85%琼脂培养基上。每次实验可使用100粒种子。
种子萌发。将其置于4℃的冰箱春化2 d,再放置于25℃培养箱(16 h光照/8 h黑暗)培养3 d,待幼苗长出两片子叶,下胚轴为5 mm左右时,进行侵染(图1 B)。
外植体准备。在超净工作台中,准备两个无菌培养皿,其中一个中加入少量无菌水,镊子和手术刀用酒精灯消毒后,等恢复至正常温度时,用镊子轻轻夹取幼苗至空的培养皿中,用手术刀在根尖往上5 mm处快速切断,然后放于含有少量无菌水的培养皿中,防止萎蔫。
切根侵染。用镊子夹取已切根的幼苗,在灭菌滤纸上吸去多余的水分,轻轻划过菌膜,蘸取少量的农杆菌后,将其放置于不含抗生素的1/2 MS培养基上(图1 C),每个培养基中放12株,用封口膜封住培养基,并用锡箔纸外包进行暗处理,立放在22℃组培室(16 h光照/8 h黑暗)3 d。
幼苗除菌。在超净工作台,将幼苗从暗处理条件下拿出,将其放置于含有250 mg·L-1头孢噻肟钠(Caf)和250 mg·L-1羧苄青霉素(Car)的灭菌水中,在28℃摇床120 rpm除菌30 min,在超净工作台中,用灭菌水清洗三遍后,将其放在含有250 mg·L-1Caf和250 mg·L-1Car的1/2 MS培养基上,并采用滤纸-幼苗-滤纸的结构进行放置(图1 D),每个培养基放7株,用封口膜封住培养基,立放在22℃组培室(16 h光照/8 h黑暗)5 d。
幼苗液体培养。将幼苗从固体培养基中移入营养液中(图1 F),放置在22℃组培室(16 h光照/8 h黑暗),等待幼苗长出发根,在这期间,营养液每2~3 d补充一次,每5 d更换一次,以免因为农杆菌的繁殖而影响植物生长。

图1 草木樨毛状根转化Fig.1 Hairy roots transformation in Melilotus albus注:A:带有pBI121-DsRed2-MaROP6的发根农杆菌;B:5 d幼苗及幼苗切根位置;C:幼苗切根处蘸取农杆菌后放在1/2 MS培养基上;D:幼苗转移至含有250 mg·L-1Caf和250 mg·L-1Car的1/2 MS培养基;E:幼苗切根处膨大;F:幼苗转移至液体培养基;G:幼苗长出毛状根;H:幼苗长出侧根;I:毛状根在共聚焦激光扫描显微镜下出现红色荧光。红色箭头指示切面;蓝色箭头指示侧根;标尺为1 cm和100 μm(I)Note:A:Agrobacterium rhizogenes with pBI121-DsRed2-MaROP6;B:5-day seedling and seedling root cutting position;C:Dipping Agrobacterium at the root cutting part of the seedling and putting the seedling on a 1/2 MS culture medium;D:Transferring the seedlings to a 1/2 MS medium containing 250 mg·L-1 cephalosporin and 250 mg·L-1 carbenicillin;E:expanding at the cut root locus of the seedlings;F:Transferring seedlings to a liquid culture medium;G:Hairy roots grow from seedlings;H:Lateral roots grow from seedlings;I:Red fluorescence appeared in hairy roots under confocal scanning laser microscope. The sectioned surfaces are indicated by red arrows;the lateral roots are indicated by blue arrows. Scale bars=1 cm and 100 μm (I)
1.2.6毛状根的继代培养 选择生长迅速、粗壮的3~5 cm的新生毛状根,用无菌手术刀切取1~2 cm的根尖,转移至含有250 mg·L-1Caf和250 mg·L-1Car的1/2 MS培养基上,使根尖紧贴在培养基的表面,每个培养基放7条毛状根。将其置于25℃黑暗培养,每4~5 d将根系转移至新的继代培养基中,以自然生长的根作为对照,连续培养30 d。
1.2.7PCR检测MaROP6转基因毛状根的转化率 使用M5超光速Mix试剂盒(北京聚合美生物公司)和嵌合引物MaROP6-2进行PCR检测,用1.5%的琼脂糖凝胶电泳进行验证。草木樨毛状根转化率=(阳性毛状根数量/毛状根数量)×100%。
1.2.8qRT-PCR测定转基因毛状根中MaROP6的表达量 按照Hieff qPCR试剂盒(元升生物公司)的说明书,使用引物MaROP6-3和Maβ-tubulin进行qRT-PCR测定转基因毛状根中MaROP6的表达量。每组实验设置三个生物学重复,使用2-ΔΔCT[26]方法计算相对表达量。
2 结果与分析
2.1 MaROP6基因的克隆与载体构建
基因CDS序列为594 bp,编码198个氨基酸,蛋白质分子量为21.604 kDa,等电点为9.32。MaROP6基因结构显示,MaROP6是由七个外显子和六个内含子组成(图2)。
MaROP6属于小G蛋白ROP基因家族,它的蛋白包含Zheng等[27]提出的七个功能域(图3),GTPase域(I和III),GDP/GTP结合域(IV和VI)和效应域(II)都是高度保守的,但插入区(V)和C端区(VII)是可变的。

图2 MaROP6基因结构Fig.2 MaROP6 gene structure

图3 MaROP6的CDS和氨基酸序列Fig.3 CDS and amino acid sequence of MaROP6注:*为终止密码子,Ⅰ-Ⅶ为MaROP6蛋白的七个功能域Note:* represents the Stop Codon,Ⅰ-Ⅶ are the seven functional domains of MaROP6 protein
以白花草木樨cDNA为模板,用MaROP6-1融合引物进行PCR扩增,在500 bp到750 bp之间发现有清晰的条带出现,测序结果显示与白花草木樨基因组数据完全符合,同时将载体pBI121-DsRed2双酶切后备用(图4)。
因为MaROP6-1的引物两端带有载体的同源
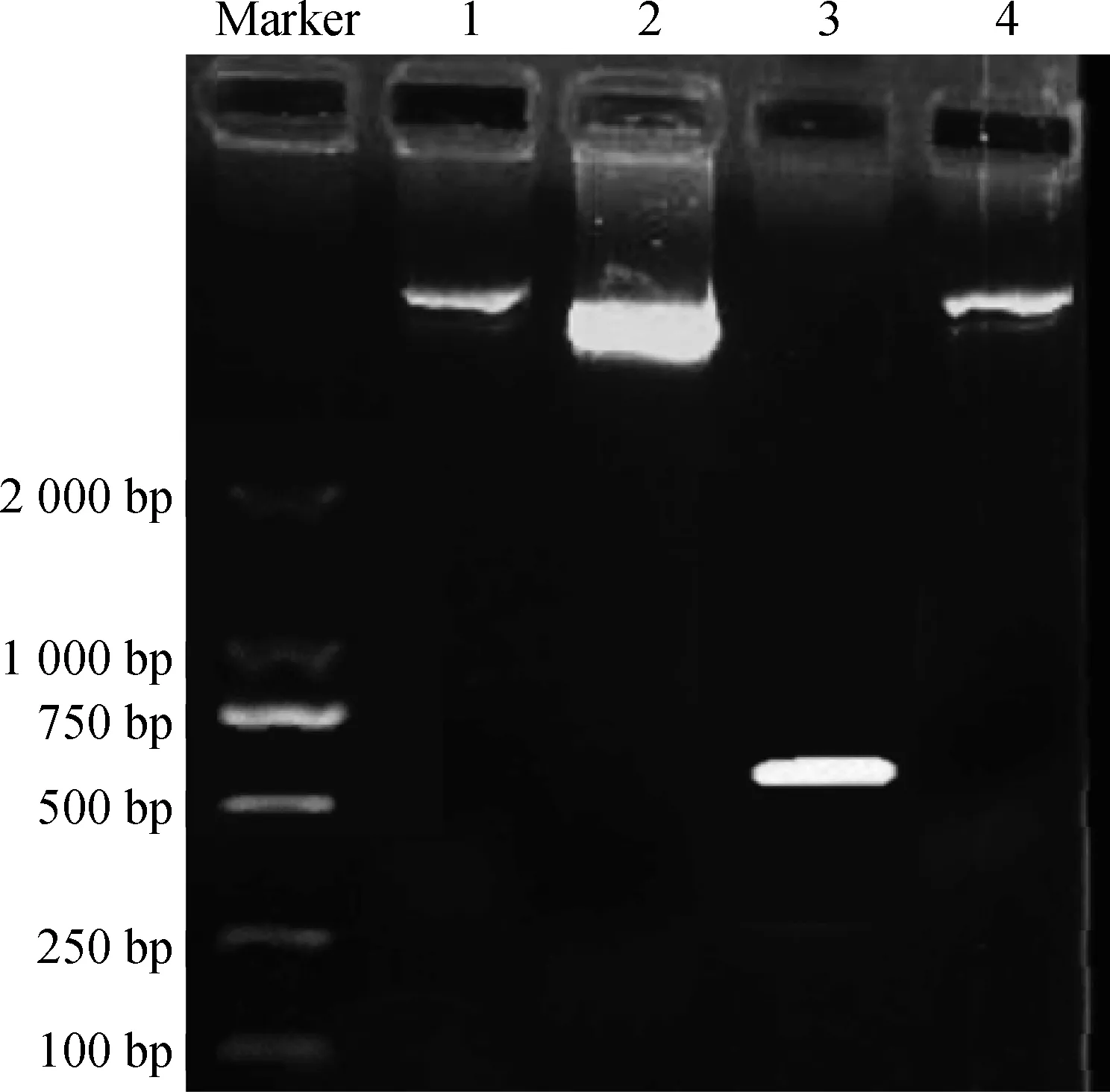
图4 pBI121-DsRed2和MaROP6全长片段及 pBI121-DsRed2-MaROP6Fig.4 pBI121-DsRed2 and full length of the MaROP6 and pBI121-DsRed2-MaROP6注:条带1为pBI121-DsRed2质粒,条带2为酶切后的pBI121-DsRed2质粒,条带3为克隆的MaROP6全长全段,条带4为pBI121-DsRed2-MaROP6质粒Note:Band 1 is pBI121-DsRed2 plasmid,band 2 is the vector after restriction digestion,band 3 is the full length of the cloned MaROP6,band 4 is pBI121-DsRed2-MaROP6 plasmid
片段,所以无缝连接酶可以将基因与载体上的同源片段融合,使二者连接在一起(图5)。
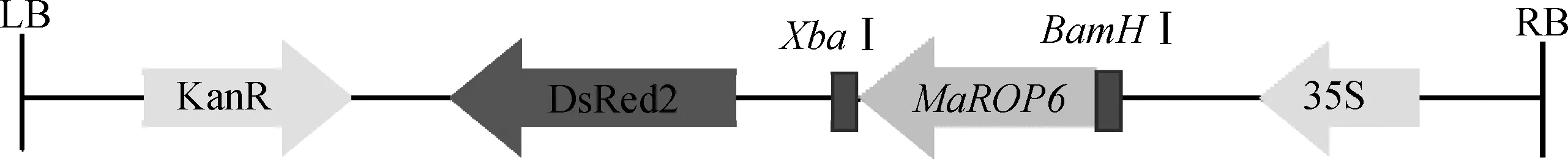
图5 pBI121-DsRed2-MaROP6表达载体构建示意图Fig.5 Schematic diagram of pBI121-DsRed2-MaROP6 expression vector construction
2.2 毛状根的获得与继代培养
幼苗暗处理后,可以清晰的看到幼苗的切根处开始膨大,并且在不含抗生素的1/2 MS固体培养基上,可以观察到幼苗切根处繁殖的发根农杆菌(图1C)。幼苗进行除菌,在含有250 mg·L-1Caf和250 mg·L-1Car的1/2 MS固体培养基上生长5天后,可以看到幼苗的切根处比之前更加膨大(图1E)。
将幼苗转移到液体培养基中继续生长,在营养液中培养4~5 d时,可以观察到部分幼苗出现了毛状根(图1F),7 d左右时,幼苗的毛状根则可以生长到4~5 cm,并且可以看到在幼苗的切口处有侧根的出现(图1 H)。并且在共聚焦激光扫描显微镜下,可以看到转基因毛状根中载体pBI121-DsRed2所特有的红色荧光(图1 I)。
将转化的毛状根的1~2 cm的根尖置于继代培养基中培养,每1~2 d观察一次毛状根的生长状况。自然生长的根在继代培养基中生长缓慢,5 d左右时根系逐渐变成褐色最终死亡(图6A),转化的毛状根在继代培养基中生长迅速,2 d左右时可观察到根尖伸长(图6B),7 d左右时可观察到根系有大量侧根长出(图6C),继代培养30 d后,根系大量繁殖,长满培养皿(图6D)。
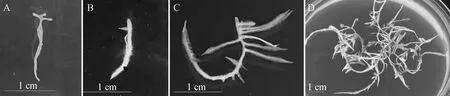
图6 毛状根在继代培养基上的培养Fig.6 Cultivation of hairy roots on subculture medium注:A:自然生长的根尖继代培养;B:毛状根的根尖继代培养;C:毛状根继代培养7 d时的生长状况;D:毛状根继代培养30 d时的生长状况。标尺为1 cmNote:A:Subculture of natural root tips;B:Subculture of hairy root tips;C:Growth of hairy roots in subculture for 7 days;D:Growth of hairy roots in subculture for 30 days. Scale bars=1 cm
2.3 毛状根的发生率
通过统计100株转化后白花草木樨幼苗长出毛状根的数量,来计算毛状根的发生率,实验重复三次,发现平均有78株白花草木樨的幼苗在切口处能长出毛状根,计算出白花草木樨毛状根的发生率为78.00±2.00%。随机挑选24株出现毛状根的白花草木樨幼苗,统计出1株上平均有4.04±1.55条毛状根。
2.4 毛状根的转化率
随机挑选24株长出毛状根的幼苗,从幼苗的切口处取毛状根,用PCR来鉴定毛状根的转化率,实验重复3次,如图7所示,24株白花草木樨毛状根中能检测出17株有条带,计算出白花草木樨毛状根的转化率为70.80±4.20%。
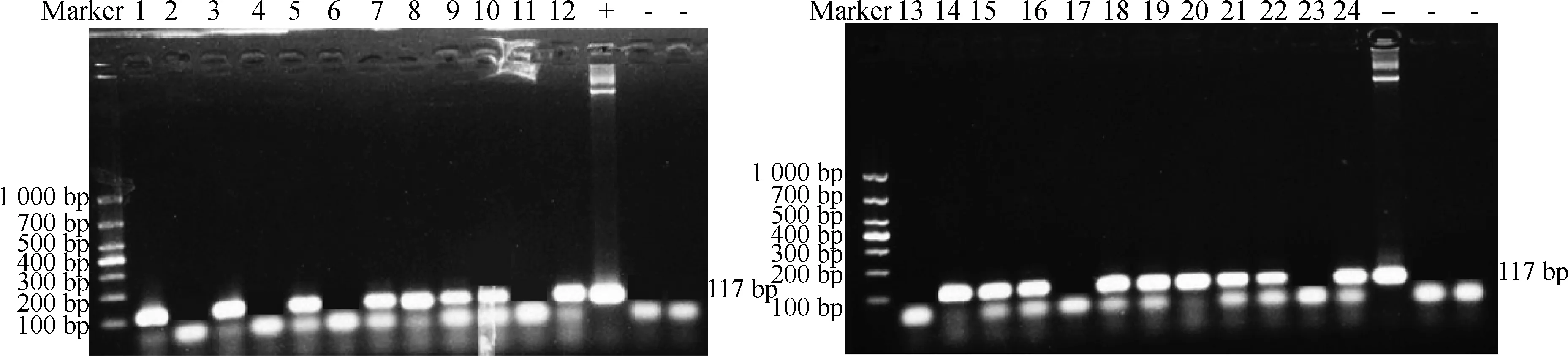
图7 转基因毛状根的检测Fig.7 Detection of transgenic hairy roots注:24株毛状根中转基因毛状根鉴定的PCR扩增结果,阳性对照为pBI121-DsRed2-MaROP6重组质粒,阴性对照为dd水和空载体转化株Note:PCR amplification results for identification of transgenic hairy roots among 24 hairy roots,The positive control is pBI121-DsRed2-MaROP6 recombinant plasmid,and the negative control is dd water and empty vector transformant
2.5 转基因毛状根中MaROP6的相对表达量
使用引物MaROP6-3和内参Maβ-tubulin,以空载体转化的草木樨为对照,进行qRT-PCR实验,来计算白花草木樨转基因毛状根中MaROP6的表达量。如图8所示,17株的阳性根中,MaROP6最低和最高相对表达量分别为对照的6.70倍和134.83倍,平均表达量为对照的36.87倍。
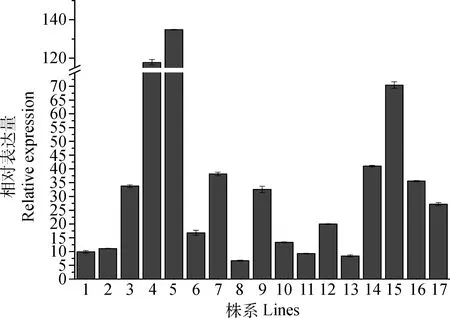
图8 转基因毛状根中MaROP6的表达水平Fig.8 The expression level of MaROP6 in transgenic hairy roots
3 讨论
3.1 发根农杆菌的应用及切根侵染法诱导毛状根的形成
自Smith和Townsend在1907年发现发根农杆菌能诱导植物形成毛状根以来[28],通过研究其侵染植物的原理及优化不同植物的转化方法,目前已经在160多种植物中成功利用发根农杆菌侵染获得了转基因毛状根[29]。陈安乐[25]使用K599菌株在大豆中建立了高效的毛状根转化体系,使得大豆幼苗在侵染一周后就产生了毛状根,通过该方法介导GmFRD3基因在大豆中过表达,使得转基因毛状根的耐铝性得到极大的提高;陈燕等[30]在百脉根中建立了毛状根转化体系,在百脉根子叶侵染后的10 d左右,即可获得转基因毛状根;王天佐等[31]在花苜蓿中建立了高效的毛状根转化体系,在一周左右即可获得转基因毛状根,毛状根的转化率可达到66.7%;刘佳[32]以苦参的不同部位作为外植体,和四种发根农杆菌作为转化菌株,最终建立了以子叶节为外植体的高效苦参毛状根转化体系,在四周后即可获得长势良好的毛状根。发根农杆菌诱导植物产生的转基因毛状根,因为具有生长速度快、分化程度高、遗传稳定性强和操作简便等特点[33],现已广泛应用在改良植物品种和植物基因工程等领域[34]。
切根侵染法是建立毛状根转化体系常用的方法之一,是在无菌环境下将原植物的根切除后,利用发根农杆菌介导在植物的切口处长出转基因毛状根,使用该方法产生的植物为嵌合植物,即地上部分是非转基因的,而根是转基因的[35]。使用切根侵染法获得转基因毛状根比使用根癌农杆菌获得转基因株系更加快速、简便,且切根侵染法作为分子生物学的研究手段,在无杂菌环境中培养的毛状根可以作为转基因的无菌苗进行后续实验研究,Si等[36]利用切根法将发根农杆菌转化蒺藜苜蓿,研究了MtDGD1在蒺藜苜蓿根瘤发育和共生固氮过程中的重要作用。
3.2 白花草木樨毛状根转化关键点分析
3.2.1侵染幼苗苗龄的选择 白花草木樨种子萌发所用的培养基为0.85%水琼脂培养基,能为种子萌发提供足够的湿度和营养物质,白花草木樨种子的萌发率高,从萌发到进行切根侵染大约需要5 d,幼苗过小进行侵染,则容易被农杆菌侵染致死,出现幼苗颜色变为褐色的现象;幼苗过大进行侵染,则会降低毛状根的发生率和转化率;以刚长出两片子叶苗龄大约为5 d的幼苗进行切根侵染效果最佳。
3.2.2暗处理时长 幼苗进行切根侵染后需要进行暗处理,暗处理时间少于3 d时,幼苗没有明显的切根处开始膨大的特征,处理时间多于5 d时,幼苗会出现幼苗的切根处变细、变软和变白的现象,这都会阻碍毛状根的形成,所以幼苗暗处理的时间为3~4 d最佳,培养基上有明显的农杆菌繁殖的现象,但不足以影响幼苗正常生长,且幼苗的切根处有明显膨大的特征。
3.2.3除菌条件的优化 幼苗暗处理后需要进行除菌处理,参考宗晓秋[37]大豆的除菌条件,设置单一抗生素Caf(250 mg·L-1或500 mg·L-1)或Car(250 mg·L-1或500 mg·L-1)时,培养基上出现农杆菌的单菌落,幼苗表面也有过度生长的农杆菌;设置250 mg·L-1Caf和250 mg·L-1Car时,培养基中没有出现农杆菌的单菌落,且毛状根生长旺盛;幼苗设置250 mg·L-1Caf和500 mg·L-1Car或500 mg·L-1Caf和250 mg·L-1Car时,培养基中虽然没有农杆菌的单菌落,但幼苗生长缓慢,毛状根生长减缓,颜色逐渐变为褐色。所以,幼苗除菌时选择250 mg·L-1Caf和250 mg·L-1Car的灭菌水,在28℃摇床120 rpm除菌30 min,最后放置于含250 mg·L-1Caf和250 mg·L-1Car 1/2 MS培养基上的效果最佳。幼苗采用滤纸-幼苗-滤纸的结构放置在除菌培养基上,可以使幼苗更加充分的接触培养基,且竖直放置时不会使幼苗跌落而影响生长。
综合来看,采用切根侵染法诱导白花草木樨毛状根的产生,可以在两周左右获得转基因毛状根,这比用根癌农杆菌介导的遗传转化体系得到转基因植株要更加快速和简便。
3.3 白花草木樨毛状根转化效率分析
对转MaROP6基因毛状根的发生率和转化率进行统计,实验设置三个重复,计算出毛状根的发生率和转化率分别为78.00±2.00%和70.80±4.20%。相对于豆科植物中百脉根52.60±6.30%和紫花苜蓿52.20±6.40%的转化率[36],白花草木樨的转化率明显更高,与毛苕子75.00±4.80%[35]和花苜蓿66.70%[31]的转化率相比相差不大,表明白花草木樨是易于转化的豆科植物。qRT-PCR结果表明转基因毛状根中MaROP6的平均表达量为对照的36.87倍,而花苜蓿转基因根中MrbZIP66的平均表达量为对照的34.13倍[31],低于白花草木樨。这就表明本实验建立的毛状根转化体系是一种高效的转化体系,可以用于白花草木樨基因功能的验证。
白花草木樨毛状根的发生率和转化率都在70%以上,且超表达MaROP6的相对平均表达量为对照的36.87倍。这就表明利用发根农杆菌介导的白花草木樨毛状根转化可以作为一种快速简便的白花草木樨生物技术手段。
3.4 白花草木樨毛状根诱导再生植株前景分析
目前草木樨尚未建立稳定的遗传转化体系,如何将草木樨的毛状根诱导出愈伤组织进而再生成完整转化植株需要进一步的探索。参考玉米[38]和北玄参[39]的毛状根体系诱导愈伤组织和再生植株的成功条件,首先需要优化毛状根的诱导和培养方法,增加毛状根的生物量,其次参考玉米、北玄参和其他豆科植物由毛状根诱导愈伤组织和再生植株的培养基配方,对于6-BA和NAA等的用量需要进一步探索,最后要进一步验证草木樨合适的品种作为转基因植物的前体材料。通过毛状根诱导建立稳定的草木樨遗传转化体系,为草木樨基因功能的深入研究提供强有力的手段,是目前迫切需要解决的问题。
4 结论
本研究以白花草木樨为材料,以结瘤基因MaROP6为例,采用切根侵染法建立了一种高效的白花草木樨毛状根转化体系,并成功获得了转MaROP6基因的毛状根,毛状根的发生率和转化率分别可以达到78.00±2.00%和70.80±4.20%,且转基因毛状根中MaROP6的相对平均表达量可以达到对照的36.87倍,表明毛状根转化体系已经成功应用到白花草木樨结瘤基因的功能研究中。白花草木樨毛状根转化体系的建立为白花草木樨结瘤基因功能的研究提供了强有力的手段,并可能将其应用到抗逆基因功能的研究等其他领域,为草木樨基因功能的验证和遗传选育奠定基础。
