JNK信号通路在右美托咪定预处理减轻大鼠离体心肌缺血再灌注损伤中的作用*
2021-12-09殷存芝陈玉姣杨在群陈亚华
殷存芝,陈 慧,陈玉姣,杨在群,陈亚华
(遵义医科大学附属医院麻醉科,贵州遵义 563003)
恢复心肌的血供是挽救缺血性心脏病的关键治疗措施,但由此产生的心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)却严重影响了患者的治疗及预后。细胞凋亡是MIRI的特征之一,抗凋亡成为近年防治MIRI的重要措施[1]。右美托咪定是新型高选择性的α2肾上腺素受体激动剂,有研究表明其预处理可减轻大鼠MIRI,其机制与抑制细胞凋亡有关[2]。C-Jun氨基末端激酶(C-Jun N-terminal kinase,JNK)是丝裂原活化蛋白家族进化上高度保守的一员。研究表明JNK信号通路的激活可促进细胞凋亡[3]。本研究探讨右美托咪定预处理减轻离体大鼠MIRI的作用是否与抑制JNK信号通路的过度激活从而减轻细胞凋亡有关。
1 材料与方法
1.1 材料
1.1.1主要试剂
右美托咪定购自江苏恒瑞医药有限公司;JNK抑制剂SP600125、JNK小鼠抗大鼠单克隆抗体、p-JNK小鼠抗大鼠单克隆抗体、GAPDH小鼠抗大鼠单克隆抗体、葡萄糖调节蛋白78(GRP78)小鼠抗大鼠单克隆抗体、Goat荧光二抗购自美国Selleck公司;TTC购自北京百奥思科生物技术有限公司;原位细胞凋亡试剂盒购自美国Sigma公司。
1.1.2动物
SPF级健康雄性SD大鼠60只,8~10周,260~280 g,由重庆腾鑫生物技术有公司提供,动物许可证编号:SCXK(湘)2014-0011。
1.2 方法
1.2.1模型制备及分组
腹腔注射1%的戊巴比妥钠50 mg/kg麻醉大鼠后充分暴露心脏,迅速剪下并放置于95% O2及5% CO2预充并冷冻的4 ℃ K-H液中,轻轻挤压心脏排除瘀血。迅速悬挂并固定于Langendorff装置上,进行K-H液灌注,同时置入乳胶水囊至左心室,使左室舒张末期压力维持在4~7 mm Hg,移动保温杯使心脏处于恒温系统中。每只心脏平衡15 min后,对照组(N组)持续灌注190 min;缺血再灌注损伤(I/R)组持续灌注30 min后,停止灌注40 min,复灌120 min;右美托咪定预处理(D)组灌注含有右美托咪定(10 nmol/L)的K-H液30 min,JNK抑制剂SP600125(SP)组灌注含有SP600125(10 μmol/L)的K-H液30 min,右美托咪定与SP600125混合处理(D+SP)组灌注含右美托咪定(10 nmol/L)和SP600125(10 μmol/L)的K-H液30 min,之后处理均同I/R组。
1.2.2大鼠心功能检测
各组分别于平衡末(T1)、缺血前(T2)、再灌注末(T3)3个时点记录心率(heart rate,HR)、左心室发展压(left ventricular developed pressure,LVDP)、左心室舒张末压(left ventricular end-diastolic pressure,LVEDP)、左室内压最大上升/下降速率(maximum rate of increase of left ventricular pressure,±dp/dtmax)。
1.2.3TTC检测心肌梗死面积
再灌注末取下心脏后置于-80 ℃冰箱冰冻数分钟后取出,将心脏沿心尖至心底以横切面切成厚薄一致的5块环形切片,放置于盛有1%TTC染液的无菌器皿内,避光、恒温孵育后置于10%的甲醛内固定24 h。将心脏进行拍照,并在Image Pro软件下计算梗死面积。
1.2.4TUNEL检测心肌细胞凋亡率(AI)
再灌注末切取左心室心肌体积约1 mm3的组织块,制成冰冻切片,按照试剂盒说明书操作,将切片置于荧光显微镜下观察并拍照。每个标本观察5张切片,每张切片选取5个视野于高倍显微镜下观察,AI=(绿色荧光染色细胞核数/总的细胞核数)×100%。
1.2.5电镜观察心肌超微结构
留取再灌注末左心室心肌体积约1 mm3的标本,放置于4%戊二醛内固定,0.1 mol/L二甲胂酸钠缓冲液漂洗,1%锇酸固定,乙醇脱水,环氧树脂进行包埋、聚合,制作超薄切片并染色,透射电镜下观察、拍照。
1.2.6Western blot检测心肌组织GRP78、p-JNK、JNK蛋白表达
取左心室心肌组织,BCA法测定蛋白浓度,制备SDS-PAGE凝胶,样品进行电泳分离,转膜,封闭,分别加入GRP78、JNK、p-JNK的一抗稀释液,4 ℃孵育过夜,加入山羊抗兔荧光二抗,使用化学发光成像系统分析,以目标蛋白条带荧光强度值与内参蛋白条带荧光强度值的比值反映蛋白表达水平。
1.3 统计学处理
2 结 果
2.1 各组大鼠心功能的变化
在T3时点,与N组比较,其余组HR、LVDP、±dp/dtmax下降,LVEDP增加(P<0.05);与I/R组比较,D组、SP组、D+SP组HR、LVDP、±dp/dtmax增加,LVEDP下降(P<0.05);D组、SP组、D+SP组在各项心功能指标上无明显差异(P>0.05),见表1。
2.2 各组大鼠心肌梗死面积比较
与N组比较,其余组再灌注末心肌梗死面积均增加(P<0.05);与I/R组比较,D组、SP组、D+SP组心肌梗死面积均降低(P<0.05);D组、SP组、D+SP组变化不明显(P>0.05),见表2、图1。
2.3 各组大鼠心肌细胞AI比较
与N组比较,其余组心肌细胞AI增加(P<0.05);与 I/R组比较,D组、SP组、D+SP组心肌细胞AI降低(P<0.05);与D组比较, SP组AI增加(P<0.05);与SP组比较,D+SP组心肌细胞AI降低(P<0.05),见表2、图2。
2.4 各组大鼠超微结构改变
N组心肌细胞超微结构基本完整,结构清楚,未见明显凋亡小体;I/R组心肌细胞出现明显损伤,细胞破碎严重,明显可见凋亡小体,肌原纤维丝排列紊乱并局部出现断裂;D组、SP组、D+SP组:心肌细胞形态基本完整,少量细胞核破坏,线粒体聚集呈轻微肿胀,部分线粒体脊消失,局部发现空泡,偶见凋亡小体,见图3。
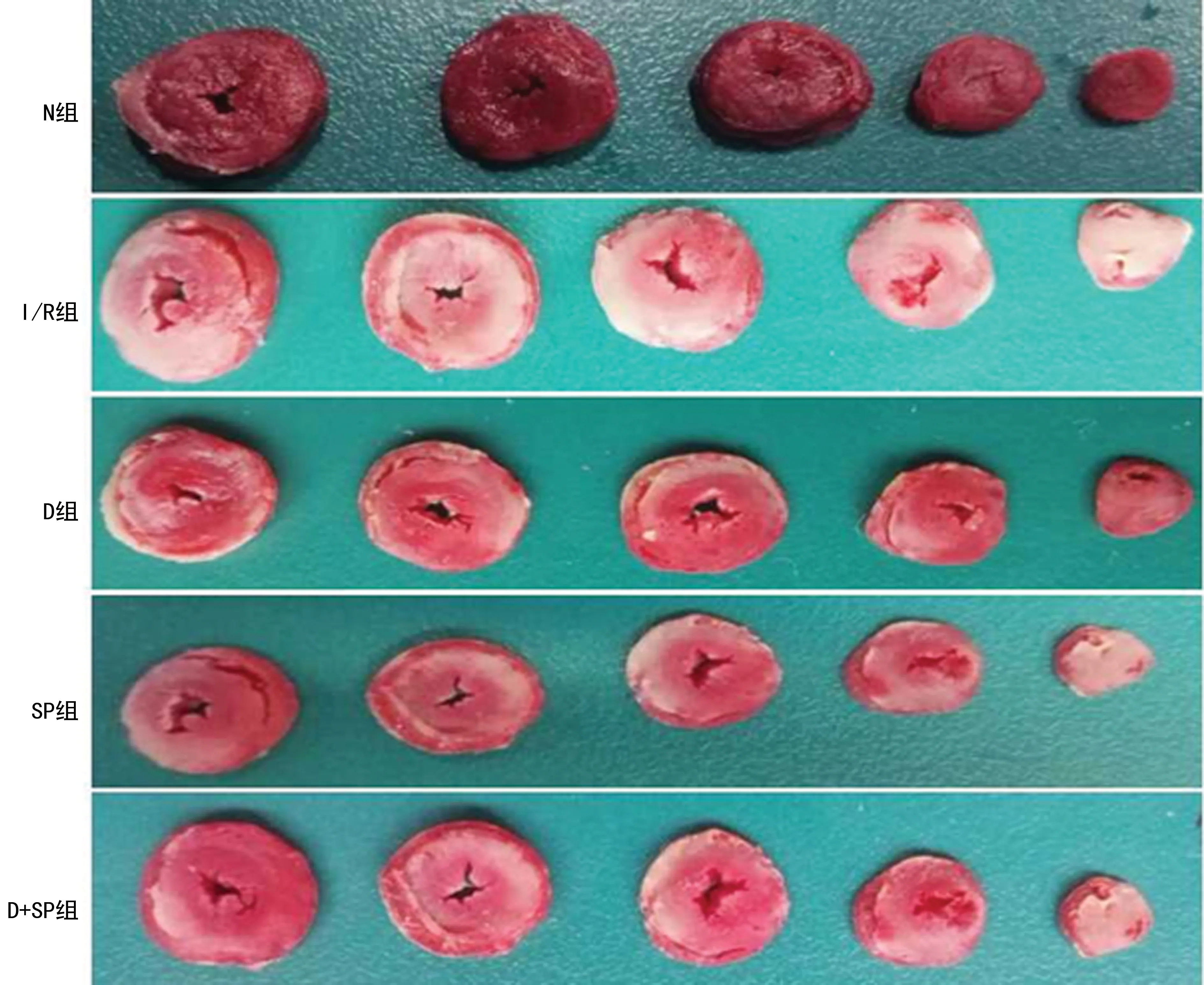
白色:梗死区域;红色:正常区域。
表1 各组大鼠不同时点心功能指标比较
续表1 各组大鼠不同时点心功能指标比较
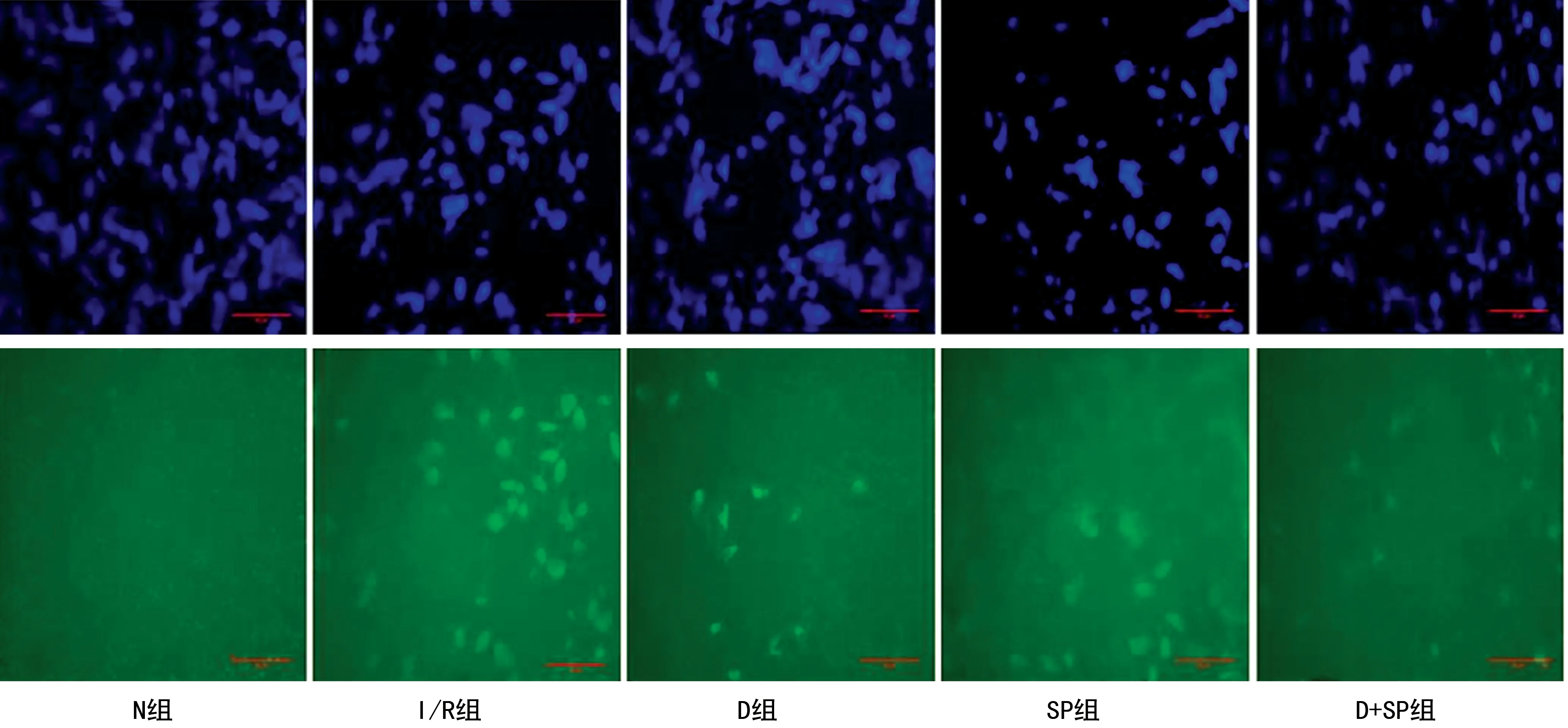
蓝色:正常细胞核;绿色荧光:凋亡细胞核。
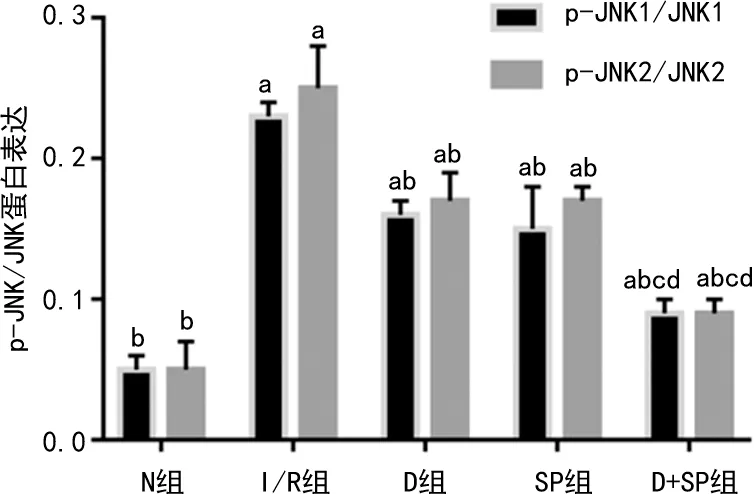
2.5 各组大鼠GRP78、p-JNK1/JNK1、p-JNK2/JNK2蛋白表达比较
与N组比较,其余组GRP78、p-JNK1/JNK1、p-JNK2/JNK2蛋白表达增加(P<0.05)。与I/R组比较,其余组GRP78、p-JNK1/JNK1、p-JNK2/JNK2蛋白表达降低(P<0.05)。与D组比较,SP组GRP78、p-JNK1/JNK1、p-JNK2/JNK2蛋白表达无明显差异(P>0.05),D+SP组GRP78、p-JNK1/JNK1、p-JNK2/JNK2蛋白表达降低(P<0.05)。与SP组比较,D+SP组GRP78、p-JNK1/JNK1、p-JNK2/JNK2蛋白表达降低(P<0.05),见图4~6。
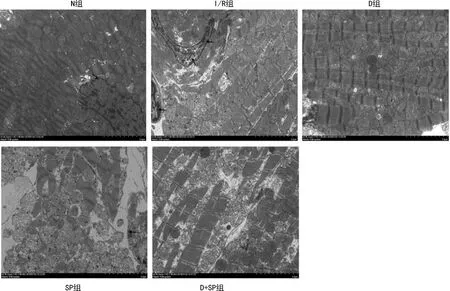
黑色:细胞核出现核固缩现象;红褐色:线粒体肿胀扩张脊消失,局部线粒体聚集;蓝色:肌源纤维丝断裂,排列紊乱;紫色:自噬体;标尺:5 μm。
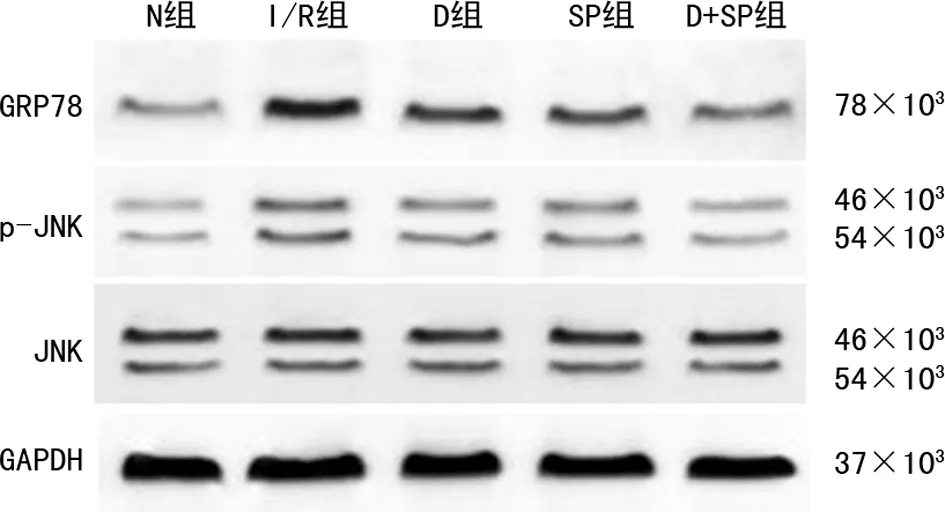
图4 各组大鼠GRP78、JNK、p-JNK蛋白印迹图

a:P<0.05,与N组比较;b:P<0.05,与I/R组比较;c:P<0.05,与D组比较;d:P<0.05,与SP组比较。
表2 各组大鼠心肌梗死面积与AI的比较
续表2 各组大鼠心肌梗死面积与AI的比较
a:P<0.05,与N组比较;b:P<0.05,与I/R组比较;c:P<0.05,与D组比较;d:P<0.05,与SP组比较。
3 讨 论
右美托咪定是一种高选择性α2肾上腺素受体激动剂,由于α2受体广泛分布于心血管、中枢和外周系统及血小板,因此具有广泛的生物学效应。右美托咪定不仅是一种良好的镇静剂,而且对于接受手术的高危心血管患者具有巨大的潜在保护效力[4]。大量研究表明右美托咪定对多种脏器均有良好的保护效应[5-6]。REN等[7]报道,右美托咪定可以减少缺血心肌无复流面积,改善心功能,减轻MIRI。胡杰等[8]研究表明,右美托咪定可以保护体外循环下冠脉旁路移植术患者的心肺功能。ZHANG等[9]报道,右美托咪定可以通过上调SIRT1/mTOR轴,减少心肌细胞凋亡、氧化应激及炎性反应、过度的心肌细胞自噬,减轻MIRI。本实验结果显示:与N组比较,I/R组大鼠心功能明显降低,心肌梗死面积与AI明显增加,心肌超微结构破坏严重,表明MIRI模型复制成功。而给予右美托咪定预处理后,大鼠心功能指标明显改善,心肌梗死面积与AI明显降低,电镜所示的超微结构也显示心肌结构破坏大大减轻,这些均可表明右美托咪定的确具有明显的抗MIRI作用。
MIRI是治疗多种心血管疾病过程中遭受的共同病理生理过程。在众多的诱发因素中,细胞凋亡是其中的原因和特征之一。抑制凋亡对于防止MIRI意义重大。CHANG等[10]报道,右美托咪定预处理可以通过激活PI3K/AKT信号通路发挥抗凋亡作用,从而减轻MIRI。YUAN等[11]研究发现,右美托咪定可通过调控FKBP12.6/RyR2信号通路减轻H9C2心肌细胞缺氧复氧诱导的细胞内钙超载与细胞凋亡。除了经典的线粒体途径与死亡受体介导的凋亡途径之外,内质网及介导的内质网应激(endoplasmic reticulum stress,ERS)途径成为近年凋亡研究的热点。MIRI时引起的缺血缺氧及钙超载等会使内质网稳态失衡、功能紊乱,从而形成ERS。适度的ERS可通过处理异常蛋白等恢复内环境稳态,但持久或过度的ERS会通过活化相关因子及途径诱发细胞凋亡[12],给机体带来不利影响。GRP78是ERS的分子伴侣蛋白,当细胞受到外界刺激(缺氧、应激等)发生ERS时,细胞内会产生大量未折叠蛋白与错误折叠蛋白,GRP78也会相应大量增加并与错误折叠蛋白结合,维持内环境稳定。 因此,GRP78表达的急速增加被认为是ERS最敏感的标志物[13]。本实验结果显示:与N组相比,I/R组GRP78蛋白表达明显增加;与I/R组比较,D组GRP78蛋白表达明显降低。说明缺血再灌注诱发心肌组织出现严重的 ERS,而使用右美托咪定预处理后,ERS反应明显减轻。
作为MAPK家族三大成员之一,JNK受细胞因子和各种应激的暴露而激活,被激活的JNK转移至细胞核内,使底物C-Jun磷酸化,大量活化的C-Jun可诱导细胞凋亡反应[14]。JNK可通过导致凋亡的多条途径诱导细胞发生凋亡, 其中主要是通过IRE1-TRAF2-ASK1-JNK通路参与到ERS介入的I/R的细胞凋亡过程,是缺血再灌注损伤与ERS之间重要的交叉通路。有研究报道,布托啡诺预处理可以明显降低I/R组心肌组织JNK磷酸化水平,抑制JNK/NF-kB信号活化、心肌细胞凋亡,从而减轻MIRI[15]。本研究结果显示,心肌缺血再灌注后JNK的活化形式p-JNK明显升高,提示JNK通路参与了缺血再灌注对心肌的损伤。与I/R组相比,SP组的大鼠JNK蛋白表达、心肌梗死面积及AI明显降低,说明通过抑制JNK通路可以明显减少大鼠MIRI及细胞凋亡。而右美托咪定预处理对MIRI的保护作用中存在JNK水平的变化,结合右美托咪定预处理可以降低ERS标志物GRP78的表达,推测右美托咪定可通过某种作用下调JNK蛋白表达并抑制其活化,抑制过度的ERS,从而对JNK调控的细胞凋亡产生抑制作用。
综上所述,右美托咪定预处理可以有效减轻大鼠离体心脏MIRI,且这种保护作用可能是通过抑制JNK信号通路的激活,从而减轻过度ERS及其介导的凋亡。
