FOXM1促进子宫内膜癌细胞系HEC-1B增殖、迁移和侵袭
2021-12-09程苾恒解美婷刘珊汕
黄 博,程苾恒,解美婷,刘珊汕,魏 敏
(湖北省人民医院 妇产科,湖北 武汉 430000)
子宫内膜癌(endometrial carcinoma)是常见的妇科恶性肿瘤,目前手术仍是其主要的治疗方法[1]。Forkhead家族转录因子叉头框蛋白M1(forkhead box protein M1,FOXM1)作为调控细胞周期的癌基因,对肿瘤的病理改变起促进作用,并对肿瘤的生长、侵袭与转移具有调控作用[2]。有研究发现,FOXM1是一种细胞增殖特异性转录因子,与非恶性前列腺上皮细胞相比,其在前列腺癌细胞中高表达,提示FOXM1异常过表达有助于前列腺癌的发生发展[3]。另有研究发现,宫颈癌细胞中抑制FOXM1的表达可以抑制肿瘤细胞的增殖、迁移、侵袭和药物敏感性[4]。然而,FOXM1对子宫内膜癌的影响目前研究甚少,本研究探讨抑制FOXM1的表达对子宫内膜癌细胞系HEC-1B增殖、迁移和侵袭的影响,为子宫内膜癌的临床治疗提供新靶点的实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞系:选择人子宫内膜癌细胞系HEC-1B和人正常子宫内膜上皮细胞系hEECs,购自中国科学院上海细胞生物学研究所细胞库。
1.1.2 实验试剂:LipofectamineTM2000(上海碧云天生物技术有限公司);siRNA-NC和siRNA-FOXM1(上海吉玛制药技术有限公司);Trizol(赛默飞世尔科技(中国)有限公司);CCK8试剂盒(苏州瑞诺德生物科技有限公司);FOXM1、血管内皮生长因子(vascular endothelial growth factor,VEGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、GAPDH上下游引物(生工生物工程(上海)股份有限公司);FOXM1兔多克隆抗体(Abcam公司);VEGF、bFGF兔多克隆抗体、山羊抗兔二抗(LI-COR公司)。
1.2 方法
1.2.1 细胞分组及转染:子宫内膜癌细胞系HEC-1B,培养于37 ℃、5% CO2、相对湿度90%、含有10%胎牛血清的RPMI-1640培养基中。取对数生长期细胞,采用LipofectamineTM2000进行转染。根据转染质粒的不同,将细胞分为3组:空白对照组(不转染,细胞正常生长)、阴性对照组[转染100 nmol/L siRNA-negative control(NC)]、siRNA-FOXM1组(转染100 nmol/L siRNA-FOXM1),分别于转染48 h后收集细胞。
1.2.2 实时荧光定量PCR:Trizol法提取各组细胞总RNA,并测定RNA的浓度和纯度,根据反转录试剂盒说明书进行操作,将RNA反转录为cDNA,取1 μL cDNA采用SYBR Green RT-qPCR试剂盒进行基因检测。FOXM1上游引物为:5′-TGCCCAGCAG TCTCTTACCT-3′,下游引物为:5′-CTACCCACCTTC TGGCAGTC-3′;VEGF上游引物为:5′-AGGGCAGAA TCATCACGAAGT-3′,下游引物为:5′-AGGGTCTC GATTGGATGGCA-3′;bFGF上游引物为:5′-TATTT CTTTGGCTGTACTTG-3′,下游引物为:5′-TCCAGC ATTTCGGTGTTG-3′;GAPDH上游引物为:5′-GAAG GTGAAGGTCGGAGTC-3′,下游引物为:5′-AAGAT GATGGATTTC-3′。反应体系:95 ℃ 5 min,95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,共40个循环。按公式(2-△△Ct法)计算各组细胞FOXM1、VEGF和bFGF mRNA相对表达量。
1.2.3 CCK8法检测实验:收集转染48 h的细胞,接种于96孔板(每孔2×103个细胞)。然后分别于0、24、48、72 h培养细胞,加入10 μL CCK-8试剂。再孵育2 h后,用酶标仪测量每个孔在450 nm吸收波长下的吸光度值(A)。
1.2.4 细胞划痕实验:在6孔板背面用记号笔均匀划线,每隔0.5~1.0 cm划一道,每道线均横穿过孔。在孔中加入约1×105个细胞,加入培养液过夜孵育。用枪头垂直于6孔板划线,PBS洗涤细胞3次,去除划下的细胞,加入无血清培养基置于37 ℃培养箱培养,24 h观察拍照,观察细胞的迁移情况,实验重复3次。
1.2.5 Transwell小室法检测细胞侵袭实验:取300 μL无血清培养基加入30 μL基质凝胶,混匀后铺于Transwell小室的上室内,调节各组细胞浓度为1×106个/mL,各取200 μL加入上室内,下层小室内加入600 μL培养液,常规培养24 h;取出Transwell用PBS洗涤3遍,用0.4%多聚甲醛固定30 min,结晶紫染色10 min,PBS洗涤3次,显微镜下观察并计数穿膜细胞数,实验重复3次。
1.2.6 Western blot检测实验:BCA法检测各组细胞蛋白浓度。取30 μg蛋白进行SDS-PAGE,湿转至PVDF膜后用5%脱脂牛奶封闭,2 h后TBST缓冲液漂洗;分别与VEGF、bFGF、β-actin蛋白特异性一抗(1∶1 000)4 ℃孵育过夜后,TBST缓冲液漂洗,加入二抗(1∶2 000),室温孵育后ECL化学发光剂显色。Image J分析软件计算各组细胞目的蛋白的相对表达量。
1.3 统计学方法

2 结果
2.1 各组细胞FOXM1 mRNA及蛋白表达水平
与人正常子宫内膜上皮hEECs细胞相比,人子宫内膜癌HEC-1B细胞FOXM1 mRNA和蛋白表达显著升高(P<0.05)(图1)。siRNA-FOXM1组FOXM1 mRNA和蛋白表达与空白对照组和阴性对照组相比显著降低(P<0.05)(图2)。
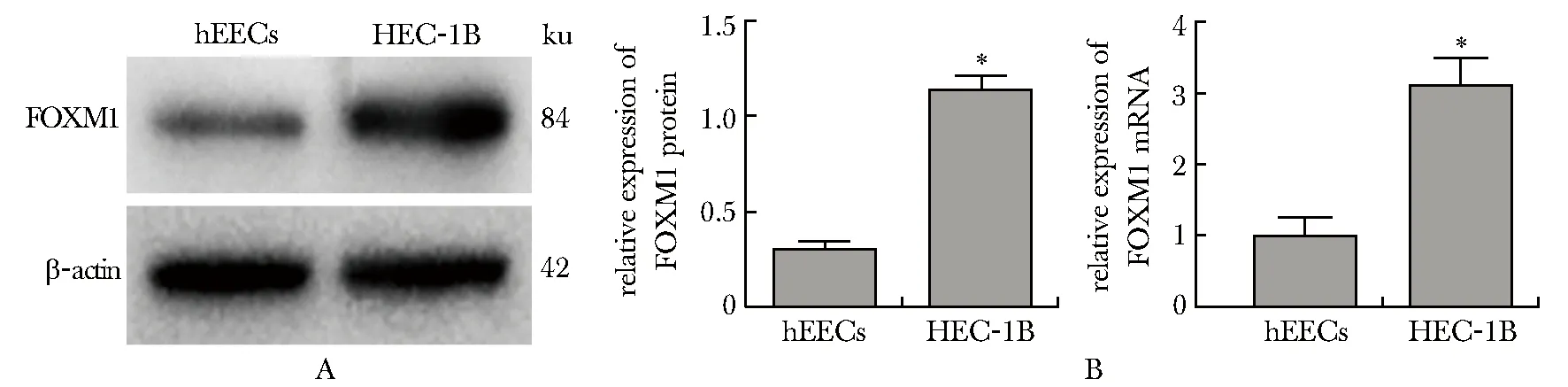
A.expression of FOXM1 protein was analyzed by Western blot;B.expression of FOXM1 mRNA was analyzed by RT-qPCR;*P<0.05 compared with hEECs cells图1 hEECs和HEC-1B细胞FOXM1 mRNA及蛋白表达水平Fig 1 Expression of FOXM1 mRNA and protein in hEECs and HEC-1B n=3)
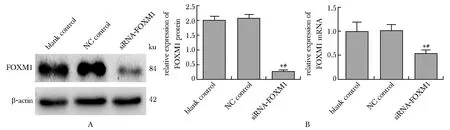
A.expression of FOXM1 protein was analyzed by Western blot;B.expression of FOXM1 mRNA was analyzed by RT-qPCR;*P<0.05 compared with blank control;#P<0.05 compared with NC control图2 转染后HEC-1B各组细胞FOXM1 mRNA及蛋白表达水平Fig 2 Expression of FOXM1 mRNA and protein in each group of HEC-1B cells after n=3)
2.2 转染后各组细胞的增殖能力
24、48和72 h siRNA-FOXM1组HEC-1B细胞增殖较空白对照组和阴性对照组显著降低(P<0.05)(表1)。
表1 转染后HEC-1B各组细胞的增殖能力Table 1 Proliferation ability of cells in each group of HEC-1B cells after transfection(A, n=3)
2.3 转染后各组细胞的迁移能力
siRNA-FOXM1组HEC-1B细胞划痕宽度与空白对照组和阴性对照组相比显著变宽,划痕宽度比显著增加(P<0.05),而空白对照组和阴性对照组相比差异无统计学意义(图3)。
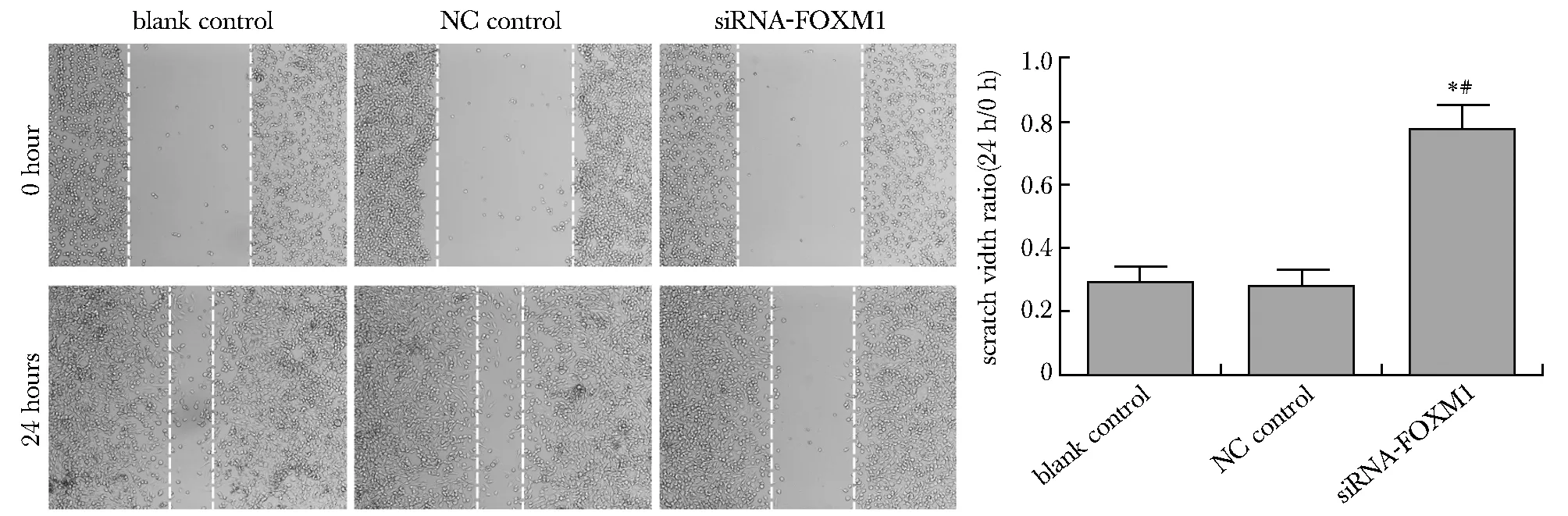
*P<0.05 compared with blank control group;#P<0.05 compared with NC control group图3 转染后HEC-1B各组细胞的迁移能力Fig 3 Migration ability of cells in each group of HEC-1B cells after transfection(×200, n=3)
2.4 转染后各组细胞的侵袭能力
与空白对照组和阴性对照组相比,siRNA-FOXM1组HEC-1B细胞穿过Transwell小室的细胞数显著减少,侵袭能力减弱(P<0.05),而空白对照组和阴性对照组相比差异无统计学意义(图4)。
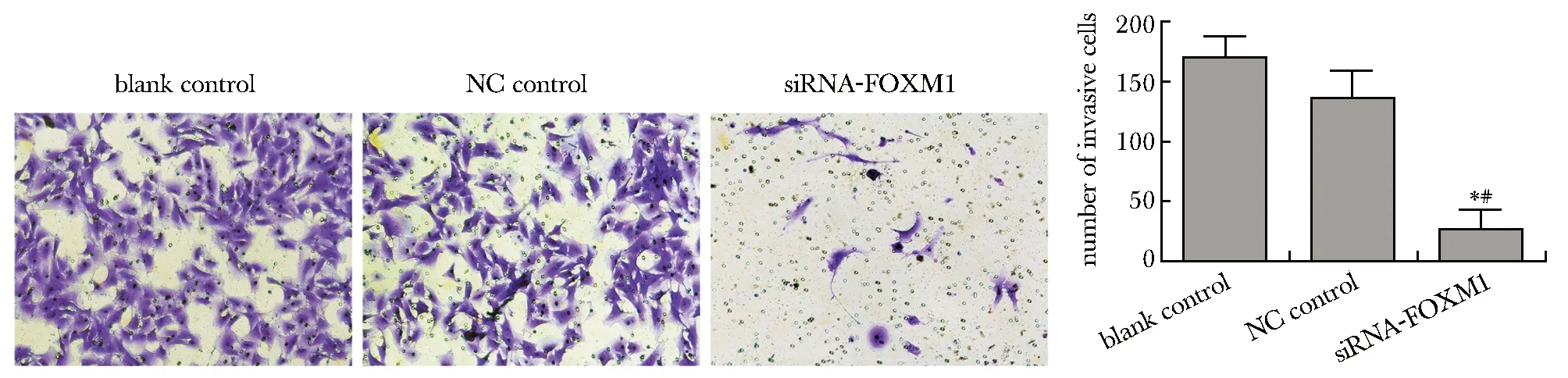
*P<0.05 compared with blank control group;#P<0.05 compared with NC control group图4 转染后HEC-1B各组细胞的侵袭能力Fig 4 Invasion ability of cells in each group of HEC-1B cells after transfection(×200, n=3)
2.5 转染后各组细胞VEGF、bFGF mRNA及蛋白表达
与空白对照组和阴性对照组相比,siRNA-FOXM1组HEC-1B细胞VEGF、bFGF mRNA及蛋白表达均显著降低(P<0.05),而空白对照组和阴性对照组相比,HEC-1B细胞VEGF、bFGF mRNA及蛋白表达无差异(图5)。

A.expression of VEGF and bFGF protein was analyzed by Western blot;B.expression of VEGF and bFGF mRNA was analyzed by RT-qPCR;*P<0.05 compared with blank control;#P<0.05 compared with NC control图5 转染后HEC-1B各组细胞VEGF、bFGF mRNA及蛋白表达Fig 5 mRNA and protein expression of VEGF and bFGF of cell in each group of HEC-1B cells after transfection
3 讨论
FOXM1是一种原癌基因,在各类癌中高表达。由于它可在不同类型的癌细胞中调节肿瘤生长、血管生成和转移等,在肿瘤发生中发挥不同的作用[5-6]。RNA干扰技术是一种基于靶基因同源双链RNA对生物体内基因序列的特异性沉默能力的一种基因技术,是临床肿瘤靶向治疗研究热点之一[7]。有研究表明,FOXM1的表达与结肠癌的侵袭、转移有关,siRNA干扰FOXM1可有效抑制结肠癌细胞的增殖、迁移和侵袭[8]。有研究[9]发现,抑制FOXM1基因的表达可明显降低鼻咽癌细胞增殖水平,诱导细胞凋亡,并提高细胞对紫杉醇的敏感性。本研究结果发现,干扰FOXM1表达后,HEC-1B细胞增殖、迁移和侵袭能力均减弱,提示降低FOXM1的表达可抑制子宫内膜癌细胞增殖、迁移和侵袭水平。
肿瘤的发生、发展及转移依赖于新生血管和淋巴管的生成,VEGF是与肿瘤相关的重要的血管因子,而bFGF是细胞生长分化的重要调节因子,VEGF和bFGF 具有协同促进肿瘤生长和转移的作用[10]。有研究[11]发现,宫颈癌组织中VEGFA、VEGFB和VEGFC高表达,且与FOXM1的表达呈正相关,表明VEGFA、VEGFB和VEGFC可能是FOXM1下游的靶基因。另有研究发现,抑制FOXM1可通过下调VEGF、MMP-9和MMP-2抑制乳腺癌细胞的侵袭性、迁移和血管生成能力[12]。本研究结果发现,siRNA-FOXM1组VEGF、bFGF mRNA及蛋白表达均显著降低,提示FOXM1可通过调控VEGF、bFGF的表达发挥作用。
综上所述,抑制HEC-1B细胞中 FOXM1的表达可以抑制细胞的增殖、迁移及侵袭能力,其机制可能是通过抑制VEGF、bFGF的表达发挥作用,为治疗子宫内膜癌的研究提供新思路。然而FOXM1是否进一步影响VEGF下游相关信号通路有待深入研究。
