异补骨脂素的药理作用和肝肾损伤机制研究进展Δ
2021-12-09申宝德杭凌宇马亚中袁海龙
杨 阔,高 茸,申宝德,杭凌宇,2,马亚中#,袁海龙
(1.空军特色医学中心药剂科,北京 100142; 2.江西中医药大学药学院,江西 南昌 330004)
中药补骨脂为豆科植物补骨脂PsoraleacorylifoliaL.的干燥成熟果实。异补骨脂素是从补骨脂中提取得到的香豆素成分,也存在于北沙参、羌活和防风等植物中[1-3]。异补骨脂素是补骨脂吸收入血的主要活性成分,也是补骨脂发挥药效的主要物质基础和毒性成分,具有抗骨质疏松、抗炎、抗肿瘤和神经保护等药理作用,但是长期、大剂量使用异补骨脂素会诱导机体肝肾损伤,极大地限制了异补骨脂素的药物研发和补骨脂的临床扩大应用[4]。本文对2010年至今关于异补骨脂素的药理毒理作用研究进行总结综述,为异补骨脂素深入研究和中药补骨脂的合理应用提供参考。
1 异补骨脂素的药理作用及机制
目前用于治疗骨质疏松症的补骨脂复方制剂,如仙灵骨葆胶囊、四神丸、乳没接骨丸等,均以异补骨脂素作为复方制剂中补骨脂质量评定的指标成分。在现代药理研究中,异补骨脂素表现出较强的抗骨质疏松活性。此外,异补骨脂素还具有抗氧化、抗肿瘤、神经保护和抗皮肤光老化等药理作用。
1.1 抗骨质疏松
骨质疏松症是以骨量降低、骨显微结构被破坏为特征的全身性骨骼疾病,主要表现为体内成骨细胞和破骨细胞动态平衡被破坏,形成骨吸收大于骨形成的局面[5]。药理研究结果显示,异补骨脂素对于治疗雌激素降低、维生素A缺乏、氧化应激反应和糖尿病引发的骨质疏松症均有较好的应用潜力,其作用原理与靶向转化生长因子β1(transforming growth factor β1,TGF-β1)/Smad、骨形态发生蛋白2(bone morphogenetic protein 2,BMP-2)/Smad、Wnt/β-连环蛋白(β-catenin)和过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor-γ,PPAR-γ)/Wnt通路来促进成骨分化、抑制成脂分化密切相关。
绝经后骨质疏松症的主要病理改变为雌激素的耗竭引起骨胶原丢失,进一步诱导骨质疏松症的发生。异补骨脂素是治疗绝经后骨质疏松症的潜在靶点。刘锐等[6]的实验研究结果发现,异补骨脂素能增加去卵巢大鼠血清中骨钙素(osteocalcin,OCN)、抗酒石酸酸性磷酸酶的含量,增加骨密度,改善骨微结构。有研究通过去卵巢骨质疏松模型和体外细胞实验,进一步完善了相关作用机制,发现异补骨脂素可剂量依赖性下调PPAR-γ的mRNA表达,上调核心结合蛋白因子2(runt-related transcription factor-2,RUNX2)的mRNA表达,来抑制骨髓腔中脂肪细胞的成熟分化,给药浓度为20 μmol/L的效果最好[7-8]。此外,异补骨脂素还可以通过靶向PPAR-γ/Wnt途径来抑制绝经后骨质疏松症大鼠的氧化应激反应,降低骨质疏松症大鼠的丙二醛(malondialdehyde,MDA)含量,提高超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性,上调碱性磷酸酶(alkaline phosphatase,ALP)、骨桥蛋白和OCN的mRNA表达[9-10]。
体外实验结果证实,异补骨脂素(1 μmol/L)可通过上调成骨细胞OB-6中OCN和RUNX2的mRNA表达,促进细胞内钙积累;抑制活性氧,保护氧化应激下OB-6细胞的线粒体功能;通过Wnt/β-catenin信号通路,减轻H2O2诱导的成骨细胞损伤[11];作用于BMP-2/Smad信号通路,促进成骨细胞MC3T3-E1增殖[12];通过激活BMP-2或丝裂原激活蛋白激酶信号通路,剂量依赖性刺激ATDC5细胞内软骨结节堆积,时间依赖性增强Ⅱ型胶原、OCN、Smad4和Sox9等成骨标志基因的mRNA表达[13];通过芳香烃受体(aryl hydrocarbon recepter,AhR)/雌激素受体α(estrogen receptor α,ERα)轴来促进成骨细胞MC3T3-E1分化,提高钙结节水平和ALP活性,上调成骨细胞标志物RUNX2和Ⅰ型胶原α1链的mRNA表达[14]。此外,异补骨脂素(10~8 mol/ml)还可通过刺激骨髓间充质干细胞分泌的外泌体中的circ-8604靶向miR-26b-3p/ERα来调控成骨细胞MC3T3-E1的增殖和分化,进而调控骨代谢[15]。
体内实验结果证实,异补骨脂素可通过TGF-β1/Smad通路上调同源盒基因D3(homeobox D3,HOXD3)的mRNA表达,抑制先天性枕颈部骨骼的畸形发育[12];上调胚胎HOXD3基因的mRNA表达,减缓维生素A缺乏诱导的胎鼠脊椎异常发育的程度[16];下调叉头框蛋白O3a信号通路,并激活Wnt信号通路,发挥抗骨质疏松作用[17];通过Wnt/β-catenin信号通路,改善1型糖尿病骨质疏松模型大鼠骨小梁数量和骨密度[18];通过调节PPAR-γ/Wnt途径,抑制骨质疏松大鼠的氧化应激,显著降低骨质疏松大鼠的MDA活性,提高SOD、GSH和GSH-Px活性[9]。
1.2 抗肿瘤
目前,关于异补骨脂素抗肿瘤的实验研究多停留在细胞水平上。体外实验结果证实,异补骨脂素对于人急性髓系白血病、人神经母细胞瘤、肾癌、肝癌和肺癌等肿瘤细胞均有较好的抑制作用,其作用原理与肿瘤细胞增殖、凋亡和转移等环节密切相关。
文献报道,异补骨脂素可体外抑制人急性髓系白血病HL-60细胞的B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)的mRNA表达,上调Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)表达,抑制细胞增殖[19];通过胱天蛋白酶(Caspase)介导的内源性途径,剂量依赖性地下调抗凋亡蛋白Bcl-2、B淋巴细胞瘤-XL和髓样白血病细胞序列1的表达,上调Caspase-9和Caspase-3的表达,诱导人SH-SY5Y神经母细胞瘤细胞凋亡[20];通过上调Caspase3的表达,下调细胞型Fas相关死亡区域蛋白样白介素1β转换酶抑制蛋白的表达,增强肿瘤坏死因子相关凋亡诱导配体诱导的肾癌Caki细胞凋亡[21];通过下调抗凋亡蛋白凋亡调节因子Bcl-2,激活磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路,通过线粒体途径诱导Huh-7肝癌细胞凋亡[22];阻滞细胞周期于G2/M期,通过调节c-Jun氨基末端激酶和细胞外信号调节激酶信号通路,抑制人肺癌A549细胞的生长和迁移[23]。
1.3 抗氧化
氧化损伤可通过诱导晶状体活性氧自由基的积聚来进一步诱发白内障的形成。文献报道,异补骨脂素可以保护H2O2诱导的胰腺β细胞凋亡,保护人晶状体上皮细胞中线粒体超微结构的完整性,剂量依赖性上调晶状体上皮细胞内ERα、ERβ的表达,下调核因子κB表达,达到抗氧化损伤的效果[24-26]。
1.4 其他
此外,学者还发现异补骨脂素具有神经保护、抗皮肤光老化、抗白癜风和保护肝损伤的药理作用。李孝明[27]通过脊髓损伤小鼠模型探究发现,异补骨脂素可改善模型组小鼠的四肢运动能力和平衡能力;上调ERα表达,促进运动神经元细胞恢复;上调PI3K和Akt磷酸化水平,上调Bcl-2的mRNA表达,下调Bax的表达,抑制神经细胞继发性坏死。杨柳等[28]研究了异补骨脂素对人皮肤角质形成细胞(HaCaT细胞)模型的影响,发现异补骨脂素可抑制细胞外信号调节激酶磷酸化,抑制白细胞介素1α、肿瘤坏死因子α等炎症因子的分泌;上调GSH抗氧化酶活性,降低乳酸脱氢酶活性和MDA含量,发挥对HaCaT细胞的保护作用。庞建云等[29]的研究结果发现,异补骨脂素可促进小鼠黑色素瘤B16F10细胞增殖,提高酪氨酸酶活性,促进黑色素形成。周俪姗等[30]通过LO2细胞非酒精性脂肪肝模型实验发现,异补骨脂素可通过抑制核因子κB活性来抑制炎症因子分泌,并下调TGF-β1的蛋白表达,改善细胞的脂肪变性。
2 异补骨脂素的肝毒性及作用机制
近年来,学者通过以大鼠、小鼠和斑马鱼等不同种属动物为实验模型,给予异补骨脂素溶液后进行体内外行为观察,发现异补骨脂素引起的机体肝毒性与给药剂量和给药时间存在一定的相关性,且毒性损伤的性别差异和种属差异较为明显。异补骨脂素产生的肝损伤早期是可逆的,停止给药一段时间后,肝损伤症状消失[4]。异补骨脂素肝毒性作用机制复杂,目前已初步证实其肝毒性与造成机体胆汁淤积、氧化应激反应和抑制氧化酶活性相关。
2.1 胆汁淤积
胆汁酸是由胆固醇在肝细胞中合成的一系列胆甾烷类内源性物质,高浓度的胆汁酸可引起细胞凋亡,进一步引发肝损伤。目前,学者通过大小鼠和体外细胞实验探究发现,异补骨脂素能够造成胆汁合成、排泄和转化过程紊乱,引起胆汁淤积,进而导致肝损伤。
黄菊阳等[31]灌胃给予大鼠异补骨脂素溶液(60 mg/kg)建立急性肝损伤模型的实验发现,给药1 d后,大鼠血清中丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)和甘油三酯(triglyceride,TG)等水平显著升高;给药3 d后,大鼠血清中ALT、AST和总胆汁酸水平持续升高,提示肝损伤进一步加重;给药7 d后,肝损伤持续存在,但没有加重趋势,提示异补骨脂素引起的大鼠肝毒性具有时间相关性。聚合酶链反应(polymerase chain reaction,PCR)结果显示,给药1、3和7 d内,异补骨脂素均可抑制胆汁酸转运相关蛋白胆盐输出泵(bile salt export pump,BSEP)、钠牛磺胆酸共转运多肽的mRNA表达,降低多药耐药蛋白2(multidrug resistance protein 2,MRP2)、多药耐药基因1、有机溶质转运体α、ATP结合盒转运体G8和ATP结合盒转运体G5的mRNA水平,抑制肝细胞中胆汁酸的外排,造成胆汁淤积。周昆等[32]研究了异补骨脂素对HepG2细胞毒性和胞内胆汁酸浓度的影响,噻唑蓝法检测结果显示,随着异补骨脂素浓度的增加,细胞存活率剂量依赖性降低,给药剂量为25 μmol/L时,细胞内胆汁酸转运蛋白MRP2、多药耐药蛋白3(multidrug resistance protein 3,MRP3)的mRNA水平显著降低;当剂量增至100 μmol/L时,细胞内MRP2、MRP3的mRNA水平持续降低,胆汁酸较对照组升高了5倍,提示异补骨脂素导致肝毒性具有剂量相关性。
另有研究结果证实,腹腔注射异补骨脂素可引起小鼠肝细胞肿胀变性、肝局灶性坏死,作用原理涉及抑制BSEP、钠牛磺胆酸共转运多肽的mRNA表达,抑制胆汁酸排出;上调低密度脂蛋白受体的表达,增强低密度脂蛋白运输胆固醇进入肝细胞合成胆汁酸的能力[33-34]。Wang等[35]研究了异补骨脂素对大鼠肝毒性的影响,通过血清生化和组织病理学检查发现,异补骨脂素可引起大鼠胆汁淤积性肝损伤,作用机制涉及下调BSEP、MRP2和MRP3的mRNA表达,抑制胆汁酸排泄;抑制体内解毒胆汁酸的主要代谢酶磺基转移酶2A1的表达,抑制胆汁酸转化,引起细胞内胆汁酸淤积。
2.2 氧化应激
当活性氧的形成超过了细胞抗氧化能力时,易诱发机体氧化应激状态,形成系列脂质过氧化物,引起细胞毒性损伤。肝型脂肪酸结合蛋白是肝细胞中的长链和支链脂肪酸转运载体,在氧化应激反应中作为内源性抗氧化剂负责脂肪酸的转运。谷胱甘肽S-转移酶和SOD是体内重要的抗氧化酶和氧自由基清除剂,对维持体内活性氧水平和细胞抗氧化能力平衡起着重要作用[36]。Zhang等[37]探究了不同剂量异补骨脂素(25、50和100 μmol/L)对斑马鱼肝脏的影响,结果发现异补骨脂素导致斑马鱼畸形发育,血清ALT、AST水平呈剂量依赖性升高,肝脏荧光强度减弱;病理组织学检查结果显示,异补骨脂素高剂量组仔鱼肝脏出现大量空泡结构;PCR结果显示,与抗氧化能力有关的基因肝型脂肪酸结合蛋白、谷胱甘肽S-转移酶P2和SOD1的mRNA水平显著降低,表明异补骨脂素可显著降低抗氧化酶活性,降低斑马鱼幼鱼肝脏抗氧化能力,引起肝脏氧化损伤。
2.3 抑制肝药酶活性
细胞色素P450酶(cytochrome P450,CYP450)主要存在于肝微粒中,是药物在肝脏中进行氧化、水解和还原等代谢反应的主要酶系,其活性直接影响药物的体内代谢速率及进程[38]。异补骨脂素在肝脏中主要经CYP450酶进行代谢,毒理研究结果表明,异补骨脂素可体内外抑制CYP450酶活性,降低CYP450酶对其代谢能力,引起肝脏中异补骨脂素药物蓄积。此外,异补骨脂素在大鼠和人肝微粒体中的CYP450酶促动力学存在种属差异,由动物结果外推至人时应注意该差异带来的影响[39]。
Song等[40]通过从肝组织中提取RNA,利用cDNA芯片和生物信息学分析发现,异补骨脂素组与对照组之间存在884个差异表达基因,其中CYP1A1、CYP1A2、谷胱甘肽硫转移酶M1和醛-酮还原酶家族7成员A3是肝毒性的关键基因,外源性CYP450酶代谢是差异表达基因揭示的最显著的富集途径,提示异补骨脂素主要通过外源性CYP450酶代谢引起肝毒性。
Liu等[41]探究了异补骨脂素对HepaRG细胞和HuH-7细胞中CYP450酶主要亚型表达的影响,发现异补骨脂素可浓度依赖性抑制CYP3A4的活性。Wang等[42]灌胃给予雄性小鼠40 mg/kg异补骨脂素28 d后,小鼠体重降低,血清ALT、AST和ALP水平升高,表明小鼠已发生实质性肝损伤;与对照组相比,异补骨脂素组小鼠肝组织中CYP2E1的活性和蛋白表达均显著降低,提示异补骨脂素导致小鼠肝损伤与影响代谢酶表达有关。
钟玉环等[43]将人肝微粒或鼠肝微粒与异补骨脂素共同孵育后,加入CYP特异性探针底物共孵育1 h,采用高效液相色谱-串联质谱法检测相应代谢产物的生成量,以评价CYP1A的活性。结果发现,异补骨脂素对大鼠和人肝微粒体的CYP1A2活性均表现出较强的抑制作用,半数抑制浓度均<0.5 μmol/L,且对人肝微粒体中CYP1A2的抑制作用高于大鼠。此外,异补骨脂素对CYP2D6和CYP2C19的活性也有一定的抑制作用。
2.4 引起机体代谢功能紊乱
代谢组学技术是从整体角度出发,观察药物引发机体毒性反应后的整体变化,利用高通量分析检测技术系统地筛选得到氨基酸、磷脂等代谢差异物,这些数据既可作为毒性反应过程中的生物标志物,也可体现肝毒性发生过程中生物学途径的改变[44]。目前,代谢组学技术的应用在异补骨脂素的肝毒性机制探究中已取得一定的成果,氨基酸代谢、脂肪酸代谢和能量代谢途径紊乱已被证实存在于异补骨脂素引起的肝损伤中。
张玥等[45]发现,异补骨脂素可引起大鼠体内氨基酸代谢紊乱。在连续7 d灌胃给予大鼠异补骨脂素(60 mg/kg)后,异补骨脂素组大鼠血清AST、TG和尿素氮水平显著升高,肝细胞出现空泡性变性。采用核磁共振氢谱代谢组学技术检测大鼠血清中内源性代谢物变化情况,结合主成分分析和偏最小二乘法判别分析筛选得到丙酮、异丙醇等14个代谢差异物发生显著改变,主要涉及D-谷氨酰胺和谷氨酸代谢,缬氨酸、亮氨酸和异亮氨酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢,以及甘氨酸、丝氨酸和苏氨酸代谢4条代谢通路。Yu等[4]利用代谢组学等技术探究得出异补骨脂素可引起雌性大鼠体内谷氨酸代谢紊乱,采集停止给药4周的恢复期大鼠血清进行生化分析发现,ALT、总胆红素、TG和肌酐等指标水平与对照组比较,差异无统计学意义(P>0.05),提示异补骨脂素致大鼠肝损伤具有可逆性。Zhang等[46]发现,异补骨脂素肝毒性存在性别差异,相同剂量给药组雌雄大鼠体重变化、血清生化和组织病理学变化趋势存在差异,其中雌性大鼠肝损伤更为明显;利用气质联用代谢组学等方法分析发现,雌性、雄性大鼠血浆中分别有19、28种代谢物发生显著变化,其中,脂肪酸代谢是雌性大鼠的主要影响途径,能量代谢是雄性大鼠的主要影响途径。
基于代谢组学技术的异补骨脂素肝毒性作用机制见表1。
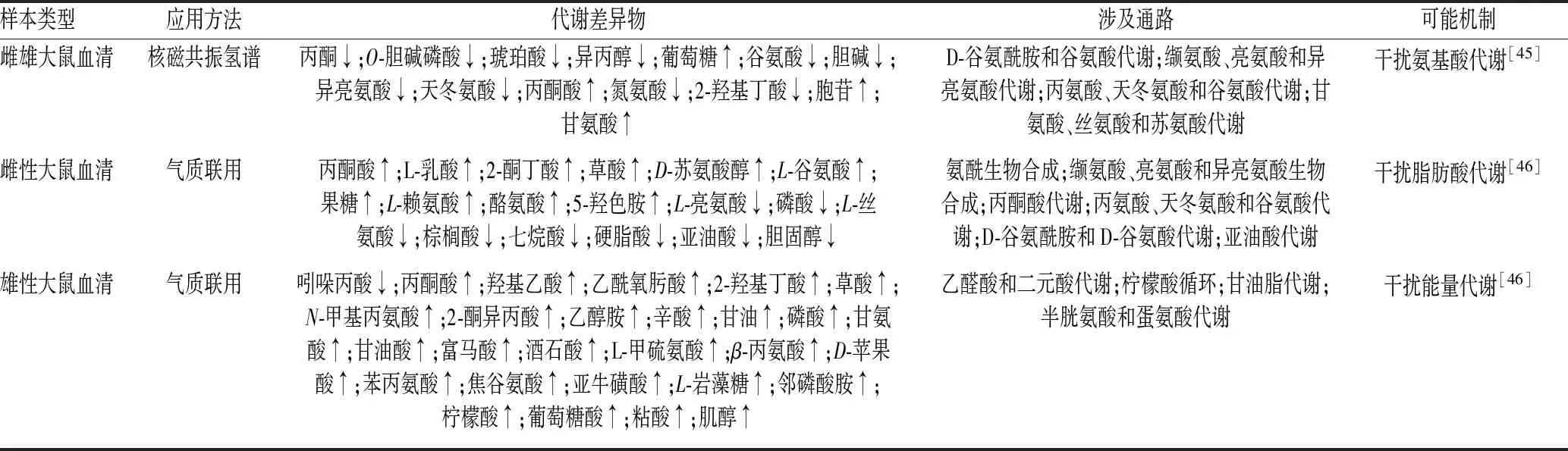
表1 基于代谢组学技术的异补骨脂素肝毒性作用机制Tab 1 Hepatotoxicity mechanism of isopsoralen based on metabonomics technique
3 异补骨脂素的肾毒性
肾脏是机体主要的排泄器官,由于其自身血流量丰富,药物吸收入血进入体循环后可迅速到达肾脏,相比于其他脏器,肾脏更易受到药物损伤。其次,由于肾小球的重吸收功能,使肾脏暴露于高浓度的药物环境中,增加药物性肾损伤风险[47]。大鼠研究结果显示,肾脏是异补骨脂素在体内的主要排泄器官,静脉注射给药后,56.25%的异补骨脂素以原型药形式从尿液排出[48]。有研究灌胃给予异补骨脂素后发现,大鼠体重降低,肾脏系数增加,血清中尿素氮含量显著升高,病理切片观察到肾脏远曲小管皮质发生空泡变性,表明异补骨脂素可引起大鼠肾毒性[4,45]。
溶质载体家族22 A有机阳离子/肉碱转运体(organic cation/carnitine transporters,OCT/OCTN)(请补充英文全称)和有机阴离子转运体(organic anion transporter,OAT)可直接影响组织中有机离子或药物的分布和排泄,进而影响肾脏中药物的蓄积状态,进一步引发不良反应。Wang等[42]通过逆转录聚合酶链反应和蛋白质印迹法检测分析得出,异补骨脂素能够下调小鼠肾脏中mOCT1、mOCTN1和mOAT3的mRNA表达,上调mOAT1的mRNA表达,降低mOCTN2的蛋白水平,表明异补骨脂素的肾毒性可能与其引起肾脏有机离子转运系统功能紊乱相关。
4 总结与展望
异补骨脂素是中药补骨脂的主要药效成分和主要毒性成分,现代研究结果已证实异补骨脂素和中药补骨脂具有抗骨质疏松、抗肿瘤和消炎等药理作用。此外,补骨脂入脾、肾经,除具有补肾助阳的药用功效外,还具有温脾止泻、纳气平喘的治疗效果。由中药自身功效出发来探究其主要成分的药效作用,对于挖掘成分的潜在药理活性具有重要意义。目前关于异补骨脂素药理作用的研究还不深入,其是否具有治疗脾胃虚弱、消化不良及呼吸道疾病等作用尚待挖掘发现。
异补骨脂素在肝脏疾病的治疗方面是一把“双刃剑”,其既可抑制炎症和氧化应激反应来保护肝损伤,又可引起肝脏组织病变诱发肝损伤。目前关于异补骨脂素肝毒性的研究暂不深入,异补骨脂素“量-毒-效”关联机制尚不明确,如何正确定位异补骨脂素在肝脏中的作用还需结合大量的研究证明来进行阐述。除异补骨脂素外,补骨脂中的主要药效成分补骨脂素也具有肝毒性。虽然,目前已有学者通过毒理实验得出异补骨脂素的急性毒性强于补骨脂素[49-50];但是,二者肝损伤毒性强弱暂不清晰,明确二者肝损伤毒性强弱对于补骨脂炮制减毒措施的评价具有重要意义。
肾脏是异补骨脂素体内的主要排泄器官,且异补骨脂素在肾组织中的暴露量仅次于肝脏,远高于其他组织[51]。本文总结发现,现关于异补骨脂素不良反应的探究多集中在肝脏,有关其肾毒性的研究较为单一,肾损伤机制暂不明确。药物毒性程度与毒性成分的体内吸收、分布以及各器官中的贮藏量密切相关,异补骨脂素引发的肾损伤也应引起重视。建议加强异补骨脂素肝肾毒性相关基础研究,进一步明确其毒性损伤机制,为后续减毒增效措施奠定基础。
