乌黄骨外散的质量标准提高研究Δ
2021-12-09孙毅东张美容詹亚坤曾祥仲陈宝婷张素方林爱华
孙毅东,张美容,詹亚坤,张 慧,曾祥仲,陈宝婷,张素方,林爱华
(1.广东省中医院珠海医院药剂科,广东 珠海 519015; 2.中山大学附属第五医院药学部,广东 珠海 519000)
乌黄骨外散(批准文号:粤药制字Z20080297)由川乌、草乌、大黄和白芷等8味药材组合而成,具有活血化淤、舒筋活络和消肿止痛的功效,是由广东省中医院珠海医院国家中医药管理局重点专科骨伤科经验方研发而成的含毒性中药外用制剂,在治疗风湿、类风湿关节炎、骨伤和软组织挫伤等方面具有较好的疗效。中药外用制剂给药简便、生物利用度高,是有毒中药的重要应用形式,但目前对于有毒中药的外用剂量尚无统一标准[1-3]。乌黄骨外散中川乌、草乌的主要有效成分和毒性成分为双酯型二萜生物碱乌头碱、次乌头碱,毒性强,治疗窗窄[4-7]。因此,制定该制剂中有毒成分的定量分析标准对保证临床使用安全尤为重要。本研究在优化大黄、白芷的薄层色谱鉴别方法的基础上,建立乌头碱、次乌头碱的高效液相色谱含量测定方法,为建立含川乌、草乌的外用制剂质量标准提供参考,现报告如下。
1 材料
1.1 仪器
BSA124S型电子天平[赛多利斯科学仪器(北京)有限公司];KQ-500E型超声波清洗器(昆山市超声仪器有限公司);RE-52 A型旋转蒸发器(上海亚荣生化仪器厂);TGL-16B型离心机(上海安亭科学仪器厂);SHZ-D(Ⅲ)型循环水式真空泵(巩义市予华仪器有限责任公司);LHH-150GSP型综合药品稳定性试验箱(上海蓝豹试验设备有限公司);DHG-9140A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);WD-9403型紫外分析仪(北京市六一仪器厂);LC-2010A HT项高效液相色谱仪(日本岛津公司)。
1.2 药品与试剂
乌黄骨外散(广东省中医院珠海医院制剂室,批号为120603、121005和131203);白芷对照药材(批号为120945-201309),欧前胡素(批号为110826-201214),异欧前胡素(批号为110827-201109),大黄素(批号为110756-200110),均购自中国食品药品检定研究院;C2H3N(色谱纯,德国CNW公司)、C4H8O(色谱纯,德国Merck公司),NH3·H2O、C3H8O、C4H8O2、CHCl3、CH3COOH、HCl和CH3COONH4等试剂均为分析纯,超纯水为EPED-10TF实验室超纯水器(南京易普达科技发展有限公司)制备。
2 方法与结果
2.1 定性鉴别
2.1.1 大黄:取样品2.0 g,加CH3OH 20 ml,超声(功率为500 W,频率为40 kHz)处理30 min,滤过,取续滤液5 ml,40 ℃减压蒸干,残渣加水15 ml、35%~38%HCl 1 ml,水浴回流30 min,冷却,加(C2H5)2O 15 ml萃取2次,合并萃取液后挥干,残渣加CHCl31 ml溶解,作为供试品溶液[8-10]。根据乌黄骨外散处方工艺制备不含大黄的阴性样品,同法制得阴性对照品溶液。取大黄素对照品适量,用CHCl3溶解稀释至0.2 mg/ml,做为对照品溶液。参照《中华人民共和国药典:四部》(2020年版)薄层色谱法,使用25 μl点样器吸取上述4种溶液各5 μl,分别点于同一硅胶H薄层板上,展开,展开剂为石油醚(PE,30~60 ℃)-C3H6O2-HCOOH(V∶V∶V=15 ∶ 5 ∶ 1)的上层溶液,展距为10 cm,取出,晾干,置于365 nm紫外光灯下检视。色谱图显示,供试品、对照药材和对照品显色点在对应位置上分别显示相同的黄色斑点,相关斑点氨蒸汽熏蒸后显红色;阴性对照显示无干扰,见图1。

A.紫外灯(365 nm)检视;B.日光检视;1—3.供试品(批号:120603、121005和131203);4.对照品(大黄素);5.阴性对照品A. ultraviolet lamp (365 nm); B. sunlight; from 1 to 3. test solution (batch number: 120603, 121005 and 131203); 4. reference solution (Frangula emodin); 5. negative reference图1 大黄的薄层色谱图Fig 1 TLC chromatograms of radix et rhizoma rhei
2.1.2 白芷:取样品3.2 g,加(C2H5)2O 20 ml,超声(功率为500 W,频率为40 kHz)处理30 min,加适量(C2H5)2O补足质量,滤过,滤液用0.2% NaOH 30 ml萃取3次,分离的(C2H5)2O层挥干后加 C4H8O21 ml溶解,作为供试品溶液[10-12]。取白芷对照药材0.5 g,按上述方法制成对照药材溶液。按乌黄骨外散处方工艺制备不含白芷的阴性样品,同法制得阴性对照品溶液。取欧前胡素、异欧前胡素对照品各适量,加C4H8O2制得质量浓度均为1 mg/ml的单一对照品溶液。参照《中华人民共和国药典:四部》(2020年版)薄层色谱法,使用25 μl点样器分别吸取上述4种溶液各5 μl,分别点于同一硅胶G薄层板上展开,展开剂为石油醚(PE,30~60 ℃)-(C2H5)2O(V∶V=1 ∶ 1),展距为8 cm,取出晾干后置波长为365、254 nm的紫外光灯下检视。色谱图显示,供试品、对照药材和对照品显色点在对应位置上分别显示相同的浅黄绿色及浅绿色荧光斑点;阴性对照显示无干扰,见图2。

1—3.供试品(批号:120603、121005和131203);4.白芷对照药材;5.对照品(欧前胡素、异欧前胡素);6.阴性对照品from 1 to 3. test solution (batch number: 120603, 121005 and 131203); 4. radix angelicae dahuricae reference; 5. reference solution (imperatorin, isoimperatorin); 6.negative reference图2 白芷的薄层色谱图Fig 2 TLC chromatograms of radix angelicae dahuricae
2.2 含量测定
2.2.1 色谱条件:色谱柱为十八烷基硅烷键合硅胶色谱柱(Merck Purospher STAR RP-18 endcapped,250 mm×4.6 mm,5 μm);以C2H3N-C4H8O(V∶V=25 ∶ 15)为流动相A,以0.1 mol/L CH3COONH4为流动相B,梯度洗脱(洗脱程序见表1);检测波长为235 nm;柱温为30 ℃;流速为0.8 ml/min;理论塔板数按乌头碱计算≤2 000,进样体积为10 μl[10,13-14]。

表1 流动相洗脱程序Tab 1 Gradient elution programs of mobile phase
2.2.2 溶液制备:精密称取次乌头碱、乌头碱对照品各适量,加C3H8O-CHCl3(V∶V=1 ∶ 1)溶解,制得每1 ml含次乌头碱45 μg、乌头碱300 μg的混合对照品溶液。精密称定乌黄骨外散(过三号筛)6 g,加入C3H8O-C4H8O2(V∶V=1 ∶ 1)混合溶液100 ml,振摇,加入浓NH4OH 10 ml,25 ℃以下超声(功率为500 W,频率为40 kHz)处理30 min,用C3H8O-C4H8O2(V∶V=1 ∶ 1)混合溶液补足减失的质量,摇匀,滤过。精密量取续滤液50 ml,40 ℃以下回收溶剂至干,残渣加入C3H8O-CHCl3(V∶V=1 ∶ 1)混合溶液3 ml溶解,以0.22 μm有机滤头滤过,取续滤液于4 ℃环境中静置1 h,20 000 r/min离心(离心半径为11 cm)5 min,取上清液,即得供试品溶液。按乌黄骨外散处方工艺制备不含川乌、草乌的阴性样品,按供试品溶液制备方法制成阴性对照品溶液。
2.2.3 方法学考察:(1)专属性试验。各取适量对照品溶液、供试品溶液及阴性对照溶液,依“2.2.1”项下色谱条件进样测定,记录色谱图,见图3。结果显示,乌头碱、次乌头碱保留时间TR分别为45.655、41.791 min,与周围杂峰分离度RS分别为2.374、1.750,理论塔板数分别为27 853、40 041。(2)线性关系考察。精密称取乌头碱、次乌头碱各适量,加C3H8O-CHCl3(V∶V=1 ∶ 1)制成每1 ml各含乌头碱1 000 μg、次乌头碱150 μg的混合对照品母液;分别精密量取1、2、3、4、5和6 ml,置于10 ml容量瓶中,加C3H8O-CHCl3(V∶V=1 ∶ 1)稀释至刻度,摇匀即得。分别精密吸取上述6种对照品溶液各10 μl,依“2.2.1”项下色谱条件测定峰面积。以待测成分质量浓度(X,μg/ml)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线,得到乌头碱、次乌头碱回归方程,Y1=14 590X1+1.7×105(r1=0.999 8),Y2=14 979X2+37 543(r=0.999 9)。结果显示,乌头碱、次乌头碱分别在100~600 μg/ml、15~90 μg/ml范围内线性良好。(3)精密度试验。精密吸取“2.2.2”项下混合对照品溶液适量,连续进样6次,依法测定峰面积。结果显示,乌头碱、次乌头碱峰面积的RSD分别为1.07%、0.94%(n=6),表明仪器精密度良好。(4)稳定性试验。精密吸取“2.2.2”项下同一批(批号:131203)样品,分别在0、4、8、12、16、20和24 h时进样测定。结果显示,乌头碱、次乌头碱峰面积的RSD分别为0.59%、1.35%(n=6),表明供试品溶液在24 h内稳定性良好。(5)重复性试验。取乌黄骨外散同一批号(批号:131203)样品依法制得6份供试品溶液,按“2.2.1”项下色谱条件进样,测定每份样品中乌头碱、次乌头碱含量。结果显示,样品中乌头碱、次乌头碱平均含量分别为518.60、28.97 μg/g,RSD分别为1.46%、1.99%(n=6),表明方法重复性良好。(6)加样回收率试验。精密量取同一批号(批号:131203)样品1.5 g各6份,分别精密加入1 mg/ml乌头碱对照品溶液0.75 ml、75 μg/ml次乌头碱对照品溶液0.56 ml。按“2.2.2”项下方法制备供试品溶液,依法测定含量,并计算加样回收率,结果见表2。
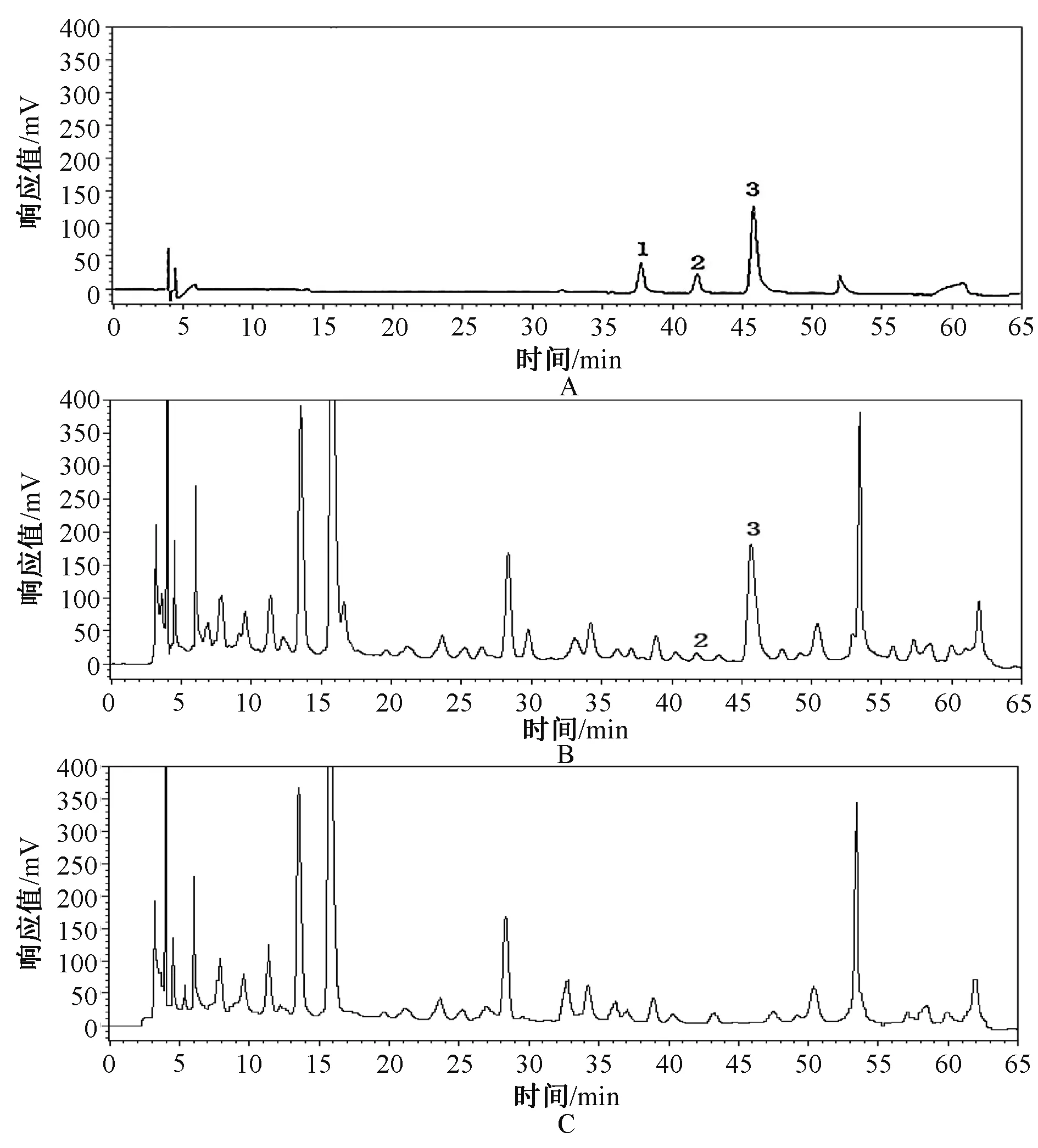
A.对照品溶液;B.供试品溶液;C.阴性对照品溶液;1.新乌头碱;2.次乌头碱;3.乌头碱A. reference solution; B. test solution; C. negative reference solution; 1. mesaconitine; 2. hypaconitine; 3. aconitine图3 高效液相色谱图Fig 3 HPLC chromatograms
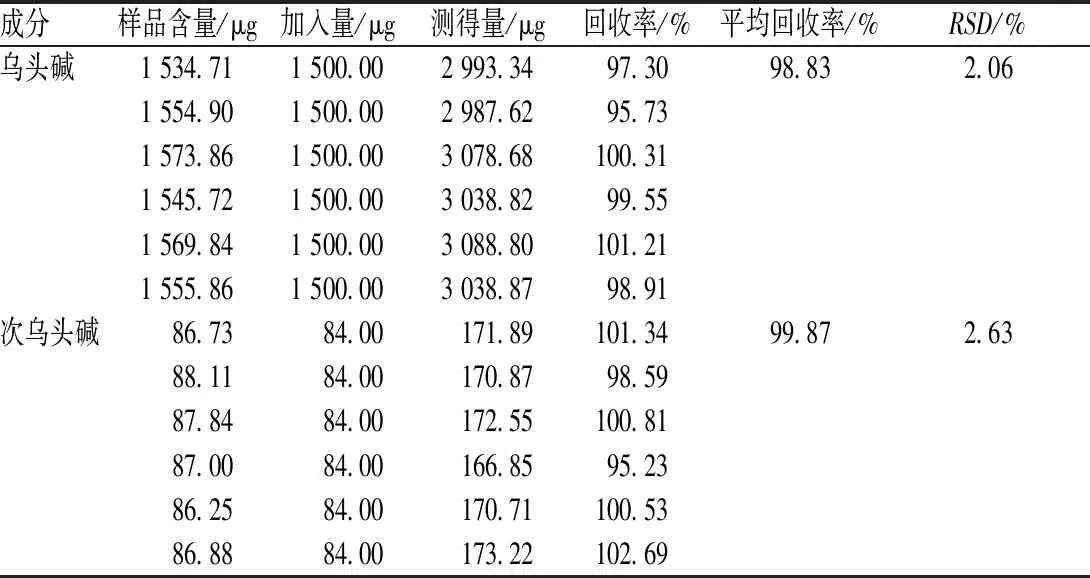
表2 加样回收率试验结果(n=6)Tab 2 Results of recovery test (n=6)
2.2.4 样品含量测定:精密称取3批样品(批号:131203、121005和120603)各适量,分别按“2.2.2”项下操作制备供试品溶液,对照品溶液和供试品溶液各进样10 μl,平行测定3次,记录峰面积,以外标法计算样品中乌头碱、次乌头碱含量,取平均值,结果见表3。

表3 乌头碱、次乌头碱的含量测定结果(μg/g,n=3)Tab 3 Content determination of aconitine and hypaconitine (μg/g, n=3)
3 讨论
毒性药材的使用是中药外用制剂的特点之一[15]。由于缺乏中药医院制剂标准规范化体系,检测指标水平偏低,导致制剂质量可控性差,进而导致临床使用存在安全风险是目前医院制剂存在的主要问题[16-18]。乌黄骨外散现行质量标准未对毒性生物碱进行定量控制,质控指标单一,难以保证有效性和安全性。因此,参考《中华人民共和国药典:一部》(2020年版),本研究以活性成分为对照,建立主要指标成分的含量测定方法。
3.1 主要指标成分的选取
乌黄骨外散方中以川乌、草乌为君药,二者合用,可祛风散寒、温经止痛;白芷祛风燥湿止痛,兼能消肿,可加强川乌、草乌散寒止痛之功,为臣药;大黄性味苦寒,活血祛瘀、清热消肿,使瘀血去,新血生,而肿胀自消,既为佐制,亦为佐助,为佐药。故本研究主要修订制剂中主要成分白芷、大黄的薄层色谱定性鉴别方法,建立川乌、草乌有毒成分乌头碱、次乌头碱的高效液相色谱定量测定方法。
3.2 薄层色谱法鉴别方法的改进
本研究中,白芷、大黄的薄层色谱法鉴别主要参考《中华人民共和国药典:一部》(2020年版)的方法,分别对温度、湿度、薄层板和展开剂进行了考察,并对展开条件进行耐用性试验。
3.2.1 白芷展开条件的筛选:本研究分别采用薄层层析硅胶板Si60[默克化工技术(上海)有限公司,规格为10 cm×20 cm]和硅胶板试剂G(青岛海洋化工厂分厂,规格为10 cm×20 cm),石油醚(30~60 ℃)-乙醚(V∶V=1 ∶ 1)和石油醚(30~60 ℃)-乙醚(V∶V=3 ∶ 2)进行研究。结果显示,硅胶板试剂G比硅胶板Si60在常温(20 ℃)下对白芷的分离效果更好,但硅胶板Si60的点更清晰,考虑到成本与分离效果,本研究采用青岛海洋化工厂分厂生产的硅胶板试剂G,以石油醚(30~60 ℃)-乙醚(V∶V=1 ∶ 1)为展开剂,耐用性好。
3.2.2 大黄展开条件的筛选:本研究以掌叶大黄为对照药材,以大黄素和大黄酸为对照品,鉴别乌黄骨外散中的大黄。预实验分别以硅胶板试剂H(青岛海洋化工厂分厂,规格为10 cm×20 cm)和自制硅胶H板(固定相为青岛海洋化工有限公司生产的薄层层析硅胶HG/T2354-2010,固定相∶ 0.5%CMC-Na=1 g∶3 ml,规格为10 cm×20 cm),结果显示,在常温条件下两者分离效果相当,考虑实验通用性,选用青岛海洋化工厂分厂生产的硅胶板试剂H。在低温(4 ℃)、低湿度(30%)和高湿度(80%)3种条件下的耐用性考察中发现,大黄酸斑点与相邻主成分斑点分离度分别为0.77、0.86和1.10,大黄素斑点与相邻主成分斑点分离度分别为2.07、1.31和1.62,最终使用大黄素作为对照。
3.3 乌头类生物碱含量限度的制定
乌黄骨外散处方中,川乌、草乌的用量(g)共占处方总用量(g)的30.82%,鉴于本品为生粉入药,按照国家药典委员会的要求(生粉入药按80%转移率计算),参照《中华人民共和国药典:一部》(2020年版)川乌、草乌项下含量限度计算,每1 g乌黄骨外散含川乌、草乌以乌头碱、次乌头碱总量计,为180~900 μg,即0.018%~0.090%。
