后腹腔镜肾部分切除术治疗内生型与外生型T1a期肾癌的效果及安全性比较
2021-12-09郭帅
郭 帅
(无锡市人民医院泌尿外科,江苏 无锡 214000)
肾癌是指起源于肾实质泌尿小管上皮的恶性肿瘤。目前,临床上尚未彻底阐明肾癌的发病原因。有研究指出,肾癌的发生可能与患者长期吸烟[1]、肥胖[2]、患有高血压及接受抗高血压治疗[3]、遗传因素、患有获得性肾囊肿病等有关。T1a期肾癌是指肿瘤局限于肾脏且最大径不超过4 cm的肾癌。自1993 年Winfield 等[4]报道后腹腔镜肾部分切除术以来,该手术获得了长足发展。后腹腔镜肾部分切除术作为治疗T1a期肾癌的重要手段,在国内外已广泛开展[5]。肾癌根据其肿瘤凸出肾脏表面的体积可分为外生型和内生型。肿瘤凸出肾脏表面的体积≤40% 的肾癌被称为内生型肾癌,肿瘤凸出肾脏表面的体积>40% 的肾癌被称为外生型肾癌。临床实践证实,对外生型T1a期肾癌患者进行后腹腔镜肾部分切除术可取得良好的效果,能在切除病灶的同时较好地保留其肾功能。内生型T1a期肾癌患者存在肿瘤定位困难、需要切除的肾组织较多、缝合难度大等问题,故对其进行后腹腔镜肾部分切除术较为困难,一些经验不足的外科医生往往选择对此类患者进行肾癌根治术。近年来陆续有学者报道了接受后腹腔镜肾部分切除术的内生型T1a期肾癌病例。但用该手术治疗内生型与外生型T1a期肾癌效果及安全性的比较研究甚少,对内生型T1a期肾癌患者进行后腹腔镜肾部分切除术的疗效、安全性尚存在争议。鉴于此,本文将49 例T1a期肾癌患者作为研究对象,比较用后腹腔镜肾部分切除术治疗内生型与外生型T1a期肾癌的效果及安全性。
1 资料与方法
1.1 一般资料
选择2020 年1 月至12 月我院收治的49 例T1a期肾癌患者作为研究对象。其纳入标准是:病情符合T1a期肾癌的诊断标准;具有进行后腹腔镜肾部分切除术的指征;自愿参与本研究。将其中23 例内生型T1a期肾癌患者设为内生型组,将其中26 例外生型T1a期肾癌患者设为外生型组。在内生型组患者中,有女9 例,男14 例;其年龄为35 ~72岁,平均年龄为(56.38±3.47)岁;其肿瘤的最大直径为4.0 cm,最小直径为1.0 cm,平均直径为(0.72±0.26)cm;其中,右肾、左肾发病的患者分别有13 例、10 例。在外生型组患者中,有女12 例,男14 例;其年龄为37 ~71 岁,平均年龄为(56.02±3.21)岁;其肿瘤的最大直径为3.5 cm,最小直径为1.1 cm,平均直径为(0.70±0.22)cm;其中,右肾、左肾发病的患者分别有14 例、12 例。两组患者的一般资料相比,P>0.05。
1.2 方法
对两组患者均进行后腹腔镜肾部分切除术,方法是:对其进行全身麻醉,使其保持健侧卧位,将腰部垫高。在髂嵴部做一个小切口,切开皮肤和皮下组织,分离肌层与腰筋膜,钝性分离腹膜后间隙。在腹膜后间隙置入气囊,向气囊内充气,扩大腹膜后间隙。分别在患侧腋后线第12肋缘下、腋前线肋缘下做一个穿刺孔,经腋后线第12 肋缘下的穿刺孔为患者建立人工气腹并置入腹腔镜。在腹腔镜下推开后腹膜脂肪,纵向切开侧锥筋膜,于腰大肌前方、肾周筋膜外游离肾脏背侧达肾蒂。游离出肾动脉主干后对肾脏进行游离,完全显露瘤体,保留瘤体表面的部分肾周脂肪,必要时可充分游离肾脏。用电凝钩在肾脏表面据肿瘤边缘约0.5 cm 处烧灼一圈,标明切除范围。用哈巴夹阻断肾动脉,并在肾周灌注冰盐水,以降低肾脏的温度。沿着之前做好的标记用剪刀将瘤体和部分肾组织完整切除,并对切缘进行快速病理检查,确保切缘呈阴性。观察创面的情况,用4-0 号可吸收线对创面血管的断端进行8 字缝合。若肾盏开放,采用4-0 号可吸收线连续缝合关闭肾集合系统。待确认肾集合系统关闭后,用2-0 号可吸收线联合hem-o-lock 夹连续缝合关闭创面。松开哈巴夹,观察肾脏血流灌注和创面出血的情况。待肾脏创面出血停止且血流灌注恢复正常后,将切除的肿瘤装入标本袋并取出。退出手术器械,关闭肾周脂肪囊,放置腹膜后引流管,解除气腹,缝合手术切口。
1.3 观察指标
比较两组患者手术的时间、术中肾脏热缺血的时间、术中的出血量、术后住院的时间及术后并发症的发生率。手术前后,比较两组患者的肾小球滤过率(glomerular filtration rate,GFR)。术后对两组患者进行随访,观察其病情复发及肿瘤转移的情况。
1.4 统计学方法
用SPSS 23.0 软件处理本研究中的数据,计量资料用±s表示,组间比较用成组t检验,组内比较用配对t检验;计数资料用% 表示,用χ² 检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 两组患者各项临床指标的比较
两组患者术中的出血量及术后住院的时间相比,P>0.05。外生型组患者手术的时间和术中肾脏热缺血的时间均短于内生型组患者,P<0.05。详见表1。
表1 两组患者各项临床指标的比较(± s)

表1 两组患者各项临床指标的比较(± s)
外生型组(n=26)内生型组(n=23)P 值指标手术的时间(min) 95.36±35.85 118.9±33.18 0.001术中肾脏热缺血的时间(min) 25.52±6.98 35.26±6.7 0.001术中的出血量(mL) 75.33±69.21 79.45±74.98 0.588术后住院的时间(d) 7.15±0.81 7.16±0.79 0.896
2.2 两组患者术后并发症发生率的比较
两组患者术后并发症的发生率相比,P>0.05。详见表2。

表2 两组患者术后并发症发生率的比较
2.3 手术前后两组患者GFR 的比较
手术前后,两组患者的GFR 相比,P>0.05。详见表3。
表3 手术前后两组患者GFR 的比较(mL/min,± s)
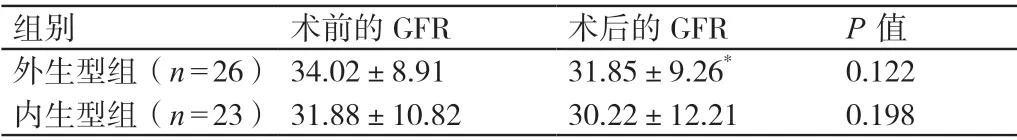
表3 手术前后两组患者GFR 的比较(mL/min,± s)
注:* 与术后内生型组相比,P >0.05。
组别 术前的GFR 术后的GFR P 值外生型组(n=26) 34.02±8.91 31.85±9.26* 0.122内生型组(n=23) 31.88±10.82 30.22±12.21 0.198
2.4 术后两组患者病情的复发及肿瘤转移的情况
术后对两组患者进行3 ~12 个月的随访(随访至2021年3 月)发现,其病情均未复发,肿瘤均未发生转移。
3 讨论
国内外关于采用后腹腔镜下肾部分切除术治疗外生型T1a期肾癌已有较多的报道。Uzzo 和Novick[6]回顾性分析对1833 例肾癌患者进行保肾手术的经验发现,当肾癌患者肿瘤的直径≤4 cm 时,其术后病情的复发率为0% ~3%,术后5 年内的生存率高达98%。另有文献报道,采用后腹腔镜肾部分切除术和开放肾部分切除术治疗早期肾癌时,患者术后病情的复发率和生存率相当[7]。Zhang 等[8]研究指出,用后腹腔镜肾癌根治术与后腹腔镜肾部分切除术治疗早期肾癌时,患者术后的生存率、病情的复发率和肿瘤的转移率相比差异不明显。现阶段,后腹腔镜肾部分切除术已成为临床上治疗外生型T1a期肾癌的首选术式。近年来随着腹腔镜技术的发展及外科医生经验的累积,后腹腔镜下肾部分切除术在国内外内生型T1a期肾癌的治疗中逐渐得到应用。本研究中我们对26 例外生型T1a期肾癌患者进行后腹腔镜下肾部分切除术均取得成功。通过对本组病例进行分析,我们认为对外生型T1a期肾癌患者进行后腹腔镜下肾部分切除术时应注意以下几点:1)术中应清晰、直观地暴露手术视野。2)术中应尽量减少患者肾脏热缺血的时间。据报道,进行后腹腔镜肾部分切除术时应将患者肾脏热缺血的时间控制在30 min 内,以避免其发生不可逆的肾功能损害[9]。另有研究指出,术中肾蒂阻断的时间在45 min 内一般不会影响患者远期的肾功能[10]。3)术中将肿瘤切除后,应确保肿瘤的切缘呈阴性,这对预防患者术后病情复发及肿瘤转移至关重要。距肿瘤边缘0.5 ~1 cm 是目前国内外大部分学者公认的肿瘤最佳的切除范围[10-11]。本组患者我们距肿瘤边缘0.5 cm 将肿瘤切除,其肿瘤切缘均呈阴性,术后对其进行随访发现其病情均未复发,肿瘤均未发生转移。由此可初步认为,距肿瘤边缘0.5 cm 将肿瘤切除是安全的,但这一观点仍需进一步证实。4)术中对肾实质创面中较大的、肉眼可见的血管断端进行缝扎是有必要的,可减少患者术中的出血量,预防其术后发生创面血肿。本研究中对本组患者创面血管的断端均进行8 字缝合,术后其创面均未发生血肿。另外,本组患者的肿瘤呈外生性生长且肿瘤的直径较小,故术中未见其发生肾集合系统损伤。我们认为,在对内生型T1a期肾癌患者进行后腹腔镜下肾部分切除术时除了要做到以上几点外,还应注意以下几点:1)术前、术中应准确地定位肿瘤,明确肿瘤与正常组织间有无界限、肿瘤与肾集合系统的关系、肿瘤与大血管的关系等。术前对患者进行CT 检查和磁共振检查有助于了解其上述情况。有研究指出,将三维动态增强扫描作为保留肾单位手术前的常规评估手段,有助于手术医生了解患者手术部位的解剖层次、结构,使其对手术流程做出完整的预判[12]。此外,术中还可通过进行腹腔镜超声检查辅助定位肿瘤,了解其深度和范围,确保将肿瘤切除后其切缘呈阴性。本研究中对本组23 例患者进行手术时均能够正确地判断肿瘤的位置,其中有1 例完全内生型T1a期肾癌患者通过进行腹腔镜超声检查明确了肿瘤的位置。我们的经验是,对于非完全内生型T1a期肾癌患者,在认真反复阅片(术前的影像资料)的基础上可准确地把握肿瘤的位置并将其完整切除;对于完全内生型T1a期肾癌患者,术中对其进行腹腔镜超声检查或三维动态增强扫描对定位肿瘤可能有一定帮助,但这一观点需要进一步证实。2)与相同直径的外生型肾癌比,内生型肾癌由于其手术切除的范围较大、创面较广、渗血较多,故术中易出现手术视野不够清晰的情况,且对出血的控制要求也相对较高。有报道称,对内生型肾癌患者进行后腹腔镜肾部分切除术时,同时阻断肾动脉和肾静脉能减少肾脏创面的出血量,清晰地暴露手术视野[7]。但我们认为,术中常规阻断肾动脉即可有效地控制术中出血,再配合吸引器间歇性抽吸肾床内的血液,可清晰地暴露手术视野,且不影响后续的缝合等操作。本组23 例患者术中均仅阻断肾动脉,术中其肾脏热缺血的平均时间为(35.26±6.7min)。3)内生型肾癌多与肾集合系统距离较近,故术中肾集合系统被打开的可能性较大。国外有学者对内生型肾癌患者进行后腹腔镜肾部分切除术时通过术前留置输尿管来检测其术中是否发生肾集合系统损伤,并为肾集合系统打开的患者留置输尿管内支架进行引流减压[13-14]。本组23 例患者中有15 例患者术中发生肾集合系统损伤。我们的处理方法是:仔细寻找其肾集合系统破口并予以缝合,未为其留置输尿管内支架。这15 例患者中有2 例患者术后出现排血尿的症状,后自行好转,未发生尿瘘。因此我们认为,在直视下缝合受损的肾集合系统是安全有效的,为肾集合系统损伤患者留置输尿管内支架的意义不大。本研究的结果显示,外生型组患者术中肾脏热缺血的时间和手术的时间均短于内生型组患者。究其原因主要是,在肿瘤大小和分布无明显差异的情况下,对外生型肾癌患者进行手术的难度明显小于对内生型肾癌患者进行手术的难度;在对外生型肾癌患者进行手术时,通常不需要完全游离肾脏,切除的部分相对较少,缝合起来相对容易,故可缩短患者术中肾脏热缺血的时间和手术的时间;对于内生型肾癌患者来说,术中为了方便后续的缝合、止血等操作,通常需要充分游离肾脏,且其存在切除的肾组织多、创面缝合的面积大、肾集合系统被打开等问题,故需要更长的手术时间和肾动脉阻断的时间。本研究中两组患者术中的出血量均较少,这得益于手术医生熟练的操作技术及严密细致的止血处理。本研究中两组患者的手术过程均较为顺利,无患者转为进行开腹手术,且其术后均未出现严重的并发症。内生型组患者中有1 例患者术后出现排血尿的症状,后自行好转;有1 例患者发生皮下气肿,未经处理自行好转。外生型组患者中有3 例患者发生皮下气肿,未经处理自行好转。我们分析认为,术后患者出现排血尿的症状可能与其手术切口未愈合有关;术后患者发生皮下气肿可能与穿刺孔较大及术中套管滑脱有关。我们认为,在对肾癌患者进行后腹腔镜肾部分切除术时,术中应仔细缝合关闭肾集合系统及缝扎血管的断端,对于术后患者出现的排血尿症状一般无需进行处理;术中应熟练掌握切口的穿刺技巧,并避免套管滑脱,以预防患者术后发生皮下气肿。有文献报道,接受腹腔镜肾部分切除术的肾癌患者术后有发生尿瘘的可能[15]。我们认为,术中肾集合系统被打开的患者术后可能发生尿瘘,但通过术中小心细致的操作及严密仔细的观察修补,可避免患者术后发生尿瘘。本研究中两组患者术后均未发生尿瘘。本研究的结果显示,两组患者手术前后的GFR 无明显变化。究其原因主要是,术中我们严格控制患者肾脏切除的范围,从而有利于保护及保留其肾功能。
综上所述,用后腹腔镜肾部分切除术治疗内生型与外生型T1a期肾癌的整体疗效和安全性相当。与对内生型T1a期肾癌患者进行后腹腔镜肾部分切除术相比,对外生型T1a期肾癌患者进行该手术时其手术时间和术中肾脏热缺血的时间均更短。对于具备一定手术经验和技巧的外科医生来说,选用后腹腔镜肾部分切除术治疗内生型T1a期肾癌是安全可行的。
