微小病变性肾病合并2型糖尿病患者的临床病理特点及预后分析
2021-12-08姚星辰翟亚玲高静歌陈雅卓王新念卢珊赵占正
姚星辰 ,翟亚玲 ,高静歌 ,陈雅卓 ,王新念 ,卢珊 ,赵占正 *
微小病变肾病(MCD)是特发性肾病综合征(NS)的主要原因,其特征为大量蛋白尿,低白蛋白血症,发病年龄广泛,并以青少年为主[1]。MCD的病理特征是在光镜下肾小球基本正常,免疫荧光检测多为阴性,而电镜下肾小球脏层上皮细胞足突弥漫融合[2]。MCD具有较高的缓解率,但是易复发,且可能合并危及生命的并发症,如血栓、急性肾衰竭(AKI)、感染。随着生活水平的提高以及人类生活环境的改变,2型糖尿病(T2DM)的发病率不断上升[3],成为导致慢性肾脏病(CKD)和终末期肾病的主要原因之一[4]。T2DM的发病年龄呈年轻化趋势[5],临床上同时出现MCD合并T2DM的情况并不罕见,但关于MCD合并T2DM与单纯MCD患者的差异报道较少。国外仅见少量关于MCD合并T2DM的个案报道[6-7],在研究T2DM合并非糖尿病肾病(DN)的文章中,MCD合并T2DM曾被提及[8-9],但均未对MCD合并T2DM的临床病理特点以及预后情况进行深入探讨。本文旨在分析MCD合并T2DM患者临床病理特点及其预后,为今后临床上对MCD合并T2DM的诊断、治疗以及预后情况的预测提供参考。
1 对象与方法
1.1 研究对象 收集2017年6月1日—2018年6月1日在郑州大学第一附属医院肾内科就诊并且肾穿刺活检确诊为MCD合并T2DM患者20例(MCD合并T2DM组),单纯MCD患者306例,为达到统计学的把握度,利用SPSS 22.0软件从306例MCD患者中随机筛选出100例,作为单纯MCD组。纳入标准:(1)肾组织病理检查确诊为原发性MCD;(2)T2DM诊断标准根据2017年美国糖尿病协会(ADA)诊疗标准[10];(3)未使用激素和免疫抑制剂。排除标准:(1)肾穿刺活检显示DN;(2)除外其他非MCD的肾小球疾病;(3)继发性MCD[11],如过敏、非甾体抗炎药、肿瘤以及病毒引起的感染所导致的继发性MCD;(4)肾活检标本的肾小球数<10个;(5)临床资料不完整。本研究经郑州大学第一附属医院伦理委员会审核,患者均签署知情同意书。
1.2 研究方法
1.2.1 临床资料收集 收集患者人口学资料及实验室检查结果,主要包括性别、年龄、收缩压(SBP)、舒张压(DBP)、合并高血压、血糖、糖化血红蛋白(HbA1c)、尿素氮(BUN)、肌酐(Cr)、尿酸(UA)、清蛋白(ALB)、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、红细胞沉降率(ESR)、C反应蛋白(CRP)、24 h尿蛋白量、C3、C4、IgG、IgM、IgA,以及并发症〔如感染(包括上呼吸道感染、肺部感染、胃肠道感染、菌血症等)、AKI、静脉血栓等〕。
1.2.2 肾组织病理检查 医院病理系统中查阅病理报告收集患者的肾组织病理检查结果,主要包括免疫荧光IgG(0代表-,-/+;1代表+~++)、IgM(0代表-,-/+;1代表+~++)、IgA(0代表-,-/+;1代表+~++)、C3(0代表-,-/+;1代表+~++)、C4(0代表-,-/+;1代表+~++)、血管损伤程度(0表示单纯血管壁增厚;1表示除血管壁增厚,还合并其他病变,如纤维素样坏死,玻璃样变等)、肾小管萎缩程度(0代表无萎缩,1代表<25%肾小管萎缩,2代表25%~50%肾小管萎缩,3代表>50%肾小管萎缩)、肾间质纤维化(0代表无纤维化,1代表有纤维化)、肾间质炎症(0代表无炎症,1代表有炎症)、球形硬化小球占比。
1.3 预后及判断指标 从患者首次肾穿刺活检开始随访,到出现复发或2019年6月随访结束。2012年全球肾脏病预后组织(KDIGO)指南中,完全缓解(CR)定义是蛋白尿减少到<0.3 g/d,尿蛋白肌酐比值<0.3 g/gcr和/或尿蛋白试纸阴性。复发定义为在尿蛋白增加至0.3 g/d、尿蛋白肌酐比值0.3 g/gcr和/或尿蛋白试纸1+,并加强免疫抑制治疗[11]。无复发生存期(RFS)的定义是从完全缓解到复发的时间。2012年KDIGO指南中关于AKI的定义:48 h内Cr升高超过26.5 μmol/L,或确认/推测7 d内Cr升高至基线的1.5倍,或持续 6 h 尿量 <0.5 ml·kg-1·h-1[12]。
1.4 统计学方法 采用SPSS 22.0统计学软件进行数据的统计学处理,Graphpad Prism 8.0软件进行图表绘制。符合正态分布的计量资料采用(±s)表示,两组间比较采用独立样本t检验;不符合正态分布的计量资料用M(P25,P75)表示,两组间比较采用非参数检验;计数资料采用相对数表示,两组间比较采用χ2检验或Fisher's确切概率法;采用单因素Logistic回归分析及多因素Logistic回归分析探讨MCD合并T2DM的影响因素;采用Log-rank检验比较MCD及MCD合并T2DM的累积CR率和累积无复发生存率。以P<0.05为差异有统计学意义。
本文创新点:
随着2型糖尿病(T2DM)年轻化趋势,微小病变肾病(MCD)合并T2DM在临床上已不罕见,但其临床病理特点及预后情况仍不清楚。本研究结果发现,MCD合并T2DM患者的临床表现与单纯MCD患者相比轻,但病理表现却较重,提示临床医生在今后的工作中应注意肾穿刺活检的重要性,避免通过临床检验结果轻易判断患者的疾病状态,从而引起误诊误治。其次,研究发现肾间质纤维化程度重、血管损伤程度重、高IgG水平是MCD合并T2DM的危险因素。并且MCD合并T2DM的预后较差,应该及早诊断及早治疗。
2 结果
2.1 两组间临床资料比较 MCD合并T2DM组患者年龄、SBP、合并高血压所占比例、血糖、HbA1c、ALB、IgG水平高于单纯MCD组,男性所占比例、TC、HDL、LDL、ESR、24 h尿蛋白量低于单纯MCD组,差异均有统计学意义(P<0.05)。两组间DBP、BUN、Cr、UA、TG、CRP、C3、C4、IgM、IgA、感染发生率、AKI发生率、静脉血栓发生率比较,差异均无统计学意义(P>0.05,见表1)。MCD合并T2DM组中有2例(10%)发生感染,包括1例上呼吸道感染,1例肺部感染,单纯MCD组有26例(26%)发生感染,包括18例肺部感染、7例胃肠道感染、1例上呼吸道感染。两组患者感染发生率比较,差异无统计学意义(P=0.391)。
2.2 病理资料比较 两组间IgG阳性、IgM阳性、IgA阳性、C3阳性、C4阳性所占比例比较,差异均无统计学意义(P>0.05)。两组间血管损伤程度、肾小管萎缩程度、肾间质纤维化、肾间质炎症、球形硬化小球所占比例比较,差异均有统计学意义(P<0.05,见表2)。
2.3 MCD合并T2DM影响因素分析 以MCD合并T2DM(赋值:0=单纯MCD,1=MCD合并T2DM)为因变量,以性别(赋值:1=男,2=女)、年龄(赋值:连续变量)、高血压(赋值:0=无,1=有)、HbA1c(赋值:连续变量)、Cr(赋值:连续变量)、UA(赋值:连续变量)、ALB(赋值:连续变量)、TC(赋值:连续变量)、ESR(赋值:连续变量)、CRP(赋值:连续变量)、24 h尿蛋白量(赋值:连续变量)、C3(赋值:连续变量)、C4(赋值:连续变量)、IgG(赋值:连续变量)、IgM(赋值:连续变量)、IgA(赋值:连续变量)、AKI(赋值:0=无,1=有)、感染(赋值:0=无,1=有)、静脉血栓(赋值:0=无,1=有)、肾小管萎缩程度(赋值:按实际情况输入)、肾间质纤维化(赋值:按实际情况输入)、肾间质炎症(赋值:按实际情况输入)、球形硬化小球占比(赋值:连续变量)、血管损伤程度(赋值:按实际情况输入)为自变量进行单因素Logistic回归分析,而SBP、DBP、血糖、BUN、TG、HDL、LDL等指标由于与已纳入指标有较强的临床相关性,且与已纳入指标相比临床意义较小,可能会造成多重共线性,影响进一步的多因素回归分析,所以未纳入。结果显示,性别、年龄、高血压、HbA1c、ALB、TC、ESR、24 h尿蛋白量、IgG、球形硬化小球所占比例、血管损伤程度、肾小管萎缩程度、肾间质纤维化、肾间质炎症是MCD合并T2DM的影响因素(P<0.05,见表3)。由于HbA1c和球形硬化所占比例的置信区间过大,影响OR值的精确度,予以剔除,将剩下的因素再纳入多因素Logistic回归分析(赋值情况同单因素Logistic回归分析),结果显示,IgG水平、血管损伤程度、肾间质纤维化是MCD合并T2DM的影响因素(P<0.05,见表4)。

表1 单纯MCD组与MCD合并T2DM组患者临床资料比较Table 1 Comparison of baseline clinical data between two groups

表2 单纯MCD与MCD合并T2DM组患者肾组织病理资料的比较〔n(%)〕Table 2 Comparison of pathological data withrenal tissue between two groups
2.4 预后情况 120例患者中116例进入随访,MCD合并T2DM组20例,单纯MCD组96例。中位随访时间为15(7,23)个月,单纯MCD组的中位随访时间为16(10,23)个月,MCD合并T2DM组为10(3,25)个月,两组随访时间比较,差异无统计学差异(Z=789.500,P=0.212)。MCD合并T2DM组共有9例达到CR,达到CR的时间为1~7个月,平均(2.8±3.3)个月;单纯MCD组共有76例达到CR,达到CR的时间为1~11个月,平均(2.6±2.8)个月。在CR患者中,MCD合并T2DM组有7例复发,RFS为3~23个月,平均(10.5±7.6)个月;单纯MCD组有36例复发,从CR到复发的时间为1~39个月,平均(12.1±8.0)个月。Log-rank检验结果显示,MCD合并T2DM组的累计CR率低于单纯MCD组(P=0.027,见图1)。两组的累积无复发生存率比较,差异无统计学意义(P=0.318,见图2)。
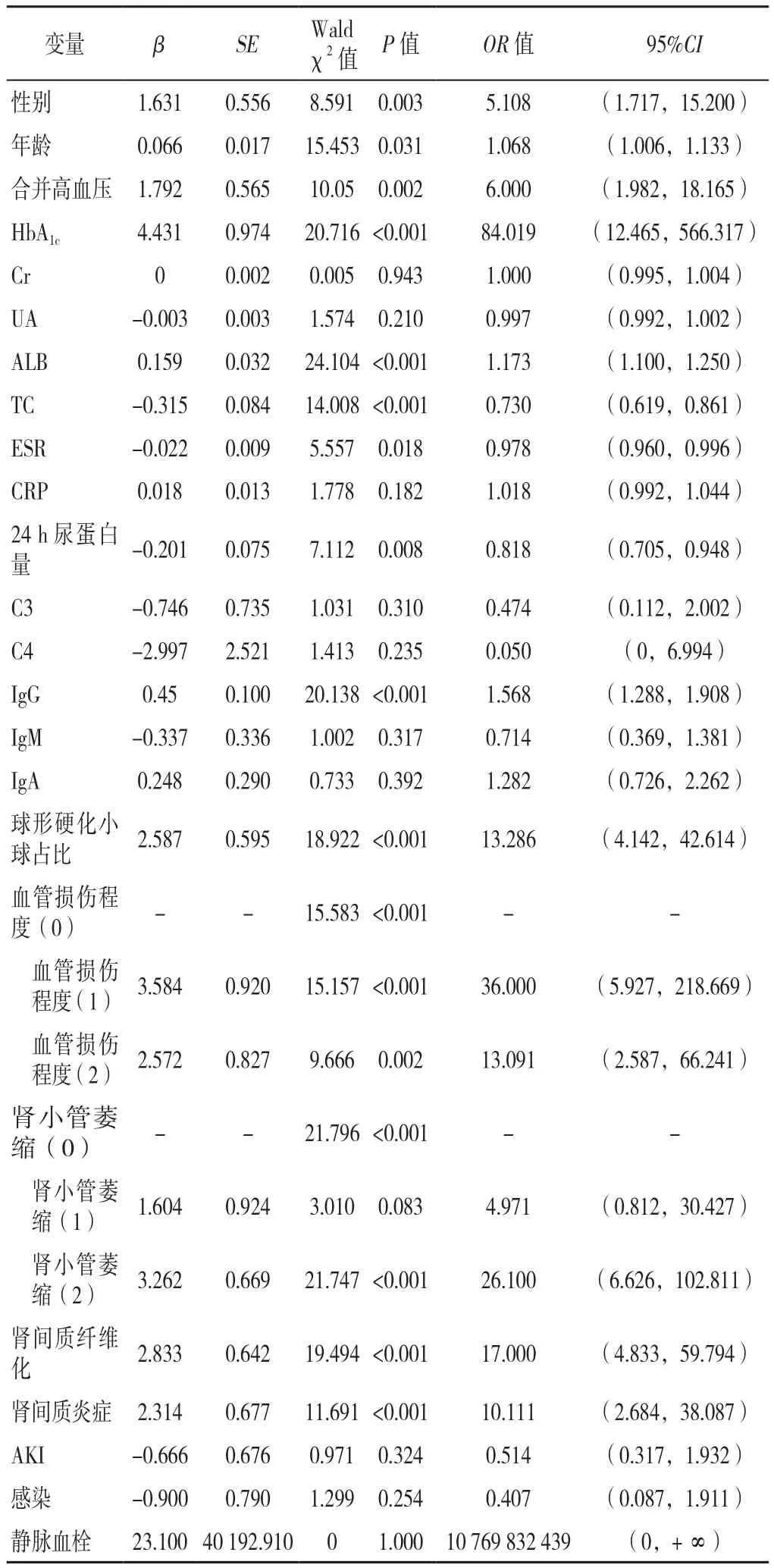
表3 MCD合并T2DM影响因素的单因素Logistic回归分析Table 3 Univariate Logistic regression of the possible risk factors for MCD with T2DM
3 讨论
在成人群体中,MCD为继膜性肾病和局灶节段性肾小球硬化之后第3个导致特发性NS的重要原因,在>1岁的儿童群体中,MCD是常见的NS,占比高达70%~90%。临床上,MCD合并T2DM的发病已不罕见,本研究的结果发现,与单纯MCD组相比,MCD合并T2DM组的临床症状较轻,但病理表现相对较重;女性、高龄、高龄、合并高血压、血管损伤程度重、高IgG是MCD合并T2DM的独立危险因素;预后分析显示,MCD合并T2DM组的CR率低。

表4 MCD合并T2DM影响因素的多因素Logistic回归分析Table 4 Multivariate logistic regression of the possible risk factors for MCD with DM
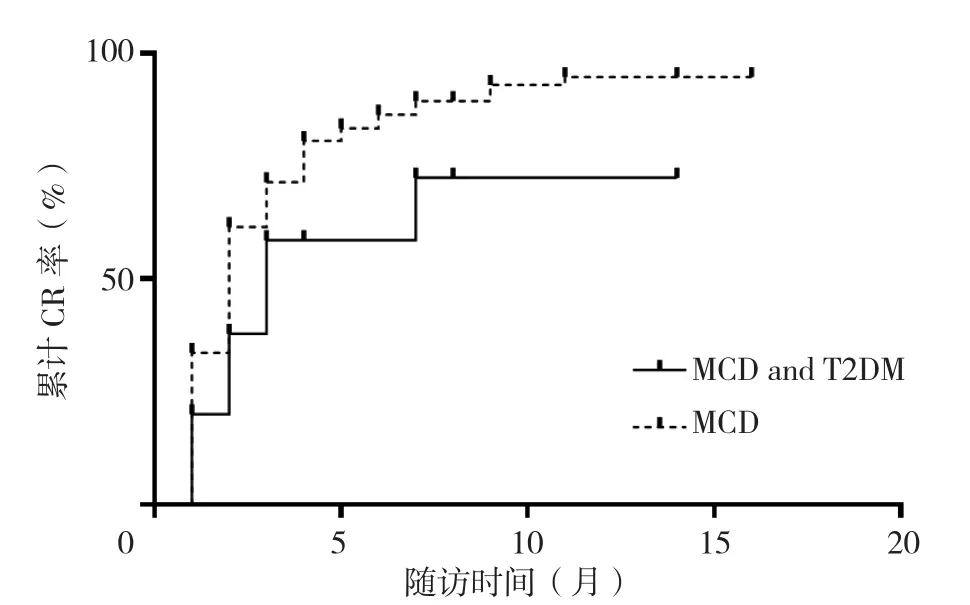
图1 MCD合并T2DM患者及MCD患者的累计CR率比较Figure 1 Cumulative complete remission rate in two groups

图2 MCD合并T2DM患者及MCD患者的累计无复发生存率比较Figure 2 Recurrence-free survival rate in two groups
在以往的研究中,年龄增长、高血压、高血脂、家族史、肥胖、饮酒是T2DM的危险因素[5,13]。本研究结果显示,与单纯MCD组相比,MCD合并T2DM组的患者年龄大、合并高血压所占比例高,与上述研究结果一致。根据世界卫生组织(WHO)2016年T2DM国家概况报道,在中国,T2DM的男性患病率为10.5%,女性为8.3%。但河南省T2DM流行病学研究显示,男性和女性T2DM患病率差异无统计学意义,>35岁男性T2DM患病率高于女性,而65~74岁男性T2DM患病率低于女性[14]。本研究中,MCD合并T2DM的患者中女性较多,结合上述河南省T2DM流行病学分析,考虑可能由于MCD合并T2DM组的年龄较大,中位年龄为51(45,57)岁,处于女性的围绝经期,体内雌激素水平下降,引起一系列内分泌改变,易引起血糖升高。与单纯MCD组相比,MCD合并T2DM组的ALB、IgG水平较高,TC、ESR、24 h尿蛋白量均较低。似乎与单纯MCD患者相比,MCD合并T2DM患者的临床症状较轻,可能由于T2DM患者常规检查肾功能,一旦发现蛋白尿、血尿,及时行肾穿刺活检明确病理类型,使得T2DM患者肾脏受累在病情较轻时被及时发现。
NS主要的并发症包括感染、静脉血栓、AKI等。并发症不但会影响MCD合并T2DM的治疗效果,还会影响其预后,加重复发[15],因此,在MCD合并T2DM的治疗中,防治并发症非常关键。其中感染是MCD最主要的并发症,导致感染发生的原因包括明显的IgG下降、免疫功能下降[16]、皮下积液[17]及激素的使用。AKI好发于MCD患者[18],在成年人中多见,通常是由一些伴随因素如脓毒血症、腹泻、利尿剂等造成的[19]。本研究结果显示,MCD合并T2DM组的感染、AKI、静脉血栓的发生率与单纯MCD组比较,无统计学差异,与相关研究结果[20-21]不一致。T2DM又被视为一种内皮细胞疾病。血糖持续高水平会导致内皮细胞损伤,从而导致血管损伤[22-23]。并且LEE等[23]通过动物实验证实肾小球毛细血管内皮细胞的损伤,是引起肾小球系膜细胞病变及肾小球硬化的始动因素。导致T2DM血管内皮细胞损伤的因素包括高血糖、血脂异常、氧化应激反应、炎性因子及血管紧张素Ⅱ(AngⅡ)活化等。在本研究中,与单纯MCD组相比,MCD合并T2DM组的血管损伤程度较重,考虑是因为血糖水平升高导致血管内皮细胞损伤加重。T2DM会导致肾小球硬化,机制包括转化生长因子β(TGF-β)在系膜细胞中表达增强、P21和P27在系膜细胞中表达增多、高糖状态引起足突融合和足细胞凋亡、血管紧张素调节一系列因子导致系膜基质合成、GBM增厚以及足细胞凋亡及脱落、高糖状态下,活性氧簇(ROS)产物表达增多,破坏足细胞结构等[24]。本研究中,MCD合并T2DM组的肾小球球形硬化所占比例高于单纯MCD组,考虑与上述原因相关。与此同时,MCD合并T2DM组的血管损伤、肾小管萎缩、肾间质纤维化以及肾间质炎症均较重。由此可见,与单纯MCD组相比,MCD合并T2DM的临床表现较轻微,但病理表现却相对较重。
本研究结果显示,MCD合并T2DM组的CR率明显低于单纯MCD组,可能与其病理表现较重有关。HARRIS等[25]在关于DN的研究中指出,球性硬化是影响肾脏预后的独立危险因素。对于肾间质纤维化及肾小管萎缩,也有研究证明,其与肾功能下降有关,可能是肾脏预后的独立预测因素[26-27]。虽然这些研究都是关于DN的,但是也可以说明高糖对肾脏病理结构的影响以及这些病理结构对肾脏预后的影响。在研究进行的时间段内,仅有2位MCD合并T2DM的患者,一位为63岁男性,NS合并AKI,给予激素治疗1个月后CR,但5个月后再发,使用激素联合他克莫司治疗效果较差,改为激素联合环磷酰胺达到CR。另一位患者为51岁女性,NS合并AKI和胰腺炎,给予甲泼尼龙20 mg/次,2次/d,共6 d,后改为15 mg/次,3次/d,1个月后复查,24 h尿蛋白量为0.97 g,在当地医院治疗至今,回访已CR。由于MCD合并T2DM患者样本量少,无法进行统计,故未纳入本研究,仅在此做补充说明。MCD合并T2DM的临床症状较轻,但其预后不佳,提示临床医生对于合并T2DM的MCD患者,需及时进行早期治疗。
本研究存在一定的局限性:(1)本研究是单中心研究;(2)由于MCD与T2DM发病年龄的不重叠,且本研究样本量偏少,仍需要进一步扩大样本量进行验证。
综上所述,MCD合并T2DM患者的临床表现较单纯MCD患者轻,但病理表现却较重,提示临床医师肾穿刺活检的重要性。肾间质纤维化、血管损伤程度重、高IgG是MCD合并T2DM的危险因素。MCD合并T2DM的预后较差。尽管有局限性,但这项回顾性研究可能对临床工作提供一些帮助。
作者贡献:姚星辰、翟亚玲进行文章的构思与设计;姚星辰进行研究的实施与可行性分析、数据收集与整理、统计学处理,撰写论文;高静歌、陈雅卓进行结果的分析与解释;王新念、卢珊进行论文的修订;赵占正负责文章的质量控制及审校;姚星辰、翟亚玲对文章整体负责,监督管理。
本文无利益冲突。
