改良法分离培养SD新生乳鼠原代心肌细胞*
2021-12-08孟香红陈慧玲李伟东徐小勇
孟香红, 曾 斌, 陈慧玲, 李伟东, 李 娜, 徐小勇
(1. 宁波卫生职业技术学院医学技术学院, 浙江 宁波 315104; 2. 宁波市医疗中心李惠利医院心血管科, 浙江 宁波 315040)
原代心肌细胞由于不受机体神经体液因素干扰,同时保持着众多在体心肌细胞的结构和功能特点,是心血管疾病临床和基础研究无可替代的体外实验模型。自20世纪60年代,Harary等[1]成功分离培养心肌细胞以来,关于原代心肌细胞纯化培养的方法不断改进和完善[2-4],但仍旧存在操作繁琐、耗时较长、存活率不高、结构破坏等诸多缺陷[5],且心肌细胞近乎是终末分化细胞无法传代培养,实验时必须每次从头分离纯化。因此,如何实现原代心肌细胞的简单快捷、高纯度、高活力分离培养,仍是心血管研究领域的亟待解决的瓶颈问题。本文利用Percoll梯度离心+5-溴脱氧尿嘧啶(5-BrdU)化学抑制法,将纯化的原代心肌细胞体外培养于含5%马血清的改良DMEM/F12中,在较短时间内成功获得了生长状态稳定、活力和纯度较高的原代新生大鼠心肌细胞,为心脏疾病机制研究和药物开发提供了理想的体外实验模型。
1 材料与方法
1.1 实验动物
SPF级新生SD 乳鼠(出生1~2 d),雌雄不限,由罗格斯大学新泽西医学院实验动物中心提供。
1.2 主要实验试剂及设备
DMEM/F12或高糖DMEM培养基(Invitrogen);丙酮酸钠(Thermo Fisher); 维生素C(Gibco);亚油酸(Sigma);Ⅱ型胶原酶(Worthington Biochemical);Percoll密度梯度离心液(GE Healthcare);HEPES(Amresco);马血清、胎牛血清(Gibco);5-溴脱氧尿嘧啶、台盼蓝、0.1%Triton-X100、4% 多聚甲醛、PBS、DAPI(Sigma);青链霉素、cTNT 鼠单克隆抗体(Invitrogen);Alexa Fluor 568驴抗鼠荧光二抗(Thermo Fisher);荧光相差显微镜(Olympus);二氧化碳细胞培养箱(Thermo Fisher);倒置光学显微镜(Leica)。
1.3 改良法分离纯化新生大鼠原代心肌细胞
1窝SD新生乳鼠(约10 只,出生不超过 2 d),乙醚麻醉后,碘伏消毒胸壁,开胸取出心脏,置于冰上预冷的PBS中清洗残存血液。弃心房,将心室部分移到手术玻璃板的凹槽中剪成 1 mm3碎块(冰上操作)。将心脏碎块移入灭菌的烧瓶中,加入 0.12% II型胶原酶(每个心脏约1 ml II 型胶原酶)37 ℃恒温水浴摇床中消化15 min,转速 220 r/min。将上清液转移到冰上装有2 ml马血清的EP管中终止消化,再次将胶原酶加至烧瓶中消化剩余心脏组织,重复3次以上直至所有组织被消化完全。将消化好的细胞悬液于4℃、1 000 r/min离心10 min,弃上清,加入0.5 ml重悬缓冲液并合并细胞悬液,用于分离纯化。
配制高密度(1.086 g/ml)和低密度(1.060 g/ml)Percoll液,在15 ml Falcon管中加入4 ml高密度分离液,后缓慢、轻柔地加入3 ml低密度分离液,便可在顶部和底部梯度之间出现清晰的中间相。将2 ml细胞悬液缓慢加到Percoll 液上面,4℃、3 000 r/min离心30 min,自然减速无刹车,即可获得 2层分界清楚的细胞带(图1)。上层细胞带(低密度Percoll液上面)主要是成纤维细胞,少量内皮细胞和心肌细胞;下层细胞带(低密度与高密度Percoll液之间)即主要为原代心肌细胞。吸弃下层细胞带以上部分,将下层细胞带中漂浮的心肌细胞转移到新EP管中,加入重悬缓冲液,2 000 r/min离心5 min洗涤细胞,弃上清,重复1次。用37℃预热的10 ml含5%马血清的DMEM/F12培养基充分重悬细胞沉淀并行细胞计数(避免气泡,反复轻柔吹打30 次以上)。调整心肌细胞的浓度为1×106cells/ml,将心肌细胞接种到经0.3%明胶包被,含5%马血清、100 μmol/L 5-溴脱氧尿嘧啶(5-BrdU)并添加各种营养因子的改良DMEM/F12培养基的培养皿中(表1),次日更换为普通无 5-BrdU含 10%胎牛血清(FBS)的高糖 DMEM 继续培养或进行相应处理和观察。
3 ml of low-density Percoll separation solution was slowly added to 4 ml of high-density Percoll solution to form a discontinuous gradient. Then 2ml of cell suspension was slowly added to Percoll solution and centrifuged at 4℃ at 3 000 r/min for 30 min to obtain 2 layers of well-defined cell bands. The upper cell band (above the low-density Percoll solution) was mainly fibroblasts, with a small amount of endothelial cells and cardiomyocytes. The bottom cell band (between low and high-density Percoll solution) was mainly primary cardiomyocytes
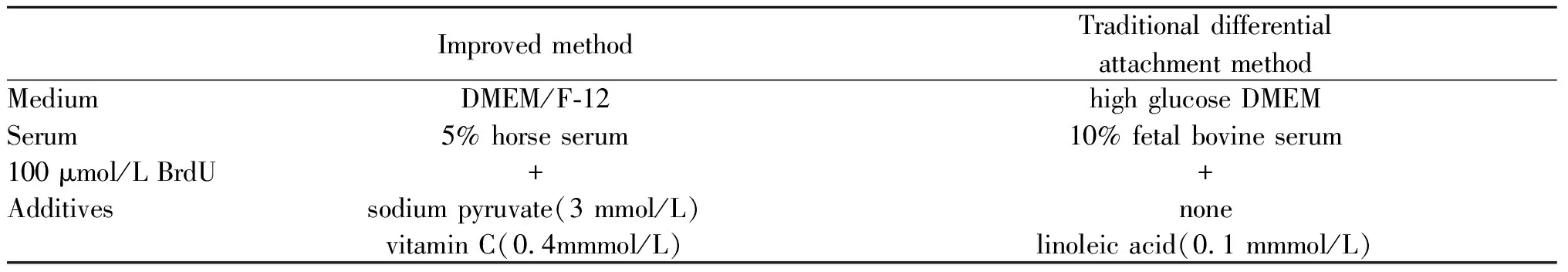
Tab. 1 Comparison of medium and components used in both methods
1.4 传统差速贴壁法纯化原代心肌细胞
同前述取心、消化完全后,4℃、1 000 r/min离心5 min并弃上清,细胞沉淀用含10% FBS的高糖DMEM 培养液重悬并制成单细胞悬液,接种于直径为10 cm的培养皿中。待贴壁 90 min 以去除成纤维细胞后,收集未贴壁的心肌细胞悬液,经台盼蓝染色计数并调整细胞至适宜密度,培养于 0.3% 明胶包被,含 10% FBS、 100 μmol/L 5-BrdU 的高糖 DMEM 培养基中。 次日更换为无5-BrdU、含 10% FBS 的普通高糖 DMEM 继续培养待后续操作。
1.5 心肌细胞得率和存活率检测
接种前,取10 μl心肌细胞悬液与等体积 0.4% 台盼蓝混匀后移至血球计数板。倒置显微镜下随机选取3个视野计数并判断细胞活力。未染色的为活细胞,蓝色的为死细胞。心肌细胞得率/心=细胞密度 × 细胞悬液总体积/新生乳鼠心脏个数,并统计三次实验的原代心肌细胞得率,以均数±标准差表示;细胞存活率 (%) = 活细胞数/总细胞数 × 100%。
1.6 心肌细胞形态学和搏动情况观察
倒置显微镜下观察心肌细胞,分别于接种后的24 h、48 h和72 h,逐日持续观察7 d。记录心肌细胞形态变化、生长状况和自发搏动频率。
1.7 心肌细胞纯度鉴定
原代心肌细胞接种于爬片小室内,次日更换培养基后继续培养24 h。取出细胞爬片,PBS冲洗两次,用4%多聚甲醛固定20 min,后用0.25% TritonX-100通透破膜20 min,PBS洗3次,5%脱脂牛奶室温封闭30 min。1∶500加入鼠抗心肌肌钙蛋白T抗体,湿盒4℃过夜。次日加入Alexa Fluor 568驴抗鼠荧光二抗,室温孵育1 h。用含 DAPI 抗荧光淬灭的封片剂封片,倒置荧光显微镜下拍照记录。心肌细胞纯度 (%) = 阳性细胞数 /DAPI 核染细胞总数 ×100% 。
1.8 统计学处理

2 结果
2.1 改良法获得新生乳鼠原代心肌细胞的形态学和搏动情况观察
显微镜观察显示,改良方法获得的心肌细胞生长良好,24 h 后几乎全部贴壁生长,细胞呈三角形、梭形或不规则形,个别细胞出现自主搏动,频率为10~30 beats/min不等。48 h后心肌细胞变长伸出伪足,部分细胞呈现同步搏动, 频率接近50~80 beats/min。72 h后心肌细胞成菊花样交织成网,自发搏动趋于同步,频率加快至80~100 beats/min;96 h后细胞聚集成簇,呈岛屿样,同步搏动频率在100~120 beats/min左右(图2)。一周内细胞生长状态良好,此后变长状态开始趋差,搏动次数减少。
2.2 两种方法获得新生乳鼠原代心肌细胞的得率和存活率的比较
比较传统差速贴壁法和改良法3次分离获得新生乳鼠原代心肌细胞的得率和存活率,结果显示:两种方法纯化原代心肌细胞的获得率相当((1.17±0.15)×106vs(1.21±0.22)×106,P>0.05);相比传统差速贴壁法,改良法获得的原代心肌细胞存活力较佳,但是没有统计学差异(93.3%±1.4%vs92.2%±0.7%,P>0.05)。
2.3 两种方法获得原代心肌细胞的纯度的比较
传统差速贴壁法和改良法获得的原代心肌细胞悬液,分别接种于细胞爬片小室,次日更换培养基后继续培养24 h,取出细胞爬片,用心肌特异性表达的心肌肌钙蛋白T(cTnT)抗体标记,Alexa Fluor 568 驴抗鼠荧光二抗染色,荧光显相差微镜观察发现,cTnT 被红染定位于胞浆(图3)。随机选取10个视野计数cTnT 阳性细胞数量(红色荧光标记)和总细胞数(蓝染 DAPI 细胞核数量),统计cTnT 阳性细胞比率,即新生乳鼠原代心肌细胞的纯度。结果显示,改良法和差速贴壁法获得的心肌细胞纯度都较佳,但是改良法分离培养的原代心肌细胞纯度明显更高(P<0.05,图3)。
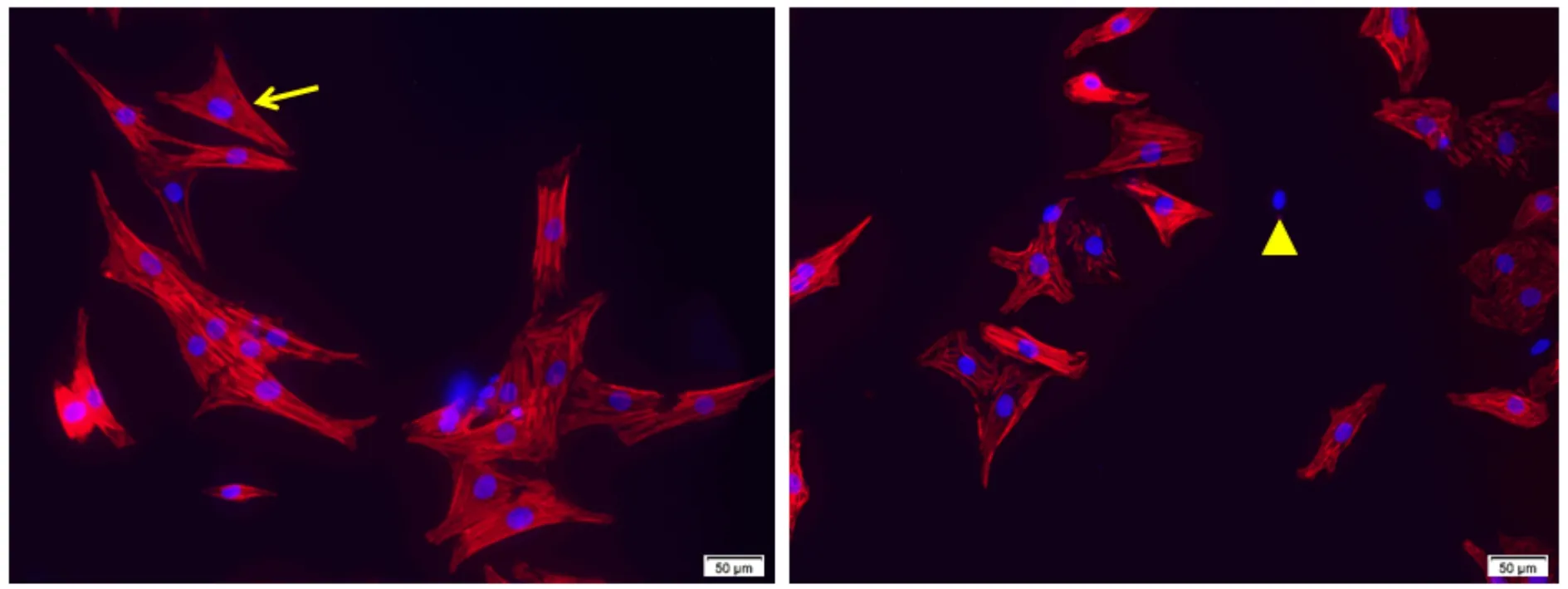
(left)Improved method attachment (right)Traditional differential method
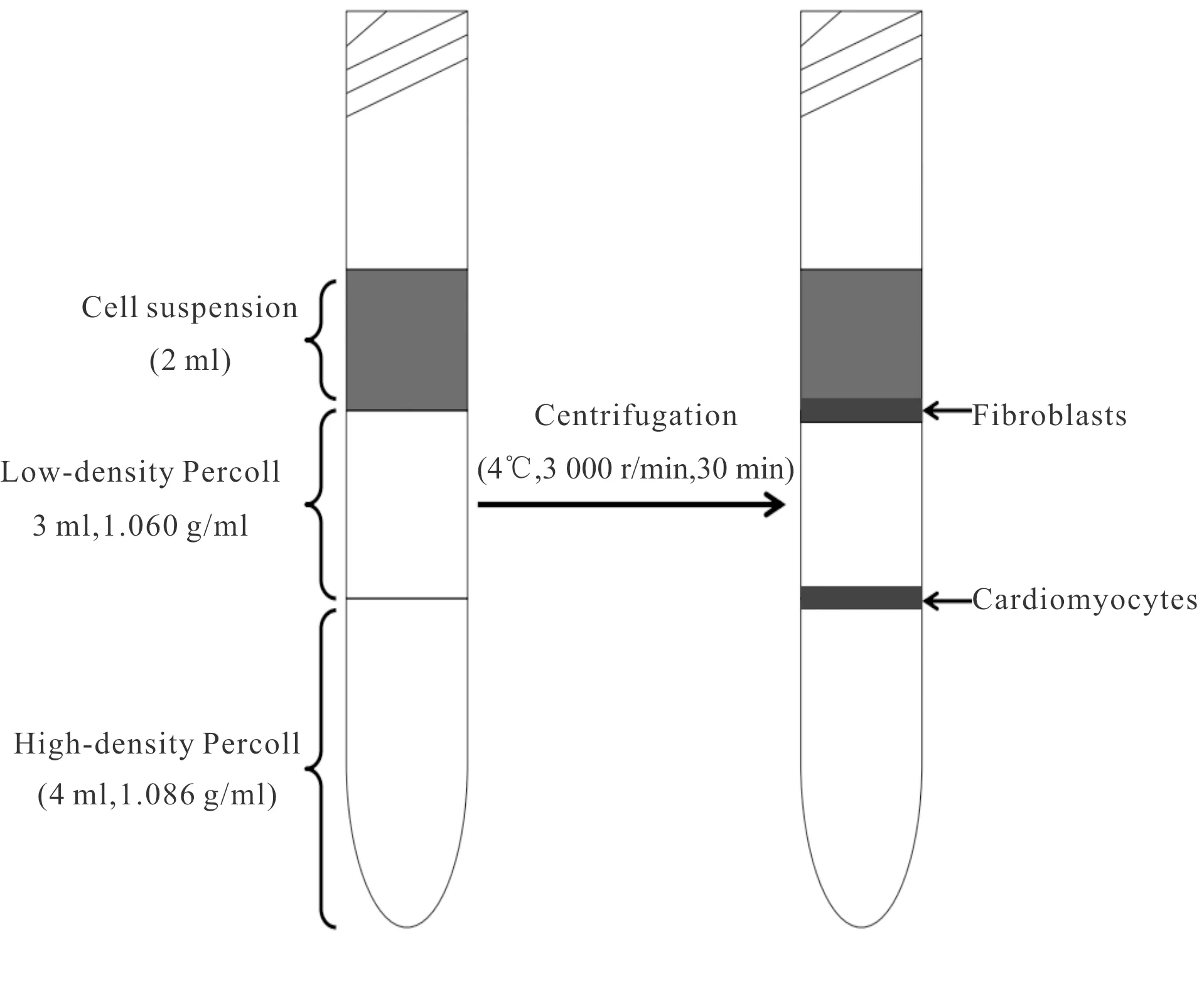
Fig. 1 Schematic diagram of primary cardiomyocytes isolated using Percoll density gradient centrifugation from neonatal rats
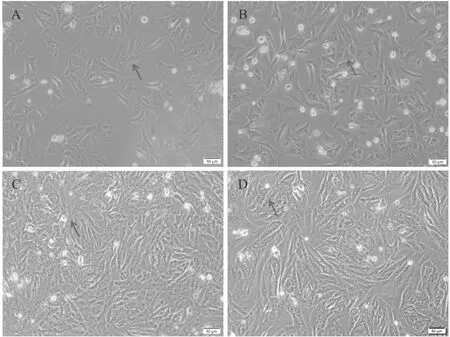
Fig. 2 Morphological images of neonatal rat primary cardiomyocytes at various culture time (Scale bar =50 μm)
2.4 两种方法获得新生乳鼠原代心肌细胞耗时的比较
传统差速贴壁法和改良法在获得原代心肌细胞的耗时比较,结果表明,从取心开始计时至获得可接种的心肌细胞悬液止,相比统差速贴壁法,改良法能在更短的时间内获得原代心肌细胞((3.1±0.4)hvs(4.3±0.3)h,P<0.01)。
3 讨论
原代心肌细胞培养是在分子水平研究心血管疾病发病机制和治疗手段的主要体外细胞模型,如何快速便捷分离得到存活率高、纯度好、结构功能保持完整的原代心肌细胞直接关系到实验进程和数据的可靠性。本课题组通过对以往培养方法的总结,探索了一种利用Percoll密度梯度离心结合5-溴脱氧尿嘧啶(5-BrdU)化学抑制+培养基优化分离纯化原代心肌细胞的改良方法。此法与Yang等[6]用超顺磁氧化铁粒子法(SIOP)纯化原代心肌细胞的获得率及纯度相当;其细胞得率和存活率与传统差速贴壁法相比没有统计学差异,但较之纯度更高,用时较短,且实验重复和稳定性好,是一种值得推广应用的原代心肌细胞分离方法,现将关键因素总结如下:
原代心肌细胞非常脆弱而且对坏境pH值相当敏感[7],最适pH在7.2~7.4之间,过酸或过碱都可能影响细胞的活力和生长状态,因此,保证合适的缓冲液和培养基pH显得尤为重要。目前实验室用于培养原代心肌细胞的培养基主要有高糖DMEM[8, 9]、M199[10]配合10%~20%的胎牛血清,而本实验中采用了DMEM/F-12完全培养基+5%的马血清,因为DMEM/F-12培养基中含有缓冲能力极强的4-羟乙基哌嗪乙磺酸,可较长时间内缓冲维持体外环境的稳态。而马血清可刺激细胞产生血清反应因子,诱导心肌前体细胞分化并促进肌小管形成,从而改善细胞形态提高细胞活力。本研究显示,相比传统差速贴壁法,改良法三次分离获得的心肌细胞活力更好,虽然结果并没有统计学差异。Sun等[11]研究发现,与胎牛血清培养相比,马血清组的原代心肌纯度更高,这可能也与成纤维细胞在马血清培养基中需要更长的倍增和融合时间有关[12]。
另外,在本次实验的培养基中添加了维生素C、丙酮酸钠和亚油酸。维生素C作为抗氧化剂,可保护心肌细胞分离过程中缺血缺氧带来的氧化损伤,并为原代心肌细胞的生长提供必需的营养支持。缺血期间无氧酵解的增加使乳酸及末端糖基化代谢终产物等有害物质大量堆积,添加丙酮酸钠可激活丙酮酸脱氢酶使糖代谢向有氧氧化方向进展[13]。而亚油酸是心磷脂的主要成分,可显著改善缺血乏氧对心肌细胞线粒体氧化磷酸化的损伤[14]。
消化酶的选择和消化时间控制是影响原代心肌细胞存活率的关键。传统的消化分离多采用胰蛋白酶,作用极强,其不仅可分解组织间蛋白亦对细胞膜蛋白甚至胞内的微管微丝均有很强的破坏作用,容易造成心肌细胞损伤,影响细胞活力和自主搏动[15];而 II 型胶原酶特异性水解心肌细胞间质中的胶原纤维,作用缓和,对心肌细胞几乎没有损伤。因此,在本实验中采用了0.12%的 II 型胶原酶而非胰蛋白酶作为消化液,尽可能减少对心肌细胞的损害。在消化过程中采取37℃摇床控时多次消化模式,摇床可使织块与消化液充分接触,时间到达15 min后将已消化下来的细胞悬液先吸出终止消化,防止酶的过度消化对细胞的损伤;通过控时及多次消化以获得数量足够且保证活力的原代心肌细胞,结果显示,此方法获得的原代心肌细胞存活率为(93.3±1.4)%。同时,24 h便可见到部分细胞自发搏动,此后几天,细胞自发搏动频率增加且趋于同步化,说明细胞结构损伤小,“合胞体”特性保存完整。
纯化多采用差速贴壁,即利用成纤维细胞较心肌细胞更早更易贴壁而将两者分离开来。但是成纤维细胞的贴壁速度和时间比较难掌握,受组织消化程度影响大,有时甚至需要二次贴壁来提高心肌细胞纯度[16],耗时费力。本研究亦显示,从取心开始计算至获得可接种的原代心肌细胞止,传统差速贴壁法较改良法所需时间明显增加。而若有过多成纤维细胞残存,因其增殖旺盛将对心肌细胞产生密度抑制,更不益于后者生长。改良法利用心肌细胞比非心肌细胞(主要为成纤维、平滑肌和内皮细胞等)比重大,密度梯度离心后各类细胞出现在不同的细胞层带将之分离。Percoll 是一种扩散系数低、密度梯度稳定、直径在15~30 nm的乙烯吡咯烷酮硅胶颗粒混悬液,对细胞无毒害,已被广泛用于中性粒细胞[17]、卫星细胞[18]、神经突触小体[19]等的分离制备。在本实验中,Percoll密度梯度离心得到的上层细胞带(低密度Percoll液上面)主要是成纤维细胞,少量内皮细胞和心肌细胞;低密度Percoll液部分主要含有各种干细胞、不成熟的心肌细胞和内皮细胞、平滑肌细胞;下层细胞带(低密度与高密度Percoll液之间)即主要为原代心肌细胞。为进一步减少成纤维细胞比例保证心肌细胞纯度,在Percoll 密度梯度离心纯化到心肌细胞后,将其培养在含100 μmol/L 5-BrdU的培养基中,利用BrdU替代胸腺嘧啶核苷酸掺入DNA中,阻止成纤维细胞增殖生长而进一步纯化心肌细胞的。结果显示,较之传统差速贴壁法,Percoll 密度梯度离心结合化学抑制分离纯化得到的原代心肌细胞纯度明显增高(P<0.05)。
原代心肌细胞在分离纯化过程中极易受到各种理化因素的损伤,但自我修复能力有限,无疑增加了贴壁难度。因此,不少研究者尝试在铺板前用纤连蛋白、层粘连蛋白或明胶等[20]包被培养皿促进心肌细胞贴壁。本实验中采用猪皮胶原纤维来源的 0.3%的明胶预处理培养板,细胞贴壁良好。
综上,相比传统差速贴壁法, Percoll 密度梯度离心+5-BrdU化学抑制结合培养基改良,分离培养新生大鼠原代心肌细胞的方法简便、省时,心肌细胞纯度高、活力好,结构和功能保存完整,完全可满足实验的需求,是一种快速、便捷、重复性好的原代心肌细胞分离培养方法,为今后心血管疾病基础研究和药物开发提供了理想的体外模型。
