低氧联合LPS刺激对星形胶质细胞中炎性因子和BNIP3表达的影响*
2021-12-08丁利平朱玲玲
丁利平, 韩 莹, 成 祥, 赵 彤, 朱玲玲,3△, 廖 红△
(1. 中国药科大学药物科学研究院, 南京 210009; 2. 军事医学研究院军事认知与脑科学研究所, 北京 100850; 3. 江苏省神经再生协同创新中心, 南京 210009)
高原环境由于缺氧可导致平原人进入高原地区,不能适应高原环境,发生高原地区的特有疾病,即急性高原病[1]。急性高原病严重时可进一步发展成急性脑水肿,进而威胁生命。近年来越来越多的研究显示炎症在加重高原低氧脑水肿和肺水肿中发挥着重要作用。研究发现给予小鼠脂多糖(lipopolysaccharide,LPS)处理,随后进行高原低氧暴露,可导致小鼠发生脑水肿[2]。通常,急进海拔 4 000 m以上地区高原脑水肿发生率明显增加,在海拔4 000 m至5 000 m地区的发生率是0.5%~ 1.0%[3]。而据报道发生胃肠道或呼吸道感染后进入高原地区的人群更易患急性高山病[4]。血脑屏障的破坏被认为是引起脑水肿的重要因素。星形胶质细胞的终足结构是血脑屏障的组成成分。LPS是多数革兰氏阴性菌细胞壁的成分,由类脂A,核心寡糖和O-抗原组成[5]。LPS可以刺激星形胶质细胞,通过细胞膜上的Toll样受体,诱导炎症反应[6]。然而,低氧调节脑炎症反应的分子机制尚待阐明。
当机体处于低氧环境时,通过上调低氧诱导因子(hypoxia-inducible factor,HIF)的表达,对低氧做出适应性反应。BNIP3(Bcl-2/E1B-19K-interacting protein 3)属于Bcl-2家族中BH3-only蛋白,主要位于线粒体外膜上,是低氧诱导因子-1ɑ(hypoxia-inducible factor-1α,HIF-1α)的靶基因之一。低氧时,HIF-1α诱导BNIP3的表达。BNIP3参与许多疾病的病理过程,如癌症和缺血性疾病[7]。低氧能调节免疫细胞的功能,促进炎症的发生发展[8]。但是,目前关于BNIP3在星型胶质细胞炎症反应中的表达和作用的研究还未见报道。本研究利用体外培养的星形胶质细胞,观察在低氧联合LPS刺激时,星形胶质细胞中BNIP3和炎性因子的表达规律。旨在为高原脑损伤的病理机制提供一些新的认识。
1 材料与方法
1.1 主要试剂和仪器
DMEM/F12培养基(Gibco公司),胰酶(Hyclone公司),胎牛血清(Ausbian公司),BNIP3抗体(Abcam公司),Hif-1α抗体(Gentex公司),β-actin抗体和LPS (Sigma公司),小鼠ELISA炎症细胞因子检测试剂盒(欣博盛公司),反转录试剂盒(TAKARA公司),SYBR Green试剂(Roche公司),ECL发光液(Bio-Rad公司),荧光实时定量PCR仪(Roche公司)。
1.2 原代星形胶质细胞的培养
用75%乙醇消毒出生24 h内的C57乳鼠(由斯贝福公司提供),断头,分离脑组织,在显微镜下去除脑膜和血管,分离出皮层,剪碎至约1 mm大小,加入0.25%胰酶消化,用含胎牛血清的培养基终止消化,离心,弃上清,重悬,滤网过滤后,接种到T25细胞培养瓶,置于37℃,5% CO2培养箱中培养。次日换液。以后每隔 3 d 换 1 次液,培养7 d,观察到大多数的细胞融合成片,细胞折光性较差。将培养瓶置于摇床上,180 r/min,12 h,除去小胶质细胞。0.25%胰酶消化,离心,重悬,接种,将细胞分组,进行实验。
1.3 原代神经元的培养
取孕期 18 d C57小鼠(由斯贝福公司提供),麻醉后,打开腹腔,分离胚胎置于分离解剖液中。分离皮层,加入0.25%胰酶消化。用10%含胎牛血清的DMEM /F12培养基终止消化,计数,按 1×106cells/cm2细胞接种到多聚赖氨酸预先包被的培养皿中,于37℃、5% CO2培养箱中培养,24 h后换 Neurobasal /B27 培养基,每隔3 d 换1/2液。培养7 d后,观察细胞形态,用于实验。
1.4 实验分组
实验分为:常氧组,LPS组,低氧组和LPS+低氧组。LPS处理后,低氧组和LPS+低氧组放入低压低氧细胞孵箱, LPS组和常氧组放入正常的细胞孵箱。LPS浓度:100 ng/ml,氧气浓度为0.3%。处理时间如表2、3、4和5注释所示。每组设置3个复孔。
1.5 Western blot法检测原代神经元和星形胶质细胞BNIP3蛋白表达
用PBS漂洗细胞,加入含蛋白酶抑制剂的RIPA 裂解液,冰上裂解,离心2 700 r/min,4 min,提取总蛋白质。用BCA法测定蛋白质浓度。用SDS-PAGE电泳分离蛋白。120 V,90 min将蛋白质转移到PVDF膜上,用5%脱脂奶粉室温封闭1 h。裁剪目的蛋白所在的条带。将目的条带和相应的一抗放在抗体盒中,4℃孵育过夜。使用的抗体有抗BNIP3 抗体(1∶1 000),抗HIF-1α抗体(1∶1 000)和抗β-actin 抗体 (1∶10 000)。过夜孵育后,用TBST洗涤3次,每次10 min。用相应的二抗(1∶10 000) 室温孵育1 h。用TBST洗涤3次,每次10 min。ECL 法进行显色,β-actin作为内参蛋白。
1.6 RT-PCR检测原代星形胶质细胞炎症细胞因子TNF-α,IL-1β和IL-6 mRNA表达
收集上述各组处理后的细胞,用Trizol法提取细胞总RNA,紫外分光光度计测定RNA浓度,其OD260/280在1.8~2.2。根据TAKARA反转录试剂盒,将RNA反转录成cDNA。TNF-α,IL-1β和IL-6的引物序列(由上海生工生物工程公司合成)见表1。RT-PCR反应条件:95℃ 10 min,95℃15 s、56℃ 20 s、72℃ 30 s共循环39次。以β-actin为内参,采用 2-ΔΔCT法计算TNF-α,IL-1β和IL-6 mRNA相对表达水平。
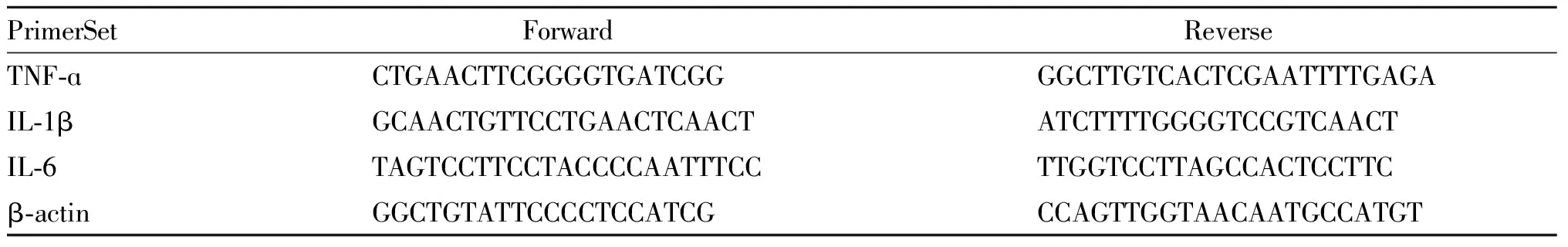
Tab. 1 Gene primer sequences of TNF-α, IL-1β, IL-6 and β-actin
1.7 ELISA检测原代星形胶质细胞炎症细胞因子TNF-α、IL-1β和IL-6 mRNA分泌变化
收集上述各组细胞上清液,用ELISA法检测上清中TNF-ɑ、IL-1β和IL-6的水平。具体方法参照试剂盒操作说明。使用酶标仪读取数据进行统计分析。
1.8 统计学处理
2 结果
2.1 低氧或联合LPS处理对星形胶质细胞中炎症因子表达的影响
双因素方差分析结果显示,LPS刺激对星形胶质细胞中炎症细胞因子TNF-α,IL-1β和IL-6mRNA的表达均影响显著(P<0.01);低氧处理对星形胶质细胞中炎症细胞因子TNF-α的表达影响不显著(P>0.05),对IL-1β和IL-6mRNA的表达影响显著(P<0.01)。在对IL-1β和IL-6mRNA的表达方面,LPS刺激和低氧处理两个因素交互作用明显(P<0.05,P<0.01)。组间两两分析结果如表2所示:与常氧组比较,LPS组和LPS+低氧组的炎症因子TNF-ɑ、IL-1β和IL-6 mRNA水平升高,差异具有统计学意义(P<0.01);与LPS组比较,LPS+低氧组炎症因子IL-1β和IL-6 mRNA水平进一步升高,差异具有统计学意义(P<0.05,P<0.01)。结果表明低氧能够增强LPS刺激后星形胶质细胞的炎症反应。
Tab. 2 The expressions of TNF-α, IL-1β and IL-6 mRNA in primary astrocytes n=3)
2.2 低氧或联合LPS对星形胶质细胞中炎症因子分泌的影响
双因素方差分析结果显示,LPS刺激对星形胶质细胞中炎症细胞因子TNF-α,和IL-6的分泌变化影响显著(P<0.01);对IL-1β的分泌变化影响不显著(P>0.05)低氧处理对星形胶质细胞中炎症细胞因子TNF-α,IL-1β和IL-6的分泌变化影响均不显著(P>0.05)。在对TNF-α,IL-1β和IL-6分泌变化方面,LPS刺激和低氧处理两个因素交互作用不明显(P>0.05)。组间两两比较结果如表3所示:在星形胶质细胞中,与常氧组比较,LPS组和LPS+低氧组的炎症因子TNF-α和IL-6分泌水平升高,差异有统计学意义(P<0.01),IL-1β分泌没有变化,低氧组TNF-α,IL-1β和IL-6分泌水平均没有变化,与LPS组比较,LPS+低氧组炎症因子TNF-α,IL-1β和IL-6分泌水平均没有明显变化。实验结果提示LPS刺激能使星形胶质细胞分泌的TNF-α和IL-6增加,但LPS和低氧联合作用未能使其增加更明显。
Tab. 3 The levels of TNF-α, IL-1β and IL-6 inthe medium of primary cultured astrocytes (pg/ml, n=3)
2.3 低氧或联合LPS对体外培养的神经元和星形胶质细胞中BNIP3表达的影响
双因素方差分析结果显示,LPS刺激对星形胶质细胞和神经元中BNIP3的表达影响不显著(P> 0.05)。低氧处理对星形胶质细胞和神经元中BNIP3的表达均影响显著(P<0.01);两个因素间的交互作用不明显(P>0.05)。组间两两比较结果如表4所示:在星形胶质细胞中,与常氧组比较,LPS组BNIP3的表达没有变化,低氧组和LPS+低氧组BNIP3的表达明显增加(P<0.01);在神经元中,与常氧组比较,LPS组BNIP3的表达没有变化,低氧组和LPS+低氧组BNIP3的表达增加,差异有统计学意义(P<0.05,P<0.01);与神经元的低氧组比较,星形胶质细胞的低氧组BNIP3的表达显著增加(P<0.01,图1,表4)。结果说明星形胶质细胞中BNIP3对低氧反应更敏感。
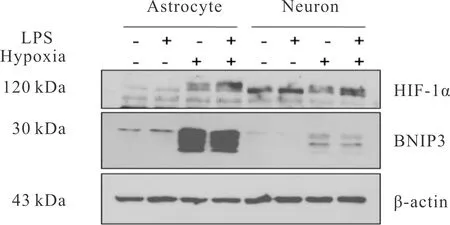
Fig. 1 Expressions of BNIP3 in primary astrocytes and neurons
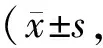
Tab. 4 Relative expression of BNIP3 in primary astrocytes and neurons n=3)
2.4 低氧或联合LPS对星形胶质细胞中BNIP3表达的影响
双因素方差分析结果显示,LPS刺激对6 h和12 h时间点星形胶质细胞中BNIP3的表达影响显著(P<0.01),对24 h时间点星形胶质细胞中BNIP3的表达影响不显著(P>0.05);低氧处理对3个时间点星形胶质细胞中BNIP3的表达影响均显著(P<0.01);两个因素对6 h和12 h时间点星形胶质细胞中BNIP3的表达影响的交互作用明显(P< 0.01),对24 h时间点星形胶质细胞中BNIP3的表达交互作用不明显(P>0.05)。组间两两比较结果如表5所示:在相同时间点,与常氧组比较,LPS组BNIP3的表达没有变化,低氧组和LPS+低氧组BNIP3的表达增加,差异有统计学意义(P<0.05,P<0.01);与低氧组比较,6 h和12 h时间点LPS+低氧组BNIP3的表达显著增加(P<0.01,图2,表5)。上述结果说明炎症能促进低氧条件下原代星形胶质细胞中BNIP3的表达,提示BNIP3在星形胶质细胞的炎性反应中可能具有一定的调节作用。

Fig. 2 Dynamic change of BNIP3 expression in primary astrocytes
3 讨论
目前关于高原脑水肿的具体病理机制尚待阐明。研究发现,腹腔注射 LPS联合高原低氧暴露能够加重脑内炎症反应和细胞的损伤,加重脑水肿的发生和发展[2]。据报道脑组织缺血缺氧后星形胶质细胞被活化[9]。大鼠进行低氧暴露(8 000 m,8 h)后,星形胶质足突出现肿胀,脑组织出现水肿[10]。上述研究表明星形胶质细胞在脑水肿的发生发展中起着重要作用。当下关于低氧下星形胶质细胞炎症反应的调控机制并不清楚。白瑜珊等研究发现低氧增强巨噬细胞中脂多糖诱导的IL-1β表达[11]。Gessi S等发现LPS刺激联合低氧(1%)作用后,星形胶质细胞中HIF-1α的蛋白表达增加,其下游的基因iNOS和AB2受体在复合作用下增加明显[12]。与本文的研究结果相符,LPS和低氧联合作用使星形胶质细胞的炎症因子IL-1β和IL-6表达明显增加。当机体处于低氧环境时,低氧诱导因子-1(hif-1)的降解被抑制,hif-1与BNIP3启动子上的低氧反应原件(hypoxic responsive element,HRE)结合,激活BNIP3的转录。BNIP3作为Bcl-2家族的一员,主要包含以下几个功能结构域:(1)PEST结构域,参与BNIP3的降解;(2)BH3结构域,参与BNIP3介导的caspase凋亡途径和自噬;(3)跨膜结构域和羧基端结构域,跨膜结构域对于BNIP3定位至线粒体外膜和发挥促凋亡作用是必不可少的,跨膜结构域的缺失不能诱导细胞死亡[13]。BNIP3 有着双重作用,既可以促进细胞凋亡或坏死,也可以介导线粒体自噬,促进细胞存活。

Tab. 5 Relative expression of BNIP3 in primary astrocytes at different time n=3)
目前关于低氧下星形胶质细胞中BNIP3的表达的研究报道较少。TorronterasR等研究发现在1%O2处理6 h后,人的星形胶质细胞中HIF-1ɑ稳定表达,从而其下游靶基因BNIP3表达增加,促进细胞存活和发挥神经保护作用,但具体的作用机制不明[14]。而何芳等实验表明在氧糖剥夺/复氧模型中,胶质细胞系C6细胞的BNIP3表达增加,介导细胞凋亡[15]。本研究通过体外原代培养神经元和星型胶质细胞,发现BNIP3在这两种细胞中都有表达,且低氧后细胞中BNIP3表达均增加,与文献报道一致。黄广海等实验发现在脑缺血3 h和9 h时,BNIP3表达升高,线粒体自噬被激活,随着缺血时间延长至24 h,BNIP3表达降低,线粒体自噬被抑制,脑梗死体积增大,说明在脑缺血早期,BNIP3可能通过线粒体自噬起到保护作用[16]。BNIP3可以通caspase凋亡途径,线粒体膜电位的丢失,线粒体膜通透转换孔的开放,细胞色素C的释放等方式介导细胞死亡[13]。线粒体自噬是指以自噬的方式清除细胞内损伤的或不需要的线粒体,维持线粒体的动态平衡。借助结构中LC3 相互作用结构域(LC3-interaction region,LIR),BNIP3与自噬体外膜上的微管相关蛋白 1-轻链 3(microtubule- associated protein1 light chain 3,LC3)结合,组成线粒体和自噬体的复合物,再与溶酶体结合,线粒体被降解[17]。BNIP3也可以与 Bcl-2 竞争性结合,释放出Beclin-1,引起线粒体自噬。 Hong等研究发现黄体酮通过提高星形胶质细胞自噬水平抑制Aβ诱导的炎症[18]。而Periyasamy P等研究表明可卡因通过诱导自噬,激活人星形胶质细胞[19]。LPS刺激(1 μg/ml)24 h也能引起星形胶质细胞过度自噬,介导细胞死亡[20]。上述结果提示在缺血缺氧或氧糖剥夺模型中, BNIP3表达的升高可以直接诱导细胞凋亡,也可以激活自噬,介导细胞存活或死亡作用。而在不同的处理条件下,星形胶质细胞的自噬对细胞的作用也不尽相同。该研究发现低氧后BNIP3的表达在星形胶质细胞中增加更加明显;LPS联合低氧刺激后星形胶质细胞中BNIP3的表达较单纯低氧组明显增加。该结果提示BNIP3在星形胶质细胞的炎性反应中可能具有一定的调节作用。
在本实验中,我们发现LPS刺激联合低氧作用较单一处理使星形胶质细胞的BNIP3表达进一步增加,说明LPS可能参与调控低氧下BNIP3的表达。此外,本实验发现低氧联合LPS刺激联合低氧增强星形胶质细胞的炎症反应。该结果表明BNIP3可能参与星形胶质细胞炎症反应的调控。接下来我们将研究BNIP3的表达变化对星形胶质细胞的炎症反应的作用及其可能机制。通过敲低或过表达星形胶质细胞中的BNIP3,观察在低氧联合LPS刺激条件下星形胶质细胞的炎症反应,存活和线粒体自噬变化,发现BNIP3调节星形胶质细胞炎症反应可能的机制,为星形胶质细胞炎症反应的调控机制,提供一些新的认识。
