Ⅱ型肺泡上皮细胞间质转分化中的Notch-1/Twist-1信号通路机制*
2021-12-08何晓伟李先伟
汤 娟, 柯 洁, 付 裕, 何晓伟, 李先伟△
(1.皖南医学院药学院病理学教研室, 2.皖南医学院医学影像学院, 3.皖南医学院临床医学院, 安徽 芜湖 241002)
肺纤维化(pulmonary fibrosis, PF)是一种呼吸系统罕见疾病,其特征是肺结缔组织过度增生,导致肺间隔增厚、肺部瘢痕形成、进行性严重呼吸困难等[1]。上皮间质转分化(epithelial-mesenchymal transition, EMT)是上皮细胞逐渐向间充质样细胞转化、丧失上皮细胞功能特性而获得间质细胞(如肌成纤维细胞)特性的过程,在PF的发病过程中起着重要作用[2,3],但其具体发生机制目前还不是很清楚。
近来的研究发现,转化生长因子-β1(transforming growth factor-β1,TGF-β1)介导的Notch-1信号通路与了肺泡上皮细胞EMT进程,在PF的发生发展中起着重要的作用[4]。我们前期的研究也证实了Notch-1参与了肺泡上皮细胞EMT的发生[5]。但Notch-1是如何影响肺泡上皮细胞EMT进程的,目前不是很清楚。Twist-1是一种进化上高度保守的碱性螺旋-环-螺旋转录因子超家族成员之一,具有调控胚胎发育、诱导细胞发生EMT等功能[6]。研究发现,在特发性肺纤维化病人肺组织中Twist-1的表达明显升高[7],而进一步研究表明Twist-1介导的肺泡上皮细胞EMT参与了肺纤维化的发生与发展[8]。而最新研究发现Notch-1/Twist-1信号通路参与了直肠癌细胞的EMT进程[9]。基于以上研究背景,本研究以肺纤维化大鼠和Ⅱ型肺泡上皮细胞为研究对象,以Notch-1/Twist-1信号通路为突破口,探讨肺泡上皮细胞EMT的发生机制,进而为PF的发病机制提供理论依据。
1 材料与方法
1.1 动物与细胞
SPF级雄性Sprague-Dawley(SD)大鼠,体质量(180±20)g,购于南京青龙山动物养殖场(许可证号:SCXK(苏)2018-0012)。大鼠Ⅱ型肺泡上皮细胞购于北京鸿跃创新科技有限公司(货号:CP-R003)。
1.2 实验试剂
注射用盐酸博莱霉素(国药准字H20055883,浙江海正药业股份有限公司)。转化生长因子-β1(TGF-β1)购于美国R&D Systems公司(编号7754-BH)。改良 Masson 三色染色液(北京博奥森生物技术有限公司,产品编号S0075)。PrimeScriptTMRT reagent Kit(编号RR047A)和TB Green® Premix Ex TaqTMII(编号RR820A,宝日医生物技术(北京)有限公司)。兔抗鼠TGF-β1抗体(编号bs-0086R)、兔抗鼠Notch-1抗体(编号bs-1335R)、兔抗鼠(glyceraldehyde 3 phosphate dehydrogenase, GAPDH)抗体(编号bs-10900R)、小鼠抗大鼠I型胶原(collagen I)抗体(编号bsm-33400M)及小鼠抗大鼠III型胶原(collagen III)抗体(编号bsm-33129M)购于北京博奥森生物技术有限公司。小鼠抗大鼠E-钙粘蛋白(E-Cadherin)抗体(编号 sc-8426)、大鼠抗大鼠紧密连接蛋白-1(zonula occludens-1, ZO-1)抗体(编号sc-33725)、小鼠抗大鼠N-钙粘蛋白(N-Cadherin)抗体(编号sc-59987)、小鼠抗大鼠波形蛋白(Vimentin)抗体(编号sc-6260)及小鼠抗大鼠Twist -1抗体(编号sc-81417)购于美国Santa Cruz公司 。兔抗鼠Notch-1胞内域(Notch1 intracellular domain, NICD)抗体(编号ab83232)和兔抗鼠Hes-1抗体(编号ab108937)购于美国Abcam公司。
1.3 实验设计
1.3.1 动物实验 SD大鼠30只随机分为对照(Control, CON)组、博莱霉素(Bleomycin, BLM)组,每组例数n=15。按BLM(7 500 U/kg)剂量分两次、中间间隔30 min气管注射制备肺纤维化大鼠模型。CON组气管滴注等量的灭菌生理盐水,其余方法与BLM组相同。造模后28 d处死动物,观察相关指标。
1.3.2 细胞实验 实验设Control组、TGF-β1(5 ng/ml)组、TGF-β1+ Notch1 siRNA阴性对照组(NC siRNA, 100 pmol/L)和TGF-β1+Notch1 siRNA干扰组(Notch1 siRNA, 100 pmol/L)。Ⅱ型肺泡上皮细胞(RLE-6TN)计数后接种于6孔板。细胞先用TGF-β1处理24 h,然后加入NC siRNA(100 pmol/L) 或Notch1 siRNA(100 pmol/L)和lipofectamine 3000(5 μl),再加入TGF-β1共处理48 h。每组设9个复孔。
1.4 肺组织形态学观察和胶原沉积分析
肺组织用10%福尔马林灌流后,取左肺下叶,根据参考文献[10]方法进行HE及Masson染色,光镜下观察肺组织病理学变化及胶原沉积情况。
1.5 肺组织TGF-β1免疫组化染色
肺组织用10%福尔马林灌流后,取左肺下叶,根据SABC-AP(链酶亲和素-碱性磷酸酶)免疫组化法检测肺组织TGF-β1蛋白表达,TGF-β1一抗浓度为1∶800,相应二抗浓度为1∶2 000。肺组织TGF-β1阳性表达呈黄至棕黄色颗粒。
1.6 大鼠肺组织和Ⅱ型肺泡上皮细胞collagen I、collagen III、ZO-1、E-cadherin、Vimentin及N-cadherin基因表达分析
无酶环境下提取左肺上叶和细胞总RNA,测定浓度后将其逆转录成cDNA。以2 μl cDNA为模板,20 μl反应体系,用StepOnePlusTMReal-Time PCR System进行qPCR扩增。PCR反应条件参照我们前期的研究结果[11]。以GAPDH为内参,统计各组ΔΔCt值,计算相应RQ值并进行分析。引物列表如下(表1)。

Tab. 1 Nucleotide sequences of primers for real-time PCR amplification
1.7 大鼠肺组织和Ⅱ型肺泡上皮细胞相关蛋白表达分析
低温条件下提取右肺组织及细胞总蛋白,BCA法测定蛋白浓度。Western blot法检测相关蛋白表达,具体方法详见我们前期的研究结果[11]。相关蛋白一抗浓度分别为N-cadherin(1∶500)、Vimentin(1∶500)、ZO-1(1∶500)、E-cadherin(1∶500)、collagen I(1∶1 000)、collagen III(1∶500)、Notch-1(1∶1 000)、NICD(1∶1 000)、Hes-1(1∶500)和Twist-1(1∶500)及GAPDH(1∶2 000),相应二抗浓度(1∶2 000~1∶5 000)。用Image J 1.43软件进行灰度值测量并分析蛋白表达情况。
1.8 统计学处理
2 结果
2.1 大鼠肺组织形态学变化
HE染色镜下观察发现Control组肺组织支气管、细支气管和肺泡结构正常,未见炎症反应,而Bleomycin组肺泡结构出现萎缩和塌陷并发生融合,肺泡壁增宽增厚明显,且可见大量炎性细胞的浸润及分泌物,纤维化显著。上述结果表明Bleomycin诱导的肺纤维化大鼠模型成功(图1)。

Fig. 1 Rat lung tissues paraffin sections were stained with HE staining (×200)
2.2 大鼠肺组织TGF-β1表达状况观察
Westernblot和免疫组化检测发现,Bleomycin组TGF-β1蛋白表达明显上调(P<0.01,图2,图3)。提示肺纤维化大鼠肺组织中TGF-β1的表达明显升高。
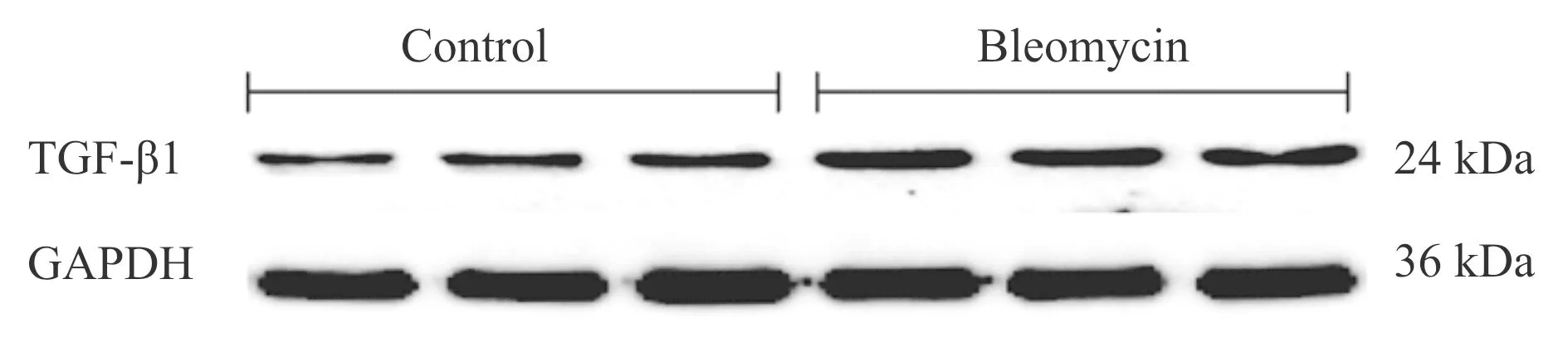
Fig. 2 Representative bands of TGF-β1 expression in rat lung tissue

Fig. 3 Representative micrographs of the immunostaining for TGF-β1 in rat lung tissue (Arrows indicate collagen I immunostaining positive ×200)
2.3 大鼠肺组织及Ⅱ型肺泡上皮细胞Notch-1、NICD、Hes-1及Twist-1蛋白表达情况观察
动物实验发现BLM能够使肺组织中Notch-1、NICD、Hes-1及Twist-1蛋白表达明显升高(P< 0.01,图4,表2)。细胞实验结果显示,TGF-β1能够明显上调Ⅱ型肺泡上皮细胞Notch-1、NICD、Hes-1及Twist-1的蛋白表达(P<0.01)。但与TGF-β1组相比,Notch-1 siRNA组Notch-1、NICD、Hes-1及Twist-1的蛋白表达明显降低(P<0.01),而Notch-1 siRNA阴性对照组无此作用(图5,表3)。
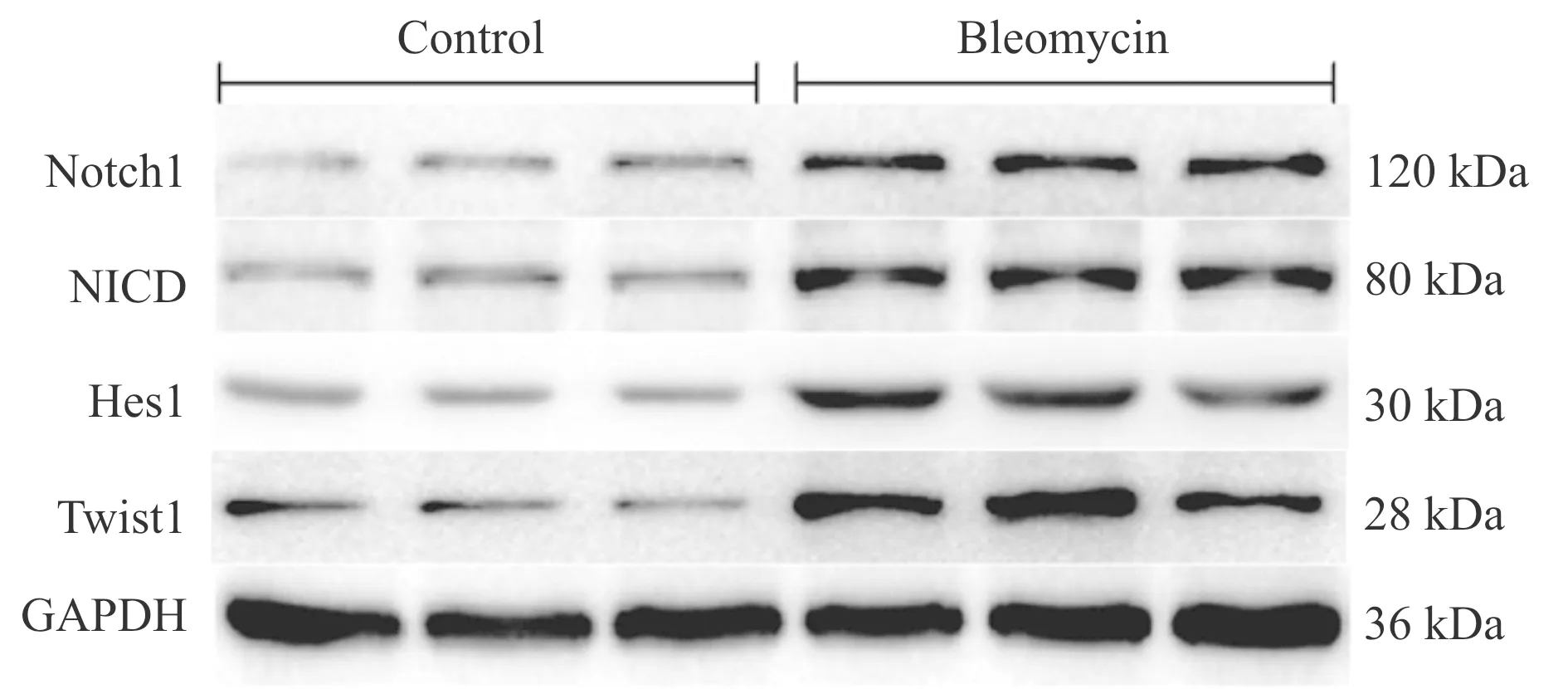
Fig. 4 Representative bands of Notch1, NICD, Hes1 and Twist1 expression in rat lung tissue
Tab. 2 Western blot analyses for Notch1, NICD, Hes1 and Twist1 expressions in lung tissues n=8)
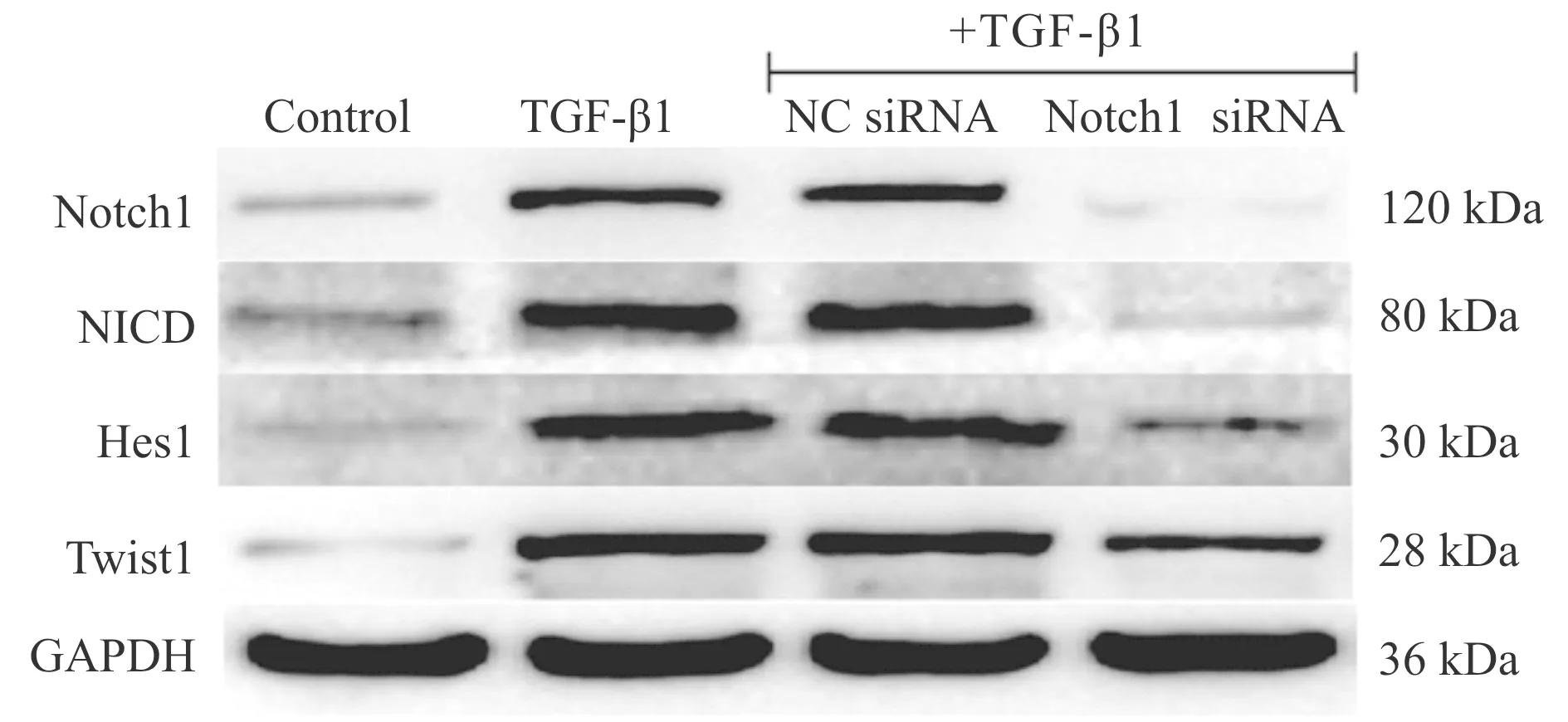
Fig. 5 Representative bands of Notch1, NICD, Hes1 and Twist1 expression in cultured type II alveolar epithelial cells
2.4 大鼠肺组织及Ⅱ型肺泡上皮细胞EMT相关标志物表达情况观察
动物实验发现BLM能够使肺组织上皮细胞标志物ZO-1和E-cadherin mRNA及蛋白表达水平明显降低而使间质细胞标志物N-cadherin和Vimentin mRNA及蛋白表达水平明显升高(P<0.01vsCON,图6,表4)。细胞实验结果显示,TGF-β1能够明显下调Ⅱ型肺泡上皮细胞ZO-1和E-cadherin mRNA及蛋白表达、显著上调Vimentin和N-cadherin mRNA及蛋白表达(P<0.01vscontrol)。但与TGF-β1组相比,Notch-1 siRNA组ZO-1和E-cadherin mRNA及蛋白表达水平明显升高而N-cadherin和Vimentin mRNA及蛋白表达水平明显降低(P<0.01vsTGF-β1),而Notch-1 siRNA阴性对照组无此作用(图7,表5,表6)。
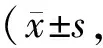
Tab. 3 Effects of Notch-1 siRNA on TGF-β1-induced expressions of Notch1, NICD, Hes1 and Twist1 in cultured type II alveolar epithelial cells n=9)
2.5 大鼠肺组织及Ⅱ型肺泡上皮细胞I 型胶原和III型胶原表达情况观察
改良Masson染色镜下观察发现CON组蓝染的胶原纤维较少,而BLM组蓝染的胶原纤维明显增多。经qPCR和Western blot检测发现,BLC组I 型胶原和III型胶原mRNA及蛋白表达明显增加(P<0.01vsCON,图8,图9,表7)。细胞实验结果显示,TGF-β1能够明显上调Ⅱ型肺泡上皮细胞I 型胶原和III型胶原mRNA及蛋白表达(P<0.01vscontrol)。但与TGF-β1组相比,Notch-1 siRNA组I 型胶原和III型胶原mRNA及蛋白表达水平明显降低(P<0.01vsTGF-β1),而Notch-1 siRNA阴性对照组无此作用(图10,表8)。
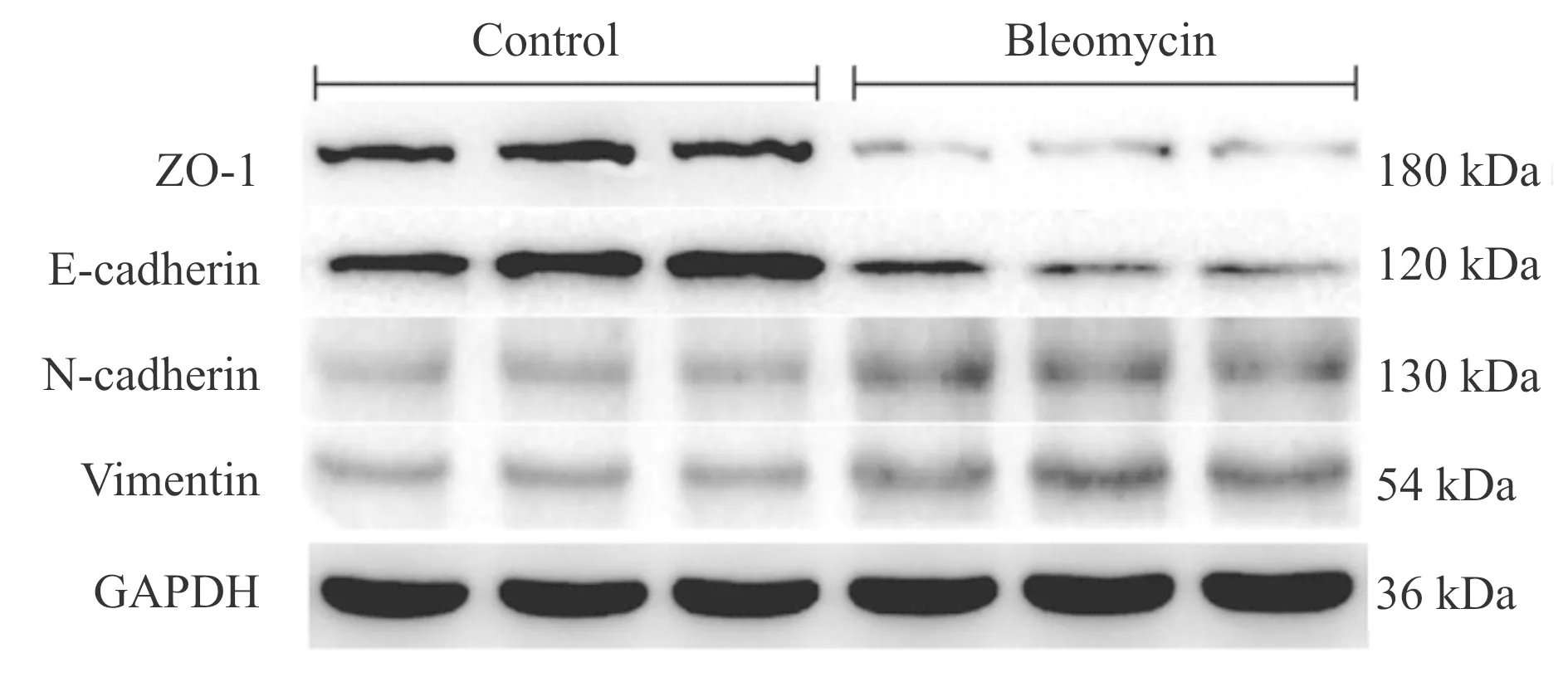
Fig. 6 Representative bands of ZO-1, E-cadherin, Vimentin and N-cadherin expressions in rat lung tissue
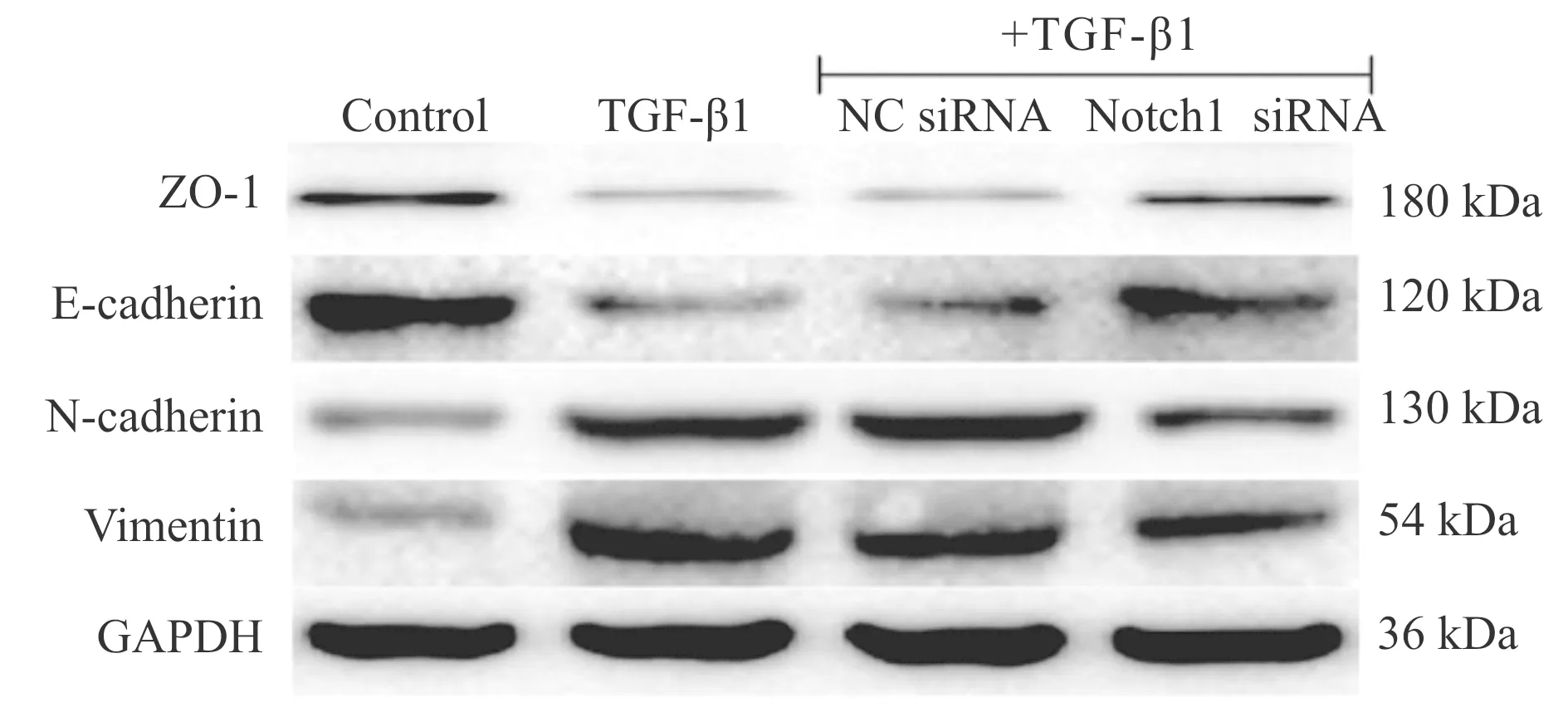
Fig. 7 Representative bands of ZO-1, E-cadherin, Vimentin and N-cadherin expressions in cultured type II alveolar epithelial cells
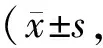
Tab. 4 Real-time PCR and western blots analyses for ZO-1, E-cadherin, Vimentin and N-cadherin expressions in lung tissues n=8)
Tab. 5 Effects of Notch-1 siRNA on TGF-β1-induced expressions of ZO-1, E-cadherin, Vimentin and N-cadherin mRNA in cultured type II alveolar epithelial cells n=9)
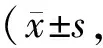
Tab. 6 Effects of Notch-1 siRNA on TGF-β1-induced expression of ZO-1, E-cadherin, Vimentin and N-cadherin proteins in cultured type II alveolar epithelial cells n=9)
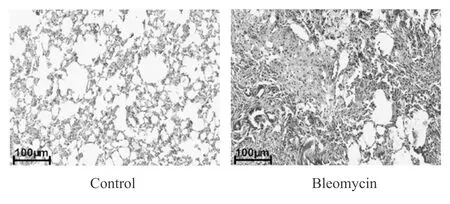
Fig. 8 Rat lung tissue paraffin sections were stained with Masson staining (×200)
Fig. 9 Representative bands of collagen I and collagen III expression in rat lung tissue
Tab. 7 Real-time PCR and western blots analyses for collagen I, collagen III and TGF-β1 expressions in lung tissues n=8)
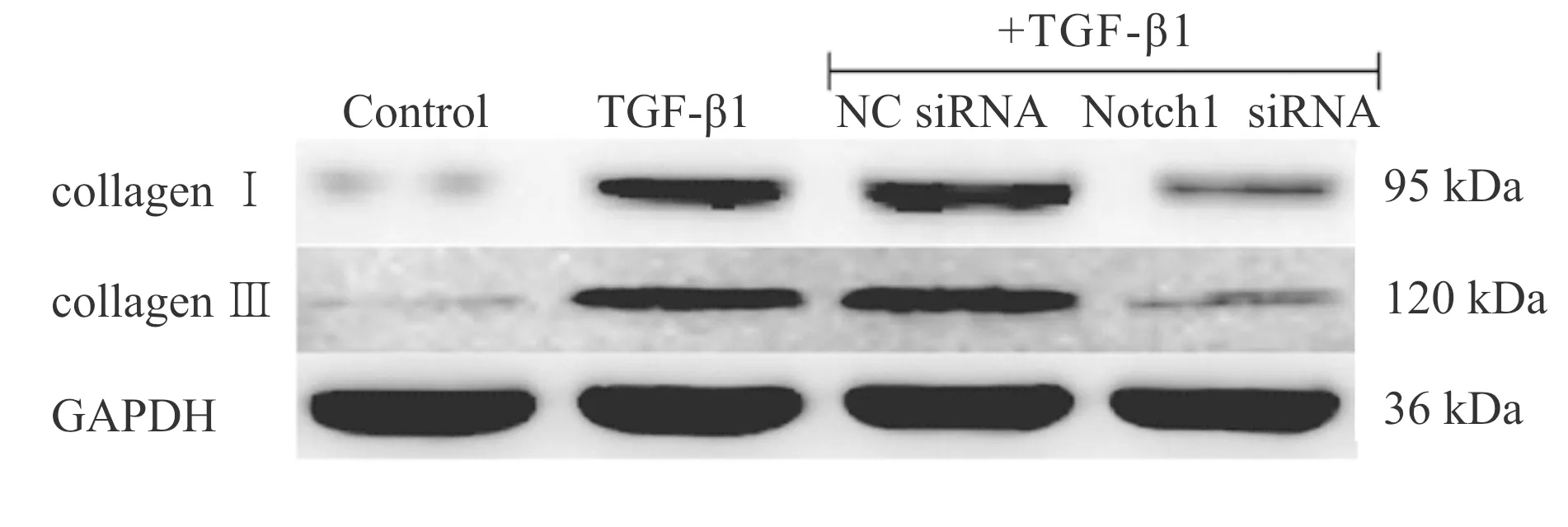
Fig. 10 Representative bands of collagen I and collagen III expression in cultured type II alveolar epithelial cells
Tab. 8 Effects of Notch-1 siRNA on TGF-β1-induced expressions of collagen I and collagen III mRNA and proteins in cultured type II alveolar epithelial cells n=9)
3 讨论
目前研究发现上皮细胞在某些刺激因素的刺激下可失去其原有的极性,导致细胞连接和极性的丧失和上皮标志物逐渐丢失,进而分化为间充质样(成纤维细胞样)细胞并获得一定的迁移和游走能力,这种上皮细胞在形态学和生理特性的改变称之为EMT[12]。已知肺泡上皮细胞包括I型和II型,正常生理情况下,II型肺泡上皮细胞可以增殖分化为I型肺泡上皮细胞并分泌大量的富含磷脂的肺表面活性剂,降低肺泡表面张力,防止肺泡塌陷,以维持肺泡壁结构的完整性[5]。但当病因相关慢性肺损伤因素持续存在时,II型肺泡上皮细胞增殖和分化为I型肺泡上皮细胞的能力明显降低,在促纤维化因子如TGF-β1、TNF-α等的作用下肺泡上皮细胞标志物(如E-cadherin和ZO-1等)逐渐丢失而间质细胞标志物(如N-cadherin和Vimentin等)逐渐增加,导致EMT的产生[13,14]。博莱霉素(bleomycin)是一种细胞毒性抗恶性肿瘤药物,它能与铜或铁离子络合,使氧分子转化为氧自由基而使肿瘤细胞DNA单链断裂、阻滞DNA的复制,干扰细胞分裂增殖[15]。该药的毒副作用之一是引起肺纤维化,在动物实验上证实,博莱霉素所致肺纤维化病理组织学改变与人类肺纤维化非常相似,被普遍作为研究肺纤维化的模型[16]。而本实验也证明了这一点,我们发现在博莱霉素诱导的大鼠肺纤维化模型中,肺组织结构严重破坏,肺泡结构出现萎缩和塌陷并发生融合,肺泡壁增宽增厚明显,且可见大量炎性细胞的浸润及分泌物,纤维化显著。同时,肺组织蓝染的胶原纤维明显增多,collagen I和collagen III的表达明显增加。另外,肺组织中E-cadherin和ZO-1表达明显下降而N-cadherin和Vimentin的表达明显增加。这些结果进一步表明,在肺纤维化发病过程中,肺泡上皮细胞发生了EMT,但具体机制目前还不是很清楚。
Twist-1是一种进化上高度保守的碱性螺旋-环-螺旋转录因子,具有调控胚胎发育、诱导细胞发生EMT等功能[6]。研究发现,在特发性肺纤维化病人肺组织中Twist-1的表达明显升高[7],进一步研究表明当Twist-1激活后,导致上皮细胞标记物如E-钙粘蛋白表达下调而间质细胞标记物如N-钙粘蛋白、波形蛋白表达上调,改变细胞形态,诱导肺泡上皮细胞EMT的发生[8]。而本实验结果显示,在BLC诱导的肺纤维化大鼠肺组织中Twist-1的表达明显升高,体外实验我们进一步发现,外源性TGF-β1能够明显诱导II型肺泡上皮细胞发生EMT(N-cadherin和Vimentin表达明显升高而E-cadherin 及ZO-1表达明显降低),I和III型胶原的表达明显也升高,同时伴随着Twist-1的表达上调。但促纤维化因子如TGF-β1是通过何种途径诱导Twist-1的表达进而介导II型肺泡上皮细胞发生EMT,目前尚不清楚。
最近研究发现Notch-1信号通路与细胞的增殖、分化,收缩、迁移等细胞生物学功能密切相关[17]。除此之外,Notch-1信号通路也被证实参与了多种组织的纤维化过程,如肾纤维化、肝纤维化和肺纤维化等[18-20]。研究发现在肺纤维化发展过程中,当Notch-1信号通路激活后,释放出NICD并进入细胞核,与核内的转录因子C启动子结合因子-1结合,进而诱导其下游转录因子Hes-1的表达上调,促进II型肺泡上皮细胞EMT,导致ECM分泌增加,从而促进肺纤维化的发生与发展[21,22]。我们的研究也证实了上述的观点,即在BLM诱导的肺纤维化大鼠肺组织中Notch-1、NICD和Hes-1的表达明显上调,同时外源性TGF-β1能够明显诱导II型肺泡上皮细胞Notch-1、NICD和Hes-1的表达,而用Notch-1的siRNA干扰片段抑制Notch-1的表达后,NICD、Hes-1和Twist-1的表达明显降低,同时肺泡上皮EMT明显被抑制(N-cadherin和Vimentin表达下调而E-cadherin 及ZO-1表达上调),collagen I和collagen III的表达明显减少。
综上所述,Twist-1参与了II型肺泡上皮细胞EMT进程,其机制可能与TGF-β1介导的Notch-1信号通路激活有关。但也有文献报道[23],Notch-3信号通路也参与了II型肺泡上皮细胞EMT,而Twist-1介导的II型肺泡上皮细胞EMT是否也与Notch-3信号通路有关,值得进一步探讨。
