白花蛇舌草多糖提取物对喉癌Hep-2细胞内质网自噬的影响*
2021-12-08张岩岩郭海艳
张岩岩, 刘 华, 宋 扬, 郭海艳
(唐山市工人医院耳鼻喉科, 河北 唐山 063000)
喉癌发生率约占头颈部肿瘤的20%,也是头颈部继鼻咽癌之后第二大类恶性肿瘤,严重威胁着患者生命安全,降低生活质量[1,2]。喉癌起病隐匿,不易发现,部分患者发现时已是中晚期,手术治疗效果不佳,但化疗药物治疗肿瘤的同时,人体正常器官亦受到极大损害,因此,研发或探索新型抗肿瘤药物已成为目前的研究热点。中药作为我国特有的卫生资源,具有巨大的原创优势及发掘潜力,白花蛇舌草出自《广西中药志》,具有“清热解毒、消痛散结、利尿除湿”的功效,在其他少数民族的医药典籍中亦有记载,其中景颇族的《德宏药录》、基诺族的《基诺药》均记载其除了清热解毒功效外,亦有抗肿瘤作用。现代药理学证实[3],白花蛇舌草多糖提取物(hedyotis diffusa polysaccharide extract,HDPE)可促进喉癌Hep-2细胞凋亡,并抑制其增殖能力,但并未进行深入研究。
内质网应激本身为真核细胞为应对内质网中Ca2+紊乱及未折叠蛋白内质网蓄积的一种自我保护机制,但高强度而持续的内质网应激易引发细胞凋亡,已成为线粒体细胞凋亡通路后又一重要的凋亡相关机制[4]。内质网自噬多由内质网应激所激活,与内质网应激共同参与处理未折叠蛋白,缓解严重的内质网应激,从而维持内质网稳态,避免细胞凋亡[5]。本研究拟培养喉癌Hep-2细胞,并使用不同浓度HDP进行干预,观察细胞内质网应激、内质网自噬发生情况及增殖能力变化。现报告如下。
1 材料与方法
1.1 材料、试药和仪器
Hep-2细胞株由购自于美国 ATCC公司。HDPE购自南京泽朗医药科技有限公司,批号A20190213,纯度≥98%;自噬抑制剂3-甲基腺嘌呤(3-MA)购自美国Sigma公司,批号:M9281;噻唑蓝(MTT)检测试剂盒购自苏州宇恒生物有限公司,货号C5236;原位末端转移酶标记(TUNEL)试剂盒购自上海碧云天公司,货号C1088;anti-Beclin-1、anti-LC3Ⅰ、anti-LC3Ⅱ、anti-GRP78、anti-ATF6及anti-CHOP(英国Abcam公司,货号分别为ab62557、ab627214、ab48394、ab108615、ab203119、ab179823);山羊抗兔/鼠过氧化物酶二抗(北京康为世纪公司,货号CW1222)。BX53型荧光显微镜购自日本Olympus公司;muLISKAN-MK3酶标仪购自美国Thermo公司;5804R型高速冷冻离心机购自德国Eppendorf公司;MCO-18AC型细胞培养箱购自日本Sanyo公司;WD-9413B型凝胶成像系统购自北京六一生物科技有限公司;SD Cell 型转移电泳槽购自美国Bio-rad公司。
1.2 细胞培养与分组
将Hep-2细胞调整约为4×103cells/well接种于12孔板内,细胞培养液为DMEM+10%FBS溶液,37℃、5% CO2培养条件下于培养箱中,待生长至 80%时,加入PBS 溶液清洗细胞,添加0.2%胰酶消化,进行传代培养,当细胞培养至第 3 代时可用于后续研究。将培养48 h细胞弃掉上清培养液,分为对照组、HDPE 100、200、400 mg/L组和3-MA组,分别加入HDPE 0、100、200、400 mg/L[3]和3-MA 20 μmol/L溶液[6],培养48 h。
1.3 细胞增殖抑制率检测
采用噻唑盐比色法(MTT)检测各组细胞增殖抑制率;首先用台盼蓝拒染法确认Hep-2细胞拒染率在95%以上;常温下收集细胞,并调整细胞混悬液浓度至1×106cells/ml,以每孔200 μl细胞混悬液接种于96 孔板中,生长至>50%融合度时加入含终浓度为0、100、200、400 mg/L HDPE,及20 μmol/L 3-MA,每组5个复孔,培养24、48及72 h,结束后加入MTT溶液20 μl(5 g/L),充分反应4 h后弃上清,每孔再加入DMSO溶液200 μl,读取吸光度(A)波长为570 nm。
增殖抑制率%=(1-A实验组/A对照组)×100%。
1.4 荧光TUNEL染色
各组培养48 h细胞加入12孔板,经过0.1% Trition X-100透化,加入3% H2O2200 μl,PBS漂洗3次后,加入蛋白酶K灭活DNA、RNA,最后加入TUNEL液,恒温箱中避光孵育60 min。取出后经PBS冲洗3次加入DAPI反应液,反应20 min后冲洗封片。应用荧光显微镜观察细胞,绿色代表已凋亡细胞,蓝色代表仍生存细胞。
凋亡指数(AI)=各视野阳性细胞数/视野所有细胞总数×100%。
1.5 单丹黄酰尸胺(MDC)染色观察自噬溶酶体情况
配置含MDC的DMSO储存液,浓度为5 mmol/L,将各组培养48 h的Hep-2细胞重悬于6孔板内(细胞密度1×106cells/ml),加入50 μmol/L MDC溶液,细胞孵育箱内培育45 min,培育条件为37℃、5% CO2,后收集细胞;经PBS溶液洗涤2次后,再用60 μl PBS溶液重悬,取液滴片,经紫外光激发,绿色荧光为细胞自噬囊泡,用倒置荧光显微镜在相同曝光条件下随机选取 3 个视野进行拍照,观察自噬空泡的变化情况并摄片,Image J软件计算荧光度。
1.6 透射电镜检测自噬发生情况
选取各组培养48 h细胞,细胞密度调定1×105cells/ml,无菌操作下置于6孔板中,500 μl/well,使用含 EDTA的胰酶消化细胞,加入4%戊二醛固定细胞,将固定细胞逐级乙醇脱水,用 70%乙醇醋酸双氧铀块染色,包埋、切片后用透射电子显微镜观察Hep-2细胞中内质网中自噬囊泡形成情况。
1.7 Western blot法检测内质网凋亡及内质网自噬蛋白
取不同组别培养48 h 的Hep-2细胞,BCA法测定各组蛋白浓度,制备上样液。取各组待测样品15 μl和5 μl蛋白Marker,加入电泳装置中,待电泳结束后进行免疫印迹,转膜,封闭,加入Beclin-1蛋白(Beclin-1)、微管相关轻链蛋白3Ⅰ(light chain 3Ⅰ,LC3Ⅰ)、LC3Ⅱ、葡萄糖调节蛋白 78(glucose regulatory protein 78,GRP78)、活化转录因子6(activated transcription factor 6,ATF6)及CCAAT 增强子结合蛋白同源蛋白(CCAAT enhancer binding homologous protein,CHOP)对应一抗(一抗比例均为1∶800),4℃孵育过夜,PBS洗膜2次后加入二抗(1∶500),常温下孵育2 h,PBS洗膜3次,ECL显像,暗室曝光,扫描胶片,用凝胶图像处理系统分析。
目的蛋白的相对表达量=目的蛋白的灰度值/β-actin的灰度值。
1.8 统计学处理
2 结果
2.1 各组细胞增殖抑制率检测
与对照组比较,HDPE 100、200、400 mg/L组和3-MA组细胞在培养24、48、72 h后增殖抑制率升高,差异有统计学意义(P<0.05);与3-MA组比较,HDPE 400 mg/L组培养24、48、72 h后增殖抑制率升高,差异有统计学意义(P<0.05, 表1)。
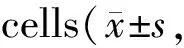
Tab. 1 Effects of HDPE on proliferation inhibition rate of Hep-2 n=6)
2.2 各组细胞TUNEL染色凋亡情况
TUNEL染色下正常细胞核为蓝色荧光,凋亡细胞核为绿色荧光。TUNEL染色结果显示:对照组细胞基本为蓝色荧光,HDPE100、200、400 mg/L组及3-MA组细胞绿色荧光细胞核逐渐增多(图1)。与对照组(AI=2.46±0.24)比较,HDPE 100、200、400 mg/L组(AI=7.62±1.33;AI=12.85±2.05;AI= 31.28±4.62)及3-MA组(AI=17.59±2.75)细胞凋亡数量增多,差异有统计学意义(P<0.05)。与3-MA组比较,HDPE 400 mg/L组细胞凋亡数量增多,差异有统计学意义(P<0.05)。

Fig. 1 Effects of HDPE on apoptosis of Hep-2 cells (TUNEL staining × 200)
2.3 各组细胞自噬溶酶体荧光强度情况
与对照组[(38.47±4.35)%]比较,HDPE 100、200、400 mg/L组[(26.72±2.18)%、(16.85± 2.04)%、(8.43±1.34)%]及3-MA组[(13.67± 3.75)%]荧光强度均降低,差异有统计学意义(P< 0.05);与3-MA组比较,HDPE 400 mg/L组荧光强度降低,差异有统计学意义(P<0.05, 图2)。
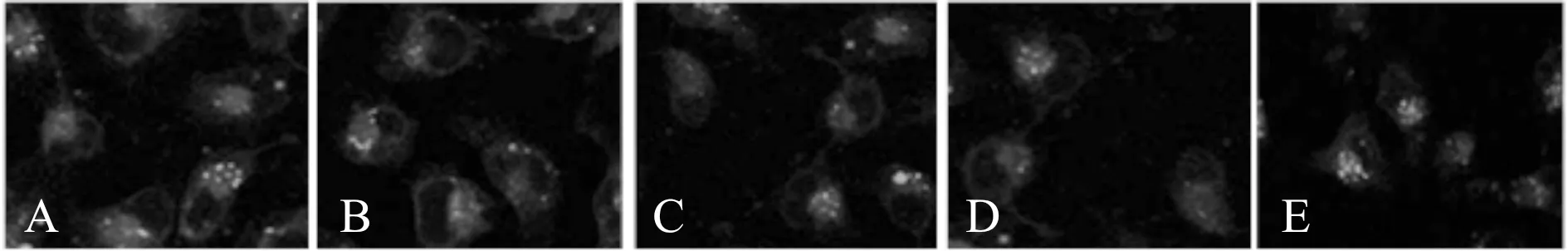
Fig. 2 Effects of HDPE on autophagy lysosomes in Hep-2 cells (MDC staining × 400)
2.4 透射电子显微镜观察内质网自噬发生情况
对照组细胞透射电子显微镜下内质网周围自噬囊泡出现较多,HDPE 100、200、400 mg/L组及3-MA组内质网周围自噬囊泡出现明显减少;与3-MA组比较,HDPE 400 mg/L组内质网周围自噬囊泡形成减少(图3)。
2.5 各组细胞内质网凋亡及内质网自噬蛋白表达情况
与对照组比较,HDPE 100、200、400 mg/L组及3-MA组细胞GRP78、ATF6、CHOP表达及LC3Ⅰ/LC3Ⅱ比值升高,Beclin-1表达降低,差异有统计学意义(P<0.05);与3-MA组比较,HDPE 400 mg/L组GRP78、ATF6及CHOP表达及LC3Ⅰ/LC3Ⅱ比值升高,Beclin-1表达降低,差异有统计学意义(P<0.05,图4,表2)。
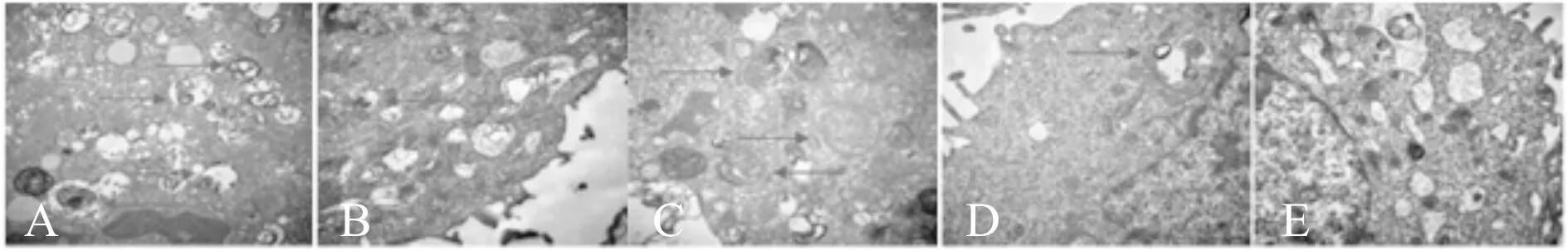
Fig. 3 Effects of HDPE on the formation of autophagy vesicles around endoplasmic reticulum in Hep-2 cells (×2500)
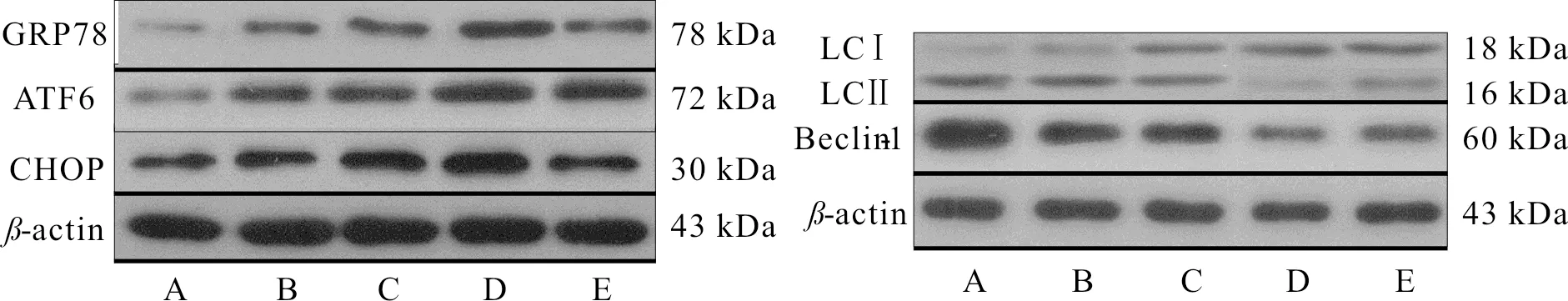
Fig. 4 Effects of HDPE on GRP78, ATF6, CHOP, LC3 Ⅰ, LC3II and Beclin-1 proteins in Hep-2 cells
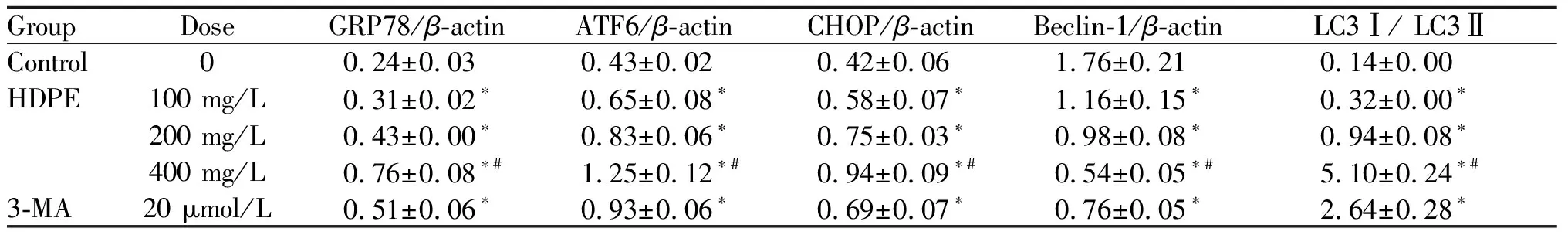
Tab. 2 Effect of HDPE on the expressions of GRP78, ATF6, CHOP, Beclin-1 protein and LC3Ⅰ/LC3II in Hep-2 cells (n=5)
3 讨论
中药是我国独特且宝贵的医疗资源,是中医长期临床实践,反复印证得到的宝贵经验,但既往在长期的临床应用中,仅能探索其临床功效,对其具体药物作用靶点的研究仍需不断探索。白花蛇舌草最早记载于《神农本草经》,用于治疗疔疮肿毒,毒蛇咬伤,其经乙醇分离后鉴定芦丁、槲皮素、山奈酚是白花蛇舌草黄酮类的主要成分,均具较强的DNA裂解能力,抑制肿瘤细胞增殖[7,8]。在现代的中药药理研究中证实,白花蛇舌草具有抗肿瘤、炎症、清除氧化自由基等作用[9-11]。喉癌近些年来发病率不断上升,虽然经常规手术及放化疗治疗后5年生存率可达68.2%,但仍不能满足临床工作者及患者的心理期望[12]。本研究采用HDPE对喉癌Hep-2细胞进行培养,并且应用自噬抑制剂3-MA为阳性对照药物,MTT实验结果证实HDPE可有效升高Hep-2细胞增殖抑制率,说明HDPE可抑制喉癌Hep-2细胞生长。
内质网是真核细胞最大的膜系统,不仅调控离子平衡、蛋白合成、脂质合成、膜生成,更可激活凋亡通路,导致细胞程序性死亡[13]。肿瘤细胞由于其疯狂生长的特性,导致细胞长期处于缺血缺氧状态,易处于内质网应激状态,激活泛素化及内质网自噬处理内质网中未折叠或错误折叠蛋白,以保证肿瘤细胞继续存活、增殖[14]。内质网自噬可选择性清除细胞内受损的内质网或内质网片段,从而起到改善细胞内环境,保护细胞的作用。已有研究发现[15],抑制肿瘤细胞内质网自噬,减少未折叠蛋白降解,可加重内质网应激程度,高强度而持续的内质网应激诱导肿瘤细胞启动凋亡程序,进而起到降低肿瘤细胞增殖能力的作用。本研究首先通过MDC染色,发现不同剂量HDPE组及3-MA组细胞自噬空泡荧光度较对照组细胞荧光度降低,说明喉癌Hep-2细胞本身自噬程度较强,经HDPE干预后可抑制Hep-2细胞自噬。通过透射电子显微镜观察各组细胞发现,常规培养Hep-2细胞内质网内及内质网周围出现较多自噬囊泡及自噬小体,而经不同剂量HDPE组及3-MA组细胞内质网内及内质网周围自噬囊泡及自噬小体均减少。结合MTT实验结果,说明HDPE可能通过抑制内质网自噬起到抑制Hep-2细胞增殖作用。
为了进一步确认HDPE对Hep-2细胞内质网应激及内质网自噬的影响,本研究对GRP78/ATF6/CHOP内质网应激凋亡信号通路及自噬标记蛋白Beclin-1、LC3Ⅰ及LC3Ⅱ进行检测。GRP78是内质网特异性的分子伴侣蛋白,其表达程度可直接反应内质网应激程度,也是对抗内质网应激的保护性反应[16,17]。ATF6是内质网Ⅱ型跨膜蛋白,其N端位于细胞质内,C端位于内质网中,可感受内质网应激并活化CHOP,诱导细胞凋亡[18]。Beclin-1及LC3Ⅰ/ LC3Ⅱ比值已被公认为自噬标记蛋白,均可在分子层面反应细胞自噬发生与否[19,20]。本研究证实,经HDPE及3-MA干预后,Hep-2细胞GRP78、ATF6、CHOP表达及LC3Ⅰ/LC3Ⅱ比值升高,Beclin-1表达降低。说明Hep-2细胞中内质网应激与内质网自噬同时发生,共同降解错误折叠蛋白或未折叠蛋白,维持细胞生殖能力。而HDPE可能通过抑制Hep-2细胞内质网自噬,降低肿瘤细胞处理未折叠蛋白能力,增强内质网应激反应,引发细胞凋亡,从而起到抑制细胞增殖作用,这也与MTT、MDC染色及透射电镜观察结果相一致。
综上所述,HDPE可能通过抑制Hep-2细胞内质网自噬反应,增强细胞内质网应激凋亡信号通路的敏感性,从而降低Hep-2细胞增殖能力,起到抑制肿瘤增殖作用。而自噬普遍存在于多种肿瘤中,抑制自噬可在一定程度上抑制肿瘤细胞增殖,本研究结果也可为其他肿瘤治疗提供思路。
