脾硬化性血管瘤样结节性转化的病理分析
2021-12-08夏言何向蕾
夏言,何向蕾
(浙江省人民医院(杭州医学院附属人民医院),浙江 杭州 310014)
脾硬化性血管瘤样结节性转化(sclerosing angiomatoidnodular transformation,SANT)是一种罕见的、发生于脾脏的非肿瘤性、良性增生性血管病变,该名称由Martel等[1]2004年推荐使用,一般通过单纯性脾切除即可治愈。迄今为止,国内外文献报道仅100多例[2],由于早期对该疾病认识不足,临床及影像学表现易与血管瘤、错钩瘤及炎性假瘤等混淆,造成误诊和漏诊。本文回顾性分析11例脾脏SANT的病理特征,总结报道如下。
1 资料与方法
1.1 一般资料 选择2013年8月~2021年1月浙江省人民医院确诊的11例SANT标本。11例患者中男3例,女8例,年龄23~65岁,中位年龄50岁。临床表现:上腹部不适2例,左腰部隐痛和胃肠功能紊乱各1例,其余7例均在体检中偶然发现。影像学检查均显示脾脏占位,考虑为“血管瘤”。11例均行单纯脾脏切除术。术后随访3-92个月,患者均存活且无复发或转移现象。
1.2 方法 所有标本经3.7%中性甲醛溶液固定,常规石蜡包埋,4μm连续切片,HE染色,光镜观察。免疫组化采用En Vision两步法,所有一抗CD34、CD31、CD8、CD68、SMA 均购自福州迈新生物技术开发有限公司,用已知阳性组织作为阳性对照,用PBS代替一抗作为阴性对照。免疫组化标记阳性为黄色或棕黄色颗粒,CD34、CD31定位于细胞质或细胞膜,CD8定位于细胞膜,CD68、SMA定位于细胞质。每张切片随机取10个视野共100个细胞,计数阳性细胞的百分率数,<5%阴性,5%~25%为弱阳,>25%为阳性。
2 结果
2.1 巨检 11例病变均位于脾脏实质内,呈结节状,2例多灶,其余单发,最长径1.5~8cm。切面颜色以灰白、灰黄为主,多伴出血,质韧或中等,脾脏切面可见灰白瘢痕样结构放射状排列或纤维条索样分割,边界清或不清,无包膜(图1)。

图1 脾脏切面可见灰白瘢痕样结构放射状排列
2.2 镜检 低倍镜下病变区的脾脏正常结构破坏,在显著增生硬化的纤维背景下可见大小不一的血管瘤样结节,可相互融合,结节中心可见裂隙状、蜂窝样或不规则的血管腔隙,结节周边常以同心圆样排列的致密胶原纤维带围绕(图2)。高倍镜下血管腔隙内衬肥胖的内皮细胞,呈短梭形或立方状,形态温和,无异形性,核分裂像罕见(图3);腔内可有或无红细胞,常见不等量红细胞外渗,周围散在淋巴细胞、浆细胞及吞噬含铁血黄素的组织细胞。结节外围见纤维细胞呈洋葱皮样包绕、分隔结节,细胞未见异形,部分间质可胶原化、黏液变性(图4)。
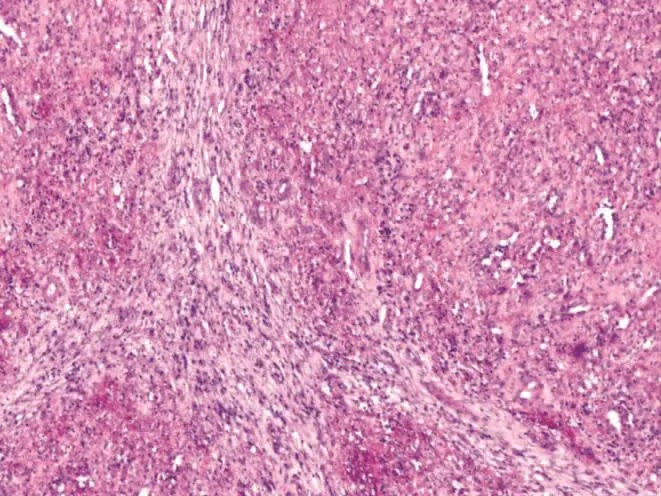
图2 大小不一的血管瘤样结节,周边见同心圆样排列的致密胶原纤维带围绕。 (HE×40)

图3 血管瘤样结节中央见大小不一的血管腔,内皮细胞肿胀,形态温和,无异形性,腔内外见红细胞分布。(HE×400)
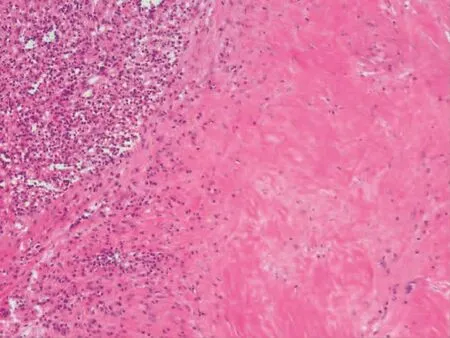
图4 结节外围纤维间质可见胶原化(HE×100)
2.3 免疫组化 11例SANT中10例CD34阳性,主要表达于脾索型毛细血管(图5);8例CD8阳性,主要表达于窦隙样血管内皮细胞(图 6);11例CD31均阳性,且其表达部位较为广泛,除前两个区域外在小静脉型血管内皮亦见表达(图7);结节内组织细胞可见CD68表达(图8);结节周围纤维间质可见SMA表达(图9)。
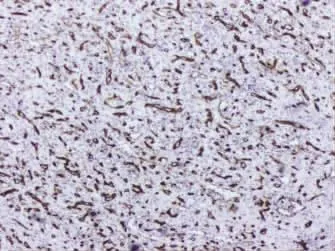
图5 结节内脾索型毛细血管内皮细胞 CD34 阳性(En Vision×100)
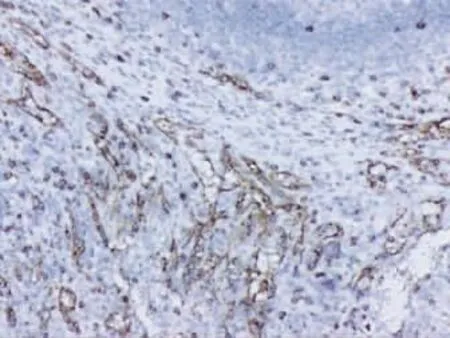
图6 结节内窦隙样血管内皮细胞CD8阳性(En Vision×100)
图7 结节内小静脉型血管内皮细胞CD31 阳性(En Vision×100)

图8 结节内组织细胞CD68阳性(En Vision×100)

图9 结节周围纤维细胞SMA阳性(En Vision×100)
3 讨论
3.1 发病机制 SANT发病机制目前尚不清楚,早期文献曾以“脾脏错构瘤”或“炎性假瘤”进行报道。现主流观点认为其是一种非肿瘤性的反应性病变,因病变位于红髓,推测可能是红髓针对非肿瘤性间质高度增生的一种结节性转化[3];也有研究发现,SANT可能与IgG4相关硬化性疾病有关[4],是一种自身免疫性疾病;Weinreb等[5]于2007年报道,SANT中发现EB病毒表达,据此认为其发病可能与EB病毒感染相关。由于病例数有限,发病机制尚待研究。
3.2 临床表现 通过复习文献发现,SANT好发于中青年,年龄30~60岁,中位年龄45岁,男女比例约1:2[6]。临床上常无明显症状,多于体检或行腹部探查时偶然发现[7],少数患者伴腹部不适、腹痛、纳差等非特异性临床症状,可同时伴发热、贫血及白细胞增多[6]。需注意的是,SANT亦会伴肿瘤性疾病,如乳腺癌或黑色素瘤[8-9],临床诊治过程中需与恶性肿瘤脾转移相鉴别。本组11例中,男:女约1:2.67,中位年龄50岁,有4例伴非特异的胃肠道症状,与文献报道基本相符。另外,本组有2例分别伴左乳导管内乳头瘤和双侧结节性甲状腺肿,并与SANT同时发现,为作者首次报道,但与SANT的关系尚待证实。
3.3 影像学表现 CT平扫时多呈较规则的类圆形等或稍低密度病灶,边界欠清,CT增强表现为早期强化及持续向心性强化[10]。MRI检查表现为T2W1不均匀低信号,病灶中央见裂隙状更低信号区,增强扫描时动脉期边缘明显结节状强化或轻度强化并逐渐向中央充填,呈渐进性强化,多数可见“轮辐状”征象[11]。本组11例影像学表现为实性占位/团块状低密度影,与此基本相符,而在结论时多考虑为脉管源性肿瘤。
3.4 病理表现 脾脏切面见灰白结节样病灶,多为孤立性,少数为多灶性,亦见结节相互融合,中央可见条索状或网格状瘢痕,色灰白,质地中等偏韧,长径3~17cm[1]。本组11例中,除1例最长径较短(1.5cm)外,其余最长径3~8cm。显微镜下示病变主要位于红髓,由多个境界清楚的血管瘤样结节及其外周包裹的纤维硬化间质组成,结节内可见不规则的血管裂隙,内衬肥胖的血管内皮细胞,细胞温和无异形。腔隙内可含红细胞,常见红细胞外渗,周围散在浆细胞、吞噬含铁血黄素的巨噬细胞和炎症细胞。结节外围有同心圆排列的纤维细胞,可伴胶原化或黏液变性。免疫组化标记显示血管瘤样结节中的血管腔隙存在三种类型:毛细血管型表达CD31和CD34,不表达CD8;窦样腔隙型表达CD31和CD8,不表达 CD34;小静脉型表达 CD31,不表达CD34和CD8;结节内组织细胞表达CD68,结节外梭形肌纤维母细胞表达SMA。本组11例有以毛细血管型和以窦样腔隙型为主,多混合存在,与曹培龙等[12]报道不同。本组免疫组化标记显示CD34主要表达于结节中央的小血管内皮,而CD8多表达于结节周边靠近纤维细胞包裹处的窦隙样血管腔隙的内皮细胞中。
3.5 鉴别诊断 (1)炎性假瘤。由梭形的纤维母细胞或肌纤维母细胞增生,伴淋巴细胞、浆细胞和组织细胞浸润,可见239数量不等的纤维胶原间质,与SANT最为相似,但无血管瘤样结构,不表达CD34、CD8和CD31。(2)脾错构瘤。由红髓组成的脾结节状病变,可见血窦样管腔,与SANT免疫组化表型有重叠,但其缺乏SANT中纤维组织同心圆样排列结构,免疫组化CD34阴性。(3)血管瘤。形态上可见纤维条索分隔的增生性血管腔隙,管腔内衬扁平内皮细胞,内皮细胞表达CD31、CD34。但缺乏SANT典型的三种血管腔隙类型,不表达CD8。(4)脾窦岸细胞血管瘤。由大小不一、相互吻合的血管腔组成,常见管腔囊性扩张及腔内乳头状突起,内皮细胞高柱状,同时表达CD31和CD68,但周边无纤维硬化间质,CD34阴性。
