不同眼内灌注液对视网膜组织学及功能的影响
2021-12-07朱莉苗恒胡钦瑞刘志明白玉婧虞有智傅亚飞夏会卡黄旅珍齐赟邓洵李岩黎晓新
朱莉 苗恒 胡钦瑞 刘志明 白玉婧 虞有智 傅亚飞 夏会卡 黄旅珍 齐赟 邓洵 李岩 黎晓新
北京大学人民医院眼科 眼视光中心 眼病与视光医学研究所 视网膜脉络膜疾病诊治研究北京市重点实验室 北京大学医学部眼视光学院 100044

表1 BSS和CEIIS组成成分比较Table 1 Comparison of components between BSS and CEIIS灌注液 相同成分不同成分BSS NaCl、KCl、CaCl2·2H2OMgCl2·6H2O、C2H3NaO2·3H2O、C6H5Na3O7·2H2OCEIIS NaCl、KCl、CaCl2·2H2OMgSO4、NaHCO3、C6H12O6·H2O 注:BSS:平衡盐灌洗液;CEIIS:复方电解质眼内灌注液 Note:BSS:balanced saline solution;CEIIS:compound electrolyte intraocular irrigating solution
玻璃体切割术中改进眼内灌注液可以更好地保护视网膜组织结构并改善视网膜功能[1-3],减少对视网膜色素上皮细胞和角膜内皮细胞的损伤。眼组织的新陈代谢有赖于眼内液体成分及其作用,如O2、pH和渗透压等。将无菌平衡盐灌洗液(balanced saline solution,BSS)与改良无菌BSS(必施佳)对眼组织的影响进行比较发现,兔眼玻璃体切割术中应用乳酸林格液对术后视网膜电图(electroretinogram,ERG)的a波、b波振幅低于正常值所持续的时间比BSS和改良BSS更长[4],推测乳酸林格液的低pH、高乳酸水平和低渗透压可能对视网膜细胞产生永久性的损伤。还有研究发现,玻璃体切割术后早期病变主要发生在视网膜内,包括视网膜的各层缺损或脱离、视神经纤维层外露、内丛状层水肿和层厚增加等[5-7],因此术眼术后视力恢复可能与术中灌注液介导的细胞内环境变化有关。葡萄糖是眼内灌注液中的重要组成成分,是维持视网膜正常功能的必要元素。复方电解质眼内灌注液(compound electrolyte intraocular irrigating solution,CEIIS)中硫酸镁、碳酸氢钠和葡萄糖的成分与BSS稍有不同(表1),更符合眼组织细胞代谢的生理需求,但目前鲜见BSS与CEIIS对眼组织细胞功能和结构影响的比较。本研究拟观察这2种眼内灌注液对体外培养的人角膜内皮细胞(human corneal endothelial cells,HCEC)、人视网膜色素上皮(human retinal pigment epithelium,HRPE)细胞和大鼠视网膜神经节细胞(retinal ganglion cells,RGC)生存的影响,并比较2种眼内灌注液对兔玻璃体切割术后视网膜功能和结构恢复的影响,为临床玻璃体切割手术中眼内灌注液的选择提供参考依据。
1 材料与方法
1.1 材料
1.1.1实验细胞及动物 HRPE细胞系(CRL2302)(美国ATTC细胞库);HCEC系(ACC647)(德国微生物菌种保藏中心);大鼠RGC(武汉普诺赛生命科技有限公司)。HRPE细胞系和HCEC系均由天津科美生物科技有限公司进行STR分析;采用免疫荧光染色法测定神经节细胞标志蛋白Rbpms和Brn3a在RGC中的表达。3~4月龄新西兰大耳白兔16只,雌雄各半,体质量2.0~2.5 kg,由北京科宇动物养殖中心提供。实验动物的喂养和使用遵循美国视觉与眼科学研究协会制定的ARVO声明。本研究方案经北京大学人民医院伦理委员会审批通过(批文号:2019PHE059)。
1.1.2主要试剂及仪器 BSS(美国Alcon公司);CEIIS(沈阳兴齐制药有限公司);DMEM/F12培养基、胎牛血清(fetal bovine serum,FBS)(美国Thermo公司);乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒、琥珀酸脱氢酶(succinate dehydrogenase,SDH)试剂盒(美国Sigma-Aldrich公司);蛋白质定量检测试剂盒(BCA法)、细胞计数试剂盒-8(cell counting kit-8,CCK-8)(上海碧云天生物技术有限公司);Annexin V-FITC凋亡试剂盒、细胞周期检测试剂盒(美国BD Biosciences公司);小鼠抗bax(89477)、小鼠抗bcl-2(15071)、小鼠抗caspase-3(9668)、小鼠抗caspase-9(9508)多克隆抗体(美国Cell Signaling Technology公司);Alexa-647-结合山羊抗兔二抗(ab150083)、Alexa-488-结合山羊抗小鼠二抗(ab150113)、Alexa-647-结合驴抗山羊二抗(ab150135)、兔抗细胞色素C抗体(ab90529)、兔抗闭锁小带蛋白(zonula occluden-1,ZO-1)抗体(ab221547)(英国Abcam公司);TUNEL试剂盒(QIA33)(美国Sigma公司)。23G玻璃体切割系统(Constellation Vision System,美国Alcon公司);全视野闪光ERG记录系统(RETIport,德国罗兰公司);离心机(美国Thermo Fisher Scientific公司);流式细胞仪(FACSCanto Ⅱ,美国BD公司);酶标仪(Imark,美国Bio-Rad公司);荧光倒置显微镜(IX53,日本Olympus公司);眼科超显微成像系统(4D-ISOCT,英国Optoprobe公司);超薄切片机(LEICA EM UC6,德国Leica公司);透射电子显微镜(Titan,美国FEI公司);光相干断层扫描仪(SPECTRALIS,德国海德堡公司)。
1.2 方法
1.2.1细胞分组及培养 取HRPE细胞、HCEC和大鼠RGC,常规培养3 d后,细胞达到70%以上融合时,将细胞分为正常对照组、BSS组和CEIIS组。正常对照组HRPE细胞和HCEC培养于含体积分数10%FBS的DMEM/F12中,大鼠RGC培养于含体积分数20% FBS的DMEM/F12中,BSS组和CEIIS组各细胞分别培养于BSS或CEIIS眼内灌注液中,在37 ℃、体积分数5% CO2、饱和湿度空气培养箱中培养。
1.2.2实验动物分组 采用抽签法将15只实验兔分为对照组3只、BSS组6只和CEIIS组6只,均取左眼为实验眼,根据分组在玻璃体切割术中分别采用BSS和CEIIS眼内灌注液,对照组实验兔不进行手术。
1.2.3实验动物玻璃体切割手术 采用肌内注射氯胺酮(35 mg/kg)和甲苯噻嗪(5 mg/kg)混合物行实验兔全身麻醉,手术期间以同样注射方法追加氯胺酮18 mg/kg和甲苯噻嗪5 mg/kg;术前双眼用左氧氟沙星滴眼液各点眼3滴,托吡卡胺滴眼液点术眼扩瞳;动物麻醉后用庆大霉素注射液反复冲洗结膜囊,采用盐酸丁卡因滴眼液点眼行表面麻醉。采用23G玻璃体切割系统行玻璃体切割术,操作如下:切开球结膜,做标准3个巩膜切口,将填充头、玻璃体切割头和光纤经角膜缘后1 mm处进入玻璃体腔;术中选择标准化溶液瓶高度以行玻璃体腔灌注,除保留靠近视网膜的玻璃体以外,对其他部分玻璃体进行切割。术中冲洗液维持60 min,总手术时间不到1.5 h,用7-0缝合线缝合切口;术后用地塞米松滴眼液点眼。所有动物实验手术皆由同一人完成。
1.2.4流式细胞术检测细胞凋亡率和细胞周期 将细胞接种于培养皿中并进行分组处理,培养24 h,采用质量分数0.25%胰蛋白酶消化细胞,1 000×g离心5 min,收集沉淀;用预冷磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤3次,将细胞重悬于含annexin V-FITC和碘化丙啶(propidium iodide,PI)的结合缓冲液中,采用流式细胞仪检测细胞凋亡情况,计算细胞凋亡率=早期凋亡率+晚期凋亡率。将细胞重悬于含有PI和RNase的结合缓冲液中,采用流式细胞仪对细胞周期进行分析。
1.2.5CCK-8法检测细胞活性 将细胞接种于96孔板并进行分组处理,于培养12、24和48 h向每孔添加10 μl CCK-8溶液,37 ℃条件下继续培养1 h,用酶标仪测定每孔波长450 nm处吸光度(A)值。
1.2.6免疫荧光法测定细胞中凋亡相关蛋白表达 细胞接种在96孔板中,培养24 h后用预冷PBS洗涤2次,加入质量分数4%多聚甲醛固定15 min,用预冷PBS洗涤3次,加入5%牛血清白蛋白室温下封闭1 h;分别置于小鼠抗bax抗体(1∶ 1 000)、兔抗细胞色素C抗体(1∶ 1 000)、小鼠抗bcl-2抗体(1∶ 1 000)、小鼠抗caspase-3抗体(1∶ 1 000)、小鼠抗caspase-9抗体(1∶ 1 000)和兔抗ZO-1抗体(1∶ 1 000)4 ℃下孵育过夜,PBS洗涤3次;用Alexa-647结合山羊抗兔二抗(1∶ 2 000)、Alexa-488结合山羊抗小鼠二抗(1∶ 2 000)和Alexa-647结合驴抗山羊二抗(1∶ 2 000)室温下避光孵育1 h,PBS洗涤3次;置于DAPI中室温下孵育5 min,PBS洗涤3次;荧光倒置显微镜下观察培养细胞和视网膜中相应蛋白表达的荧光强度。
1.2.7各组细胞线粒体氧化应激损伤测定 按照SDH和LDH检测试剂盒说明书的步骤,提前将细胞铺于96孔板中,每孔1×106细胞,分别于12、24、48 h每孔加入预冷100 μl分析缓冲液,冰上裂解10 min,10 000×g离心5 min,取上清,向每孔加入50 μl裂解上清,每个样品设置2个复孔,再加入50 μl反应混合物(分析缓冲液46 μl+基底混合物2 μl+探针2 μl);将96孔板于25 ℃下孵育,每5 min测1次;用酶标仪测定每孔600 nm处A值,总孵育时间不超过30 min。阳性对照由试剂盒提供。
1.2.8TUNEL染色法检测视网膜各层细胞的早期凋亡情况 采用肌内注射行全身麻醉,摘取对照组和实验组术后24 h各3只兔左眼球,浸入眼球固定液中,空气栓塞法处死实验兔;眼球固定10 min后,用1 ml注射器针头于角膜正中央穿刺以利于固定液进入眼球,继续固定过夜;标本经过固定和冲洗后在脱水机中梯度脱水,二甲苯透明,浸蜡,行石蜡包埋;沿视神经与眼轴平行的平面进行石蜡切片,切片厚度为5 μm,60 ℃烤片10 h,备用。按照TUNEL试剂盒说明书步骤,取切片用蛋白酶K于37 ℃条件下孵育30 min,PBS清洗3次,每次3 min;用体积分数3% H2O2封闭液室温封闭10 min,PBS清洗3次,每次3 min;滴加30 μl新鲜配置的TUNEL混合液,于37 ℃条件下孵育60 min,PBS清洗3次,每次3 min;滴加50 μl Streptavidin-HRP工作液,室温孵育30 min,PBS清洗3次,每次3 min;滴加200 μl DAB显色液,室温孵育15 min,PBS清洗3次,每次5 min;用苏木素染色液染核,清洗3次后封片直接观察。取各组眼球各3张切片用于TUNEL染色,计算100倍显微镜视野下TUNEL阳性细胞数。

图1 各组不同时间点3种细胞的形态学变化(×200,标尺=20 μm) 随培养时间延长,BSS组和CEIIS组细胞数量逐渐减少,正常对照组细胞数逐渐增多 HCEC:人角膜内皮细胞;HRPE:人视网膜色素上皮;RGC:视网膜神经节细胞;BSS:平衡盐灌洗液;CEIIS:复方电解质眼内灌注液 Figure 1 The morphological findings of HCEC,HRPE and RGC cells under different culture conditions at various time points (×200,bar=20 μm) With the extension of culture time,the number of cells in the BSS group and CEIIS group was decreased gradually,and the number of cells in the normal control group was increased gradually HCEC:human corneal endothelial cells;HRPE:human retinal pigment epithelium;RGC:retinal ganglion cells;BSS:balanced salt solution;CEIIS:compound electrolyte intraocular irrigating solution
1.2.9免疫组织化学染色法测定兔视网膜组织中凋亡相关蛋白表达 取各组眼球石蜡切片,脱蜡,抗原修复20 min,自然冷却至室温;用3% H2O2封闭液室温孵育10 min;PBS冲洗3次,每次3 min;滴加小鼠抗bax抗体(1∶ 500)、兔抗细胞色素C抗体(1∶ 500)4 ℃孵育过夜;PBS冲洗3次,每次3 min;滴加反应增强液,室温孵育20 min;PBS冲洗3次,每次3 min;滴加增强酶聚合物,室温孵育20 min;PBS冲洗3次,每次3 min;加入新鲜配制的DAB显色液,室温孵育5~8 min;自来水冲洗,苏木素染色液孵育20 s,封片后于显微镜下观察并拍照。
1.2.10全视野闪光ERG检查术眼视网膜功能 分别于术前和术后24 h,采用全视野闪光ERG记录系统对实验兔左眼进行闪光ERG检查,检查过程遵循国际临床视觉电生理学会的记录标准。在绝对暗室的红光照明下(波长>650 nm)进行ERG记录;采用托吡卡胺滴眼液点眼扩瞳,采用盐酸丁卡因滴眼液点眼表面麻醉;动物在暗室中暗适应1 h,记录暗适应ERG、振荡电位(oscillatory potential,OPs)和明适应ERG;检查时将金属环状电极对准角膜中央,参考针状电极插入实验兔颊部皮肤下,尽可能远离心脏,地电极插入尾部皮下;按照设定程序参数开始进行闪光ERG刺激,记录a波、b波的振幅。
1.2.11OCT检查术眼视网膜各层结构变化 分别于术前和术后24 h,采用光相干断层扫描仪对全身麻醉状态下实验兔术眼视网膜视盘部位进行检测,观察各组实验兔视网膜各层结构变化。
1.2.12透射电子显微镜下观察术眼超微结构变化 取对照组和实验组术后24 h实验兔各3只,采用肌内注射全身麻醉,摘取左眼眼球,用体积分数3%戊二醛固定3 h,用0.1 mol/L PBS溶液(pH7.2)于4 ℃条件下洗涤2次,每次10 min;用质量分数1%锇酸于4 ℃条件下固定1 h,直至样品变黑;将固定过的眼球用0.1 mol/L PBS溶液4 ℃条件下洗涤2次,每次10 min;依次用体积分数50%、70%、90%乙醇4 ℃条件下各脱水10 min,然后用100%乙醇室温下脱水3次,每次10 min;采用100%乙醇与环氧丙烷等比例混合溶液室温下渗透10 min,环氧丙烷室温下渗透10 min;Epon812与环氧丙烷等比例混合溶液浸透30 min,真空干燥仪(0.2~0.4 kg/cm2)室温条件下干燥2 h以上;使用Epon812包埋,40 ℃条件下聚合2 h,60 ℃条件下聚合4 h,80 ℃条件下聚合10 h;沿视神经与眼轴平行的平面进行半薄切片,切片厚度为1 000 nm,甲苯胺蓝染色1 min,确定视网膜的位置及结构,再行超薄切片,切片厚度为70 nm;醋酸铀和柠檬酸铅染色液室温下染色10 min,漂洗后透射电子显微镜下观察并拍照。
1.3 统计学方法
采用SPSS 26.0统计学软件进行统计分析。计量数据资料经Shapiro-Wilk检验证实接近正态分布,以mean±SD表示,经Levene检验证实方差齐。各组间测量指标总体差异比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组不同时间点培养细胞的形态学变化
倒置显微镜下观察可见,随培养时间的延长,BSS组和CEIIS组细胞数量逐渐减少,正常对照组细胞数逐渐增多。培养48 h,BSS组培养基中可见大量漂浮细胞,细胞排列紊乱,形态不均一;CEIIS组培养细胞排列致密整齐,细胞形态和大小均一。BSS组和CEIIS组细胞数量均少于正常对照组(图1)。

图2 各组3种细胞的细胞凋亡和细胞周期流式细胞分析图 A:细胞凋亡流式细胞分析图 B:细胞周期流式细胞分析图 BSS:平衡盐灌洗液;CEIIS:复方电解质眼内灌注液;HCEC:人角膜内皮细胞;HRPE:人视网膜色素上皮;RGC:视网膜神经节细胞Figure 2 Apoptosis and cell cycle of three kinds of cells in each group analyzed by flow cytometry A:Flow cytometric analysis of apoptosis B:Flow cytometric analysis of cell cycle BSS:balanced saline solution;CEIIS:compound electrolyte intraocular irrigating solution;HCEC:human corneal endothelial cells;HRPE:human retinal pigment epithelium;RGC:retinal ganglion cells
2.2 各组细胞状态比较
正常对照组、BSS组和CEIIS组间HRPE细胞和RGC的细胞凋亡率总体比较差异均有统计学意义(HRPE:F=37.287,P<0.001;RGC:F=7.378,P=0.024),HCEC细胞凋亡率总体比较差异无统计学意义(F=3.919,P=0.082)。BSS组HRPE细胞和RGC的细胞凋亡率分别为(37.157±6.918)%和(29.993±12.330)%,明显高于CEIIS组的(4.163±1.310)%和(6.337±1.903)%,差异均有统计学意义(P=0.003、0.045);BSS组和CEIIS组HCEC细胞凋亡率分别为(16.380±8.969)%和(3.267±0.265)%,组间比较差异无统计学意义(P=0.107)(图2A)。
正常对照组、BSS组和CEIIS组间HCEC和HRPE细胞的G0/G1+S期比例总体比较差异均无统计学意义(HCEC:F=2.226,P=0.189;HRPE:F=2.634,P=0.151)。各组间RGC的G2/M期比例总体比较差异有统计学意义(F=8.354,P=0.018);其中BSS组RGC的G2/M期比例高于DMEM组和CEIIS组,差异均有统计学意义(P=0.047、0.024)(图2B)。各培养时间点CEIIS组HCEC、HRPE细胞和RGC的增生A值均明显高于BSS组,差异均有统计学意义(均P<0.05)(表2)。
2.3 各组不同细胞凋亡相关蛋白表达比较
细胞免疫荧光染色显示,BSS组HCEC、HRPE细胞和RGC中细胞色素C、bax、caspase-3和caspase-9均呈强荧光表达,荧光强度强于正常对照组和CEIIS组,bcl-2荧光强度弱于CEIIS组;BSS组各细胞ZO-1呈弱荧光表达,荧光强度低于正常对照组和CEIIS组(图3)。
2.4 各组不同细胞中LDH和SDH释放量比较
培养12、24、48 h时BSS组3种细胞中LDH释放水平均高于CEIIS组,差异均有统计学意义(均P<0.001);不同时间点BSS组3种细胞中LDH释放水平均高于相应时间点正常对照组,差异均有统计学意义(均P<0.001);培养12 h时,CEIIS组HRPE细胞、RGC中LDH释放水平高于正常对照组,HCEC细胞中LDH释放水平低于正常对照组,差异均有统计学意义(均P<0.001);培养24 h时,CEIIS组3种细胞LDH释放水平均高于相应时间点正常对照组,差异均有统计学意义(均P<0.001);培养48 h时,CEIIS组HCEC、HRPE细胞LDH释放水平高于正常对照组,RGC的LDH释放水平低于正常对照组,差异均有统计学意义(均P<0.001)(表3)。

表2 各组不同时间点3种细胞增生A值比较(mean±SD)Table 2 Comparison of proliferation absorbance value of HCEC,HRPE cells and RGC among different groups at various timepoints (mean±SD,A value)组别样本量培养12 h不同细胞A值培养24 h不同细胞A值培养48 h不同细胞A值HCECHRPERGCHCECHRPERGCHCECHRPERGC正常对照组30.350±0.0360.736±0.0860.647±0.0790.435±0.0441.524±0.0611.317±0.0370.648±0.0760.939±0.1000.925±0.027BSS组30.122±0.0150.067±0.0030.188±0.0040.056±0.0030.079±0.0200.197±0.0350.060±0.0040.112±0.0150.266±0.042CEIIS组30.315±0.017b0.849±0.081b0.382±0.028ab0.225±0.020ab1.385±0.171b0.529±0.110ab0.120±0.005ab0.724±0.083ab0.870±0.109bF值76.588114.74567.304138.130170.512216.855161.44996.37683.633P值<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001 注:与正常对照组比较,aP<0.05;与BSS组比较,bP<0.05(单因素方差分析,LSD-t检验) HCEC:人角膜内皮细胞;HRPE:人视网膜色素上皮;RGC:视网膜神经节细胞;BSS:平衡盐溶液;CEIIS:复方电解质眼内灌注液 Note:Compared with the normal control group,aP<0.05;compared with the BSS group,bP<0.05 (One-way ANOVA,LSD-t test) HCEC:human corneal endothelial cells;HRPE:human retinal pigment epithelium;RGC:retinal ganglion cells;BSS:balanced saline solution;CEIIS:compound electrolyte intraocu-lar irrigating solution
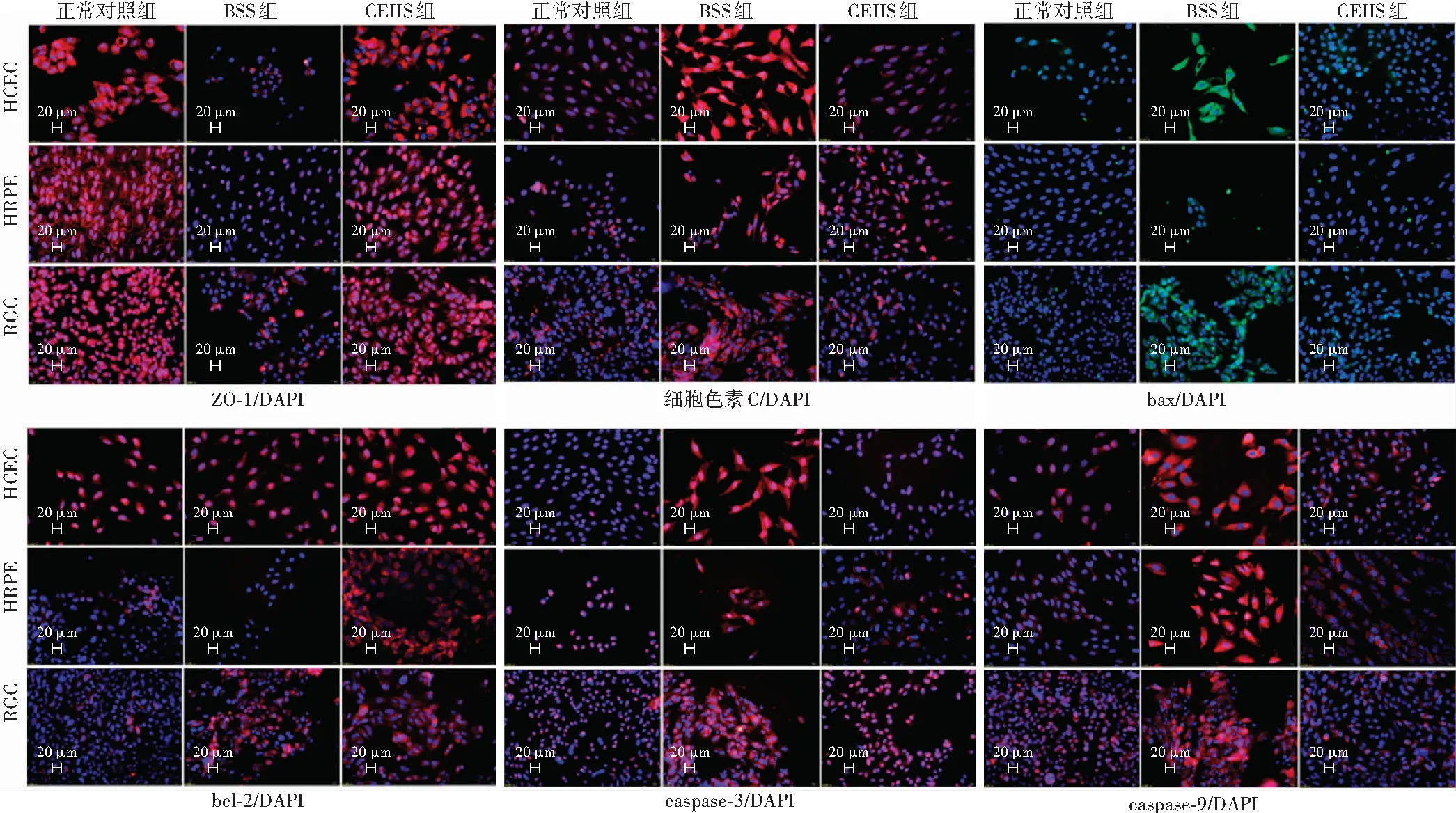
图3 各组3种细胞ZO-1、bax、bcl-2、细胞色素C、caspase-3和caspase-9免疫荧光染色图 (×200,标尺=20 μm) BSS组各细胞中细胞色素C、bax、caspase-3和caspase-9蛋白荧光强度强于正常对照组和CEIIS组,bcl-2蛋白荧光强度弱于CEIIS组,ZO-1蛋白荧光强度弱于正常对照组和CEIIS组 BSS:平衡盐灌洗液;CEIIS:复方电解质眼内灌注液;HCEC:人角膜内皮细胞;HRPE:人视网膜色素上皮;RGC:视网膜神经节细胞Figure 3 Immunofluorescence staining of three cells for ZO-1,bax,bcl-2,cytochrome c,caspase-3 and caspase-9 in each group (×200,bar=20 μm) The fluorescence intensity of cytochrome C,bax,caspase-3 and caspase-9 proteins in the BSS group was stronger than that in the normal control group and CEIIS group.The fluorescence intensity of bcl-2 protein in CEIIS group was stronger than that in the BSS group.The fluorescence intensity of ZO-1 protein in the BSS group was weaker than that in the normal control group and CEIIS group BSS:balanced saline solution;CEIIS:compound electrolyte intraocular irrigating solution;HCEC:human corneal endothelial cells;HRPE:human retinal pigment epithelium;RGC:retinal ganglion cells
培养12 h时,BSS组HCEC和RGC的SDH释放水平均高于CEIIS组,差异均有统计学意义(均P<0.05),BSS组HRPE细胞SDH释放水平与CEIIS组比较差异无统计学意义(P=0.359);培养24 h时,BSS组HCEC与HRPE细胞SDH释放水平高于CEIIS组,差异有统计学意义(P<0.05);培养48 h时,BSS组3种细胞SDH释放水平均高于CEIIS组,差异均有统计学意义(均P<0.05)(表4)。
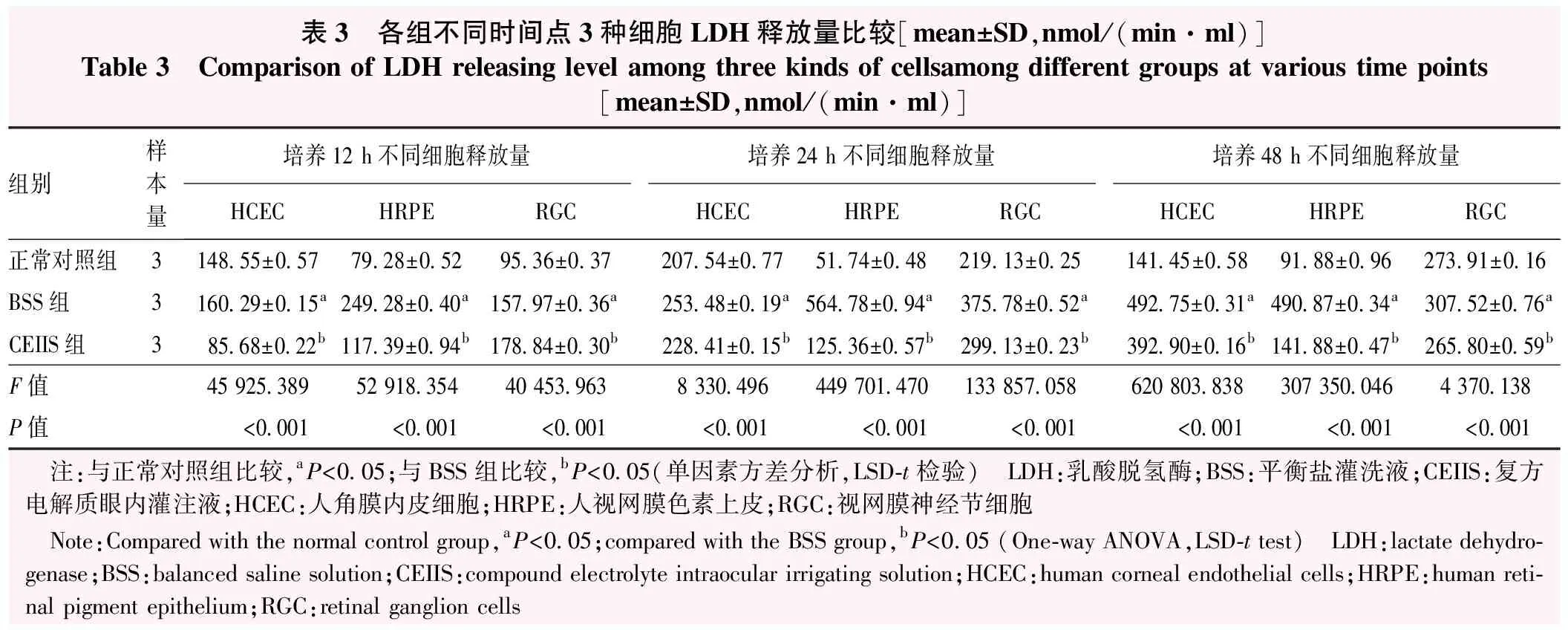
表3 各组不同时间点3种细胞LDH释放量比较[mean±SD,nmol/(min·ml)]Table 3 Comparison of LDH releasing level among three kinds of cellsamong different groups at various time points[mean±SD,nmol/(min·ml)]组别样本量培养12 h不同细胞释放量培养24 h不同细胞释放量培养48 h不同细胞释放量HCECHRPERGCHCECHRPERGCHCECHRPERGC正常对照组3148.55±0.5779.28±0.5295.36±0.37207.54±0.7751.74±0.48219.13±0.25141.45±0.5891.88±0.96273.91±0.16BSS组3160.29±0.15a249.28±0.40a157.97±0.36a253.48±0.19a564.78±0.94a375.78±0.52a492.75±0.31a490.87±0.34a307.52±0.76aCEIIS组385.68±0.22b117.39±0.94b178.84±0.30b228.41±0.15b125.36±0.57b299.13±0.23b392.90±0.16b141.88±0.47b265.80±0.59bF值45 925.38952 918.35440 453.9638 330.496449 701.470133 857.058620 803.838307 350.0464 370.138P值<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001 注:与正常对照组比较,aP<0.05;与BSS组比较,bP<0.05(单因素方差分析,LSD-t检验) LDH:乳酸脱氢酶;BSS:平衡盐灌洗液;CEIIS:复方电解质眼内灌注液;HCEC:人角膜内皮细胞;HRPE:人视网膜色素上皮;RGC:视网膜神经节细胞 Note:Compared with the normal control group,aP<0.05;compared with the BSS group,bP<0.05 (One-way ANOVA,LSD-t test) LDH:lactate dehydro-genase;BSS:balanced saline solution;CEIIS:compound electrolyte intraocular irrigating solution;HCEC:human corneal endothelial cells;HRPE:human reti-nal pigment epithelium;RGC:retinal ganglion cells
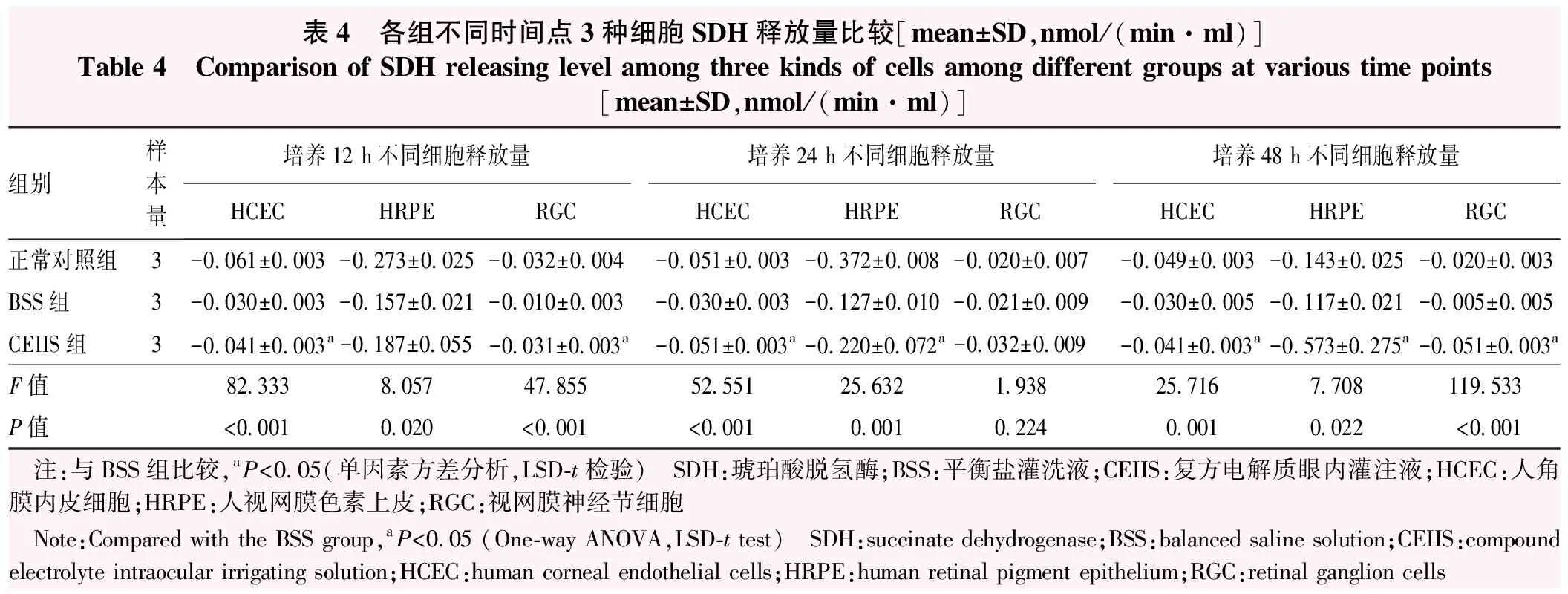
表4 各组不同时间点3种细胞SDH释放量比较[mean±SD,nmol/(min·ml)]Table 4 Comparison of SDH releasing level among three kinds of cells among different groups at various time points[mean±SD,nmol/(min·ml)]组别样本量培养12 h不同细胞释放量培养24 h不同细胞释放量培养48 h不同细胞释放量HCECHRPERGCHCECHRPERGCHCECHRPERGC正常对照组3-0.061±0.003-0.273±0.025-0.032±0.004-0.051±0.003-0.372±0.008-0.020±0.007-0.049±0.003-0.143±0.025-0.020±0.003BSS组3-0.030±0.003-0.157±0.021-0.010±0.003-0.030±0.003-0.127±0.010-0.021±0.009-0.030±0.005-0.117±0.021-0.005±0.005CEIIS组3-0.041±0.003a-0.187±0.055-0.031±0.003a-0.051±0.003a-0.220±0.072a-0.032±0.009-0.041±0.003a-0.573±0.275a-0.051±0.003aF值82.3338.05747.85552.55125.6321.93825.7167.708119.533P值<0.0010.020<0.001<0.0010.0010.2240.0010.022<0.001 注:与BSS组比较,aP<0.05(单因素方差分析,LSD-t检验) SDH:琥珀酸脱氢酶;BSS:平衡盐灌洗液;CEIIS:复方电解质眼内灌注液;HCEC:人角膜内皮细胞;HRPE:人视网膜色素上皮;RGC:视网膜神经节细胞 Note:Compared with the BSS group,aP<0.05 (One-way ANOVA,LSD-t test) SDH:succinate dehydrogenase;BSS:balanced saline solution;CEIIS:compound electrolyte intraocular irrigating solution;HCEC:human corneal endothelial cells;HRPE:human retinal pigment epithelium;RGC:retinal ganglion cells
2.5 各组实验兔手术前后视网膜细胞凋亡情况及凋亡相关蛋白表达变化
术前BSS组和CEIIS组术眼视网膜细胞凋亡数分别为(15.8±10.4)个/高倍视野和(19.8±9.1)个/高倍视野,2个组比较差异无统计学意义(P=0.531);BSS组和CEIIS组中bax和细胞色素C蛋白呈弱表达。玻璃体切割术后24 h,视网膜凋亡细胞主要位于视网膜内核层和RGC层;细胞色素C主要表达于光感受器层。BSS组细胞色素C表达强于CEIIS组;bax蛋白主要表达于视网膜外核层,2个组间视网膜bax蛋白表达强度无明显差别;术后BSS组视网膜细胞凋亡数为(135.2±22.8)个/高倍视野,高于CEIIS组的(81.3±17.7)个/高倍视野,差异有统计学意义(t=4.175,P=0.002)(图4)。

图4 各组术前及术后24 h术眼视网膜细胞凋亡、细胞色素C及bax免疫组织化学染色图(DAB ×400,标尺=50 μm) 术前BSS组和CEIIS组术眼视网膜中TUNEL阳性细胞凋亡数均较低,术后BSS组视网膜中TUNEL阳性细胞染色明显强于CEIIS组,主要位于视网膜内核层和RGC层。术前BSS和CEIIS组术眼视网膜中细胞色素C蛋白呈弱表达,术后BSS组细胞色素C表达强于CEIIS组,主要表达在光感受器层。术前BSS和CEIIS组术眼视网膜中bax蛋白呈弱表达,术后BSS组和CEIIS组视网膜中bax蛋白表达均增强,且2个组间无明显差别 BSS:平衡盐灌洗液;CEIIS:复方电解质眼内灌注液Figure 4 Immunohistochemical staining of retinal cell apoptosis,cytochrome C and bax in various groups before and 24 hours after surgery (DAB ×400,bar=50 μm) The number of apoptotic TUNEL-positive cells in the retina of the BSS group and CEIIS group were lower before operation.After operation,the TUNEL-positive cell staining in the retina of the BSS group was obviously stronger than that of the CEIIS group,which was mainly located in the inner nuclear layer and RGC layer.Before operation,cytochrome C protein was weakly expressed in the retina of BSS and CEIIS groups.After operation,the expression of cytochrome C in the BSS group was stronger than that in the CEIIS group,which mainly expressed in the photoreceptor layer.Weak expression of bax protein was found in the retina of BSS and CEIIS groups before operation,and the expression of bax protein was increased in the retina of BSS and CEIIS groups after operation,and there was no significant difference between the two groups BSS:balanced saline solution;CEIIS:compound electrolyte intraocular irrigating solution
2.6 各组实验兔视网膜各层结构变化
BSS组术前和术后神经节细胞层+内丛状层+内核层厚度分别为(131.67±4.50)μm和(132.00±4.90)μm,外丛状层+外核层厚度分别为(111.67±15.92)μm和(112.33±14.97)μm,术前与术后各厚度值比较,差异均无统计学意义(均P>0.05);CEIIS组术前和术后神经节细胞层+内丛状层+内核层厚度分别为(130.67±3.40)μm和(134.67±2.05)μm,外丛状层+外核层厚度分别为(144.33±20.53)μm和(145±15.25)μm,术前与术后各厚度值比较,差异均无统计学意义(均P>0.05)。术后未见视网膜脱离发生(图5)。
2.7 实验兔视网膜超微结构变化
透射电子显微镜检查显示,实验兔非手术眼视网膜组织结构层次清楚,细胞排列致密,外核层细胞核排列规则;BSS组和CEIIS组术后术眼视网膜感光层细胞排列疏松,视网膜光感受器外节膜盘大量脱落,出现叠状结构解离和空泡变性,部分细胞核皱缩,RPE细胞色素颗粒减少,线粒体肿胀,内膜嵴消失,出现空泡,以BSS组更为严重(图6)。

图5 手术前后BSS组和CEIIS组术眼视网膜OCT图 术后24 h各组术眼视网膜结构和厚度与术前比较均无明显变化 BSS:平衡盐灌洗液;CEIIS:复方电解质眼内灌注液Figure 5 Retinal OCT images of the BSS group and CEIIS group after operation There were no significant changes in retinal structure and thickness between before and 24 hours after operation BSS:balanced saline solution;CEIIS:compound electrolyte intraocular irrigating solution

图6 各组实验眼术后视网膜超微结构变化 透射电子显微镜检查结果证实2个组术后视网膜有轻微的组织学改变,术后24 h细胞密度较术前稀疏,光感受器外节膜盘大量脱落,出现叠状结构解离和空泡变性,BSS组比CEIIS组更严重 BSS:平衡盐灌洗液;CEIIS:复方电解质眼内灌注液Figure 6 Retinal ultrastructural changes of experimental eyes in each group after operation Slight histological changes were found in the retina of BSS and CEIIS groups after operation with a transmission electron microscope.The cell density at 24 hours after operation was sparser compared with that before operation.A large number of membrane discs in photoreceptor outer segment fell off.Dissociation of overlapped structure and the vacuolar degeneration were observed in the two groups,which were more serious in BSS group than CEIIS group BSS:balanced saline solution;CEIIS:compound electrolyte intraocular irrigating solution
2.8 各组实验眼视网膜功能比较
术前BSS组与CEIIS组术眼a波、b波振幅值比较差异均无统计学意义(P=0.374、0.159)。术后24 h,BSS组术眼暗适应0.01(cd·s/m2)ERG b波振幅较术前显著降低,差异有统计学意义(P=0.037);CEIIS组术眼手术前后b波振幅比较差异无统计学意义(P=0.123)。术后24 h,BSS组术眼暗适应3.0(cd·s/m2)ERG a、b波振幅较术前均明显下降,差异均有统计学意义(P=0.026、0.010);CEIIS组兔眼术后a、b波振幅较术前均有所下降,但差异均无统计学意义(P=0.093、0.159)。BSS组和CEIIS组术眼术后OPs波总振幅较术前均有所下降,但差异均无统计学意义(P=0.642、0.258)。BSS组术眼术前30Hz闪烁光ERG振幅为(9.62±3.22)μV,术后降低至(1.79±1.04)μV,差异有统计学意义(t=4.777,P=0.002),CEIIS组术眼30Hz闪光ERG振幅从术前的(9.68±5.14)μV降低至术后的(3.06±1.04)μV,差异无统计学意义(t=1.785,P=0.149)(表5~7)。
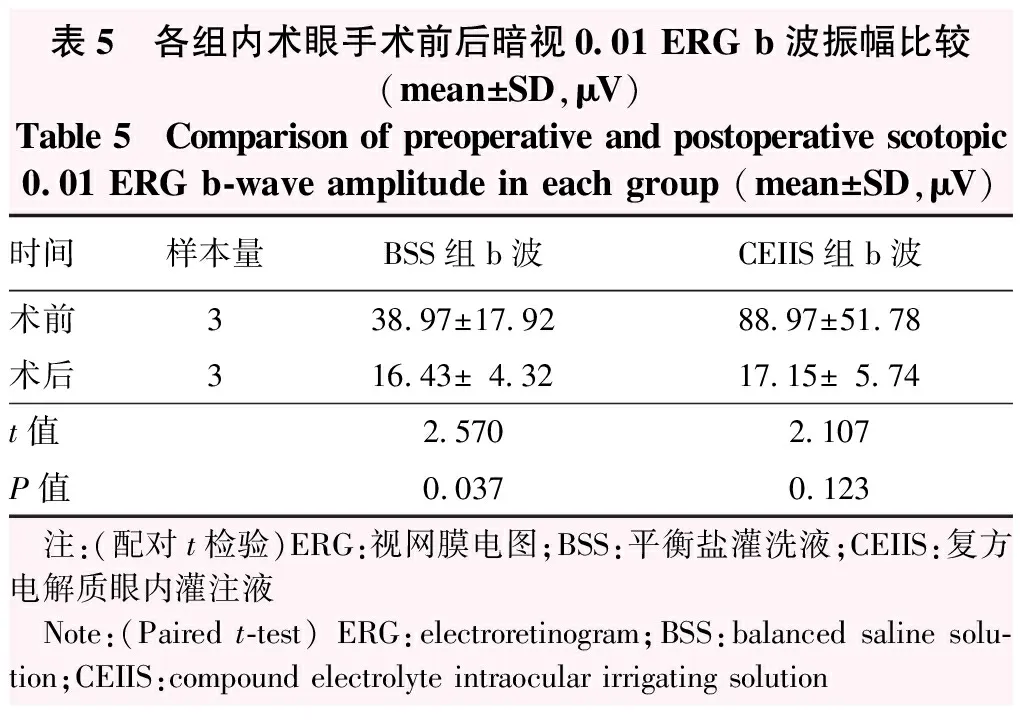
表5 各组内术眼手术前后暗视0.01 ERG b波振幅比较(mean±SD,μV)Table 5 Comparison of preoperative and postoperative scotopic0.01 ERG b-wave amplitude in each group (mean±SD,μV)时间样本量BSS组b波CEIIS组b波术前338.97±17.9288.97±51.78术后316.43±4.3217.15±5.74t值2.5702.107P值0.0370.123 注:(配对t检验)ERG:视网膜电图;BSS:平衡盐灌洗液;CEIIS:复方电解质眼内灌注液 Note:(Paired t-test) ERG:electroretinogram;BSS:balanced saline solu-tion;CEIIS:compound electrolyte intraocular irrigating solution
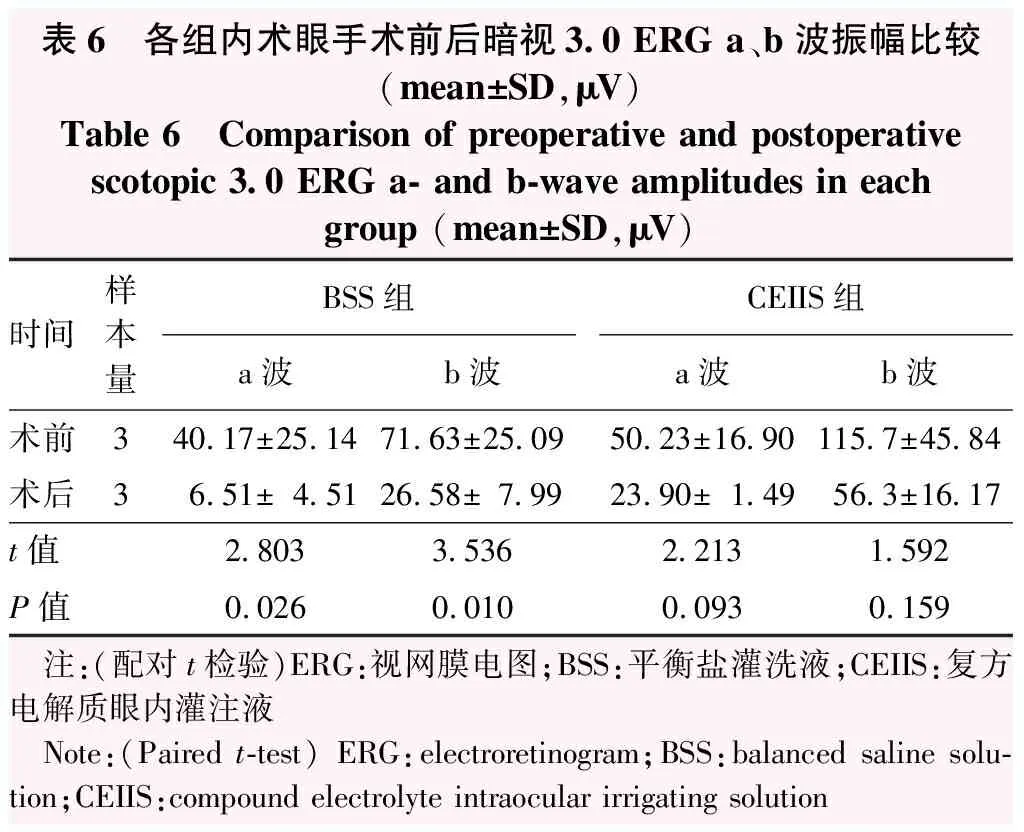
表6 各组内术眼手术前后暗视3.0 ERG a、b波振幅比较(mean±SD,μV)Table 6 Comparison of preoperative and postoperativescotopic 3.0 ERG a- and b-wave amplitudes in eachgroup (mean±SD,μV)时间样本量BSS组CEIIS组a波b波a波b波术前340.17±25.1471.63±25.0950.23±16.90115.7±45.84术后36.51±4.5126.58±7.9923.90±1.4956.3±16.17t值2.8033.5362.2131.592P值0.0260.0100.0930.159 注:(配对t检验)ERG:视网膜电图;BSS:平衡盐灌洗液;CEIIS:复方电解质眼内灌注液 Note:(Paired t-test) ERG:electroretinogram;BSS:balanced saline solu-tion;CEIIS:compound electrolyte intraocular irrigating solution

表7 各组内术眼手术前后明视3.0 ERG a、b波振幅比较(mean±SD,μV)Table 7 Comparison of preoperative and postoperativephotopic 3.0 ERG a- and b-wave amplitudes in eachgroup (mean±SD,μV)时间样本量BSS组CEIIS组a波b波a波b波术前37.91±5.2557.27±20.8812.29±5.7995.17±43.34术后36.01±2.3520.83±5.233.13±2.5325.90±4.68t值0.6581.8872.0512.247P值0.5320.1570.1100.088 注:(配对t检验)ERG:视网膜电图;BSS:平衡盐灌洗液;CEIIS:复方电解质眼内灌注液 Note:(Paired t-test) ERG:electroretinogram;BSS:balanced saline solu-tion;CEIIS:compound electrolyte intraocular irrigating solution
3 讨论
由于玻璃体切割术有导致眼内炎症的风险或对视网膜功能的恢复产生影响,因此术中选择最佳的眼内灌注溶液对术眼视觉质量和患者生活质量的改善至关重要。0.9%氯化钠溶液、BSS、透明质酸盐和硅油等均可作为玻璃体切割术的眼内填充物[8-10],但从理论上讲CEIIS所含成分更接近视网膜及其他眼组织代谢所需组分。
HCEC、HRPE细胞和RGC对玻璃体切割术后视觉功能的恢复至关重要。本研究采用BSS和CEIIS对这些细胞进行体外培养,发现BSS和CEIIS对这些细胞的增生活力均有一定的影响,但CEIIS条件下的细胞活力优于BSS。本研究采用免疫组织化学染色法证实BSS组细胞ZO-1的表达水平明显低于CEIIS组,推测主要是由BSS中碳酸氢盐和葡萄糖成分缺失所致。此外,3种细胞对葡萄糖成分的敏感性有所不同,HRPE细胞反应最为敏感,推测HRPE细胞对碳酸氢盐和葡萄糖的依赖性可能高于其他细胞。研究发现,碳酸氢盐对维持正常视网膜功能是必不可少的,葡萄糖在维持细胞活力、减少凋亡、维持细胞周期、保持细胞间的正常连接和通讯、减少氧化还原介导的损伤及维持线粒体结构和功能等方面尤为重要,这可能是体外细胞实验中CEIIS组细胞活性好、损伤小的主要原因[11-13]。
为了验证离体实验的研究结果,本研究进行了相应的在体动物实验,结果显示玻璃体切割术后视网膜的OCT影像未见明显变化。然而,透射电子显微镜下观察可见术后视网膜超微结构发生轻微改变,本研究结果与孟自军等[14]和Hasumura等[15]的研究结果一致。Terasaki[16]研究发现,玻璃体切割术术中填充液释放到玻璃体中的化学介质可引起视网膜功能下降,OCT检查结果也提示视网膜厚度的减少有助于其功能恢复。然而,本研究结果未发现手术前后视网膜厚度变化。
本研究采用闪光ERG检查评估实验眼视网膜功能,结果显示BSS组和CEIIS组术眼均可见视网膜内层和外层损伤,表现为玻璃体切割术后a波和b波振幅明显降低。有研究报道,玻璃体切割术后皮质可能会对视网膜产生直接损害作用,尤其是神经纤维层,同时也会影响视盘的血液供应[17],与本研究中离体细胞学实验结果相符。有研究发现,玻璃体切割术后视网膜早期的损伤,如内界膜脱落缺损或丢失、视神经纤维层外露、内丛状层和内核层水肿等主要发生于视网膜内层[15-18]。此外,术后并发症,如暂时性视网膜水肿和暂时性视网膜代谢状态的紊乱最终导致ERG结果的改变。
本研究结果提示玻璃体切割术会对视网膜内层造成影响。研究发现BSS组实验眼暗适应3.0刺激下a波、b波振幅低于CEIIS组,既往用空气或硅油代替眼内介质以及在眼压急剧升高的时期也同样观察到了可逆的振幅降低[19]。然而,ERG结果显示,玻璃体切割术中使用不同成分的眼内介质时,术后视网膜的功能也会存在差异。Mizote等[20]和Hirooka等[21]研究发现兔眼玻璃体切割术中压力引起的视网膜缺血后7 d,RGC数量减少,视网膜内丛状层厚度下降,而玻璃体切割术中用D-allose进行眼内冲洗可保护视网膜免受缺血损伤。本研究结果也显示,玻璃体切割术后用含有葡萄糖成分的CEIIS进行眼内灌注后ERG各波振幅较不含葡萄糖成分的BSS更高,这可能是由于葡萄糖可为视网膜代谢提供能量,从而保护视网膜免受早期损伤所致。因此,在玻璃体切割中使用含有葡萄糖成分的眼内灌注溶液有助于视网膜功能的恢复。
玻璃体切割术后视网膜功能和结构在较长时间内不会发生明显改变[17-18]。本研究中离体细胞学实验结果显示,CEIIS和BSS眼内灌注液对眼组织细胞的影响有明显差异,而在体实验结果显示,术后短时间内视网膜功能和结构未见明显差异,表明在体内这种应激可能引发了更为复杂和有效的保护机制,值得进一步研究。
综上所述,本研究结果表明,玻璃体切割术中CEIIS灌注液的应用对视网膜的保护作用优于BSS灌注液,灌注液中碳酸氢盐和葡萄糖成分可能在玻璃体切割术中起到重要作用。
利益冲突所有作者均声明不存在利益冲突
