PD‐1/PD‐L1 单抗在靶向耐药和肺癌术前辅助治疗中的疗效分析研究进展
2021-12-07综述唐东方陈晓宇朱训夏付文韬沈晓咏审校
刘 洋(综述) 唐东方 陈晓宇 朱训夏 康 宁 付文韬 沈晓咏(审校)
(复旦大学附属华东医院胸外科 上海 200040)
肺癌是全世界发病率和死亡率最高的恶性肿瘤之一[1]。 目前晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的治疗手段主要有化疗、放疗、靶向及免疫治疗等。然而,肺癌患者会对化疗产生严重的耐药性,这是公认的难题。近年来,有学者发现NSCLC 中突变频率最高的EGFR阳性率约为10%~30%;ALK融合基因位列第二,其敏感突变约有5%[3]。以IPSSA 研究等为代表的10 个临床研究表明:吉非替尼较传统化疗能够显著提高患者的客观缓解率(objective response rate,ORR)及生活质量,明显延长患者的无进展生存期(progress free survival,PFS)[4]。靶向治疗在取得显著的临床疗效时,继发性耐药是一个不可忽略的问题。目前公认:常规术前辅助化疗虽然能够有效减灭局部肿瘤灶和淋巴结转移灶,降低临床分期,提高手术切除率和术后生存率,但也会增加患者围手术期并发症的概率,提高手术风险。因此如何减少相关并发症,使患者最终获益仍需解决。随着肿瘤免疫学的不断进展,肿瘤的免疫治疗被认为是未来最有希望治愈恶性肿瘤的治疗方式。研究发现,以PD-1 为靶点的纳武单抗(Nivolumab)及帕博丽珠单抗(Pembrolizumab)和以PD-L1 为靶点的阿特珠单抗(Atezolizumab)等具有明显的临床疗效[5]。目前,国内外仅有极少数文献对免疫治疗能否应用于解决肺癌患者在靶向治疗后产生耐药性的难题进行系统性探究及综述,临床上多将化疗、放疗应用于肺癌术前辅助治疗,而免疫治疗在此方面的应用仍无详细说明。本文详细说明PD-1/PD-L1 信号通路的作用,PD-1/PD-L1 单抗在解决肺癌患者靶向治疗后产生耐药性的重要作用,在肺癌术前辅助治疗方面也具有极大的临床应用潜力。
PD‐1/PD‐L1 的表达及信号通路PD-1 是一类Ⅰ型跨膜糖蛋白,属于免疫球蛋白超家族(B7-CD28),相对分子质量为50000~55000[6]。同时,PD-1 也是一种免疫抑制受体,在活化的T 细胞、自然杀伤细胞(NK cell)、B 细胞、间充质干细胞和单核细胞中均有表达,能通过调节外周组织中T 细胞识别抗原调控正常机体的免疫反应,阻止肿瘤相关疾病的进展[7]。PD-L1 和PD-L2 为PD-1 的配体,两者也在免疫反应中起到重要的负性调控作用[8]。研究发现肿瘤细胞主要表达PD-L1,属于B7 家族,是一类细胞表面糖蛋白[9]。也有研究发现PD-L1 的表达水平和药物疗效具有一定的相关性,其表达水平越高,免疫抑制剂应用的疗效越好[11]。
PD-L1 和PD-1 结合后形成的通路有T 细胞抑制作用,能够阻止T 细胞增殖和扩散[12]。Yi 等[13]证明肿瘤获得性免疫逃逸是由PD-1/PD-L1 途径介导的,所以可通过阻断PD-1 和PD-L1 通路正向促进抗肿瘤免疫反应。Jacot 等[14]发现PD-1 和PD-L1 结合后通过招募蛋白酪氨酸磷酸酶1(SHP-1)和2(SHP-2),抑制下游P13K/Akt通路的磷酸化及mTOR和ERK2的活化,最终减弱T 细胞在肿瘤微环境中的免疫杀伤作用,促进肿瘤细胞生长。临床研究[15]证明,PD-1/PD-L1 抑制剂在晚期NSCLC 患者中疗效显著,并且发现在应用PD-L1 抑制剂治疗时PD-L1 阳性患者的总体反应率高于PD-L1 阴性人群(34.1%vs.19.9%)。近年来PD-1/PD-L1 抑制剂在肿瘤治疗上取得了重大突破。Nivolumab 是晚期NSCLC 的二线治疗方案,适用于EFGR基因突变阴性和ALK阴性、既往接受过含铂方案化疗后出现进展或不可耐受的局部晚期或转移性NSCLC 患者[17]。Atezolizumab 被推荐用于含铂化疗期间或之后出现病情恶化的转移性NSCLC,以及出现EGFR/ALK基因突变的NSCLC 患者使用EGFR/ALK分子靶向药物后治疗无效[18]。 2019年5月,Pembrolizumab 联合化疗(培美曲塞+卡铂)获批用于EGFR/ALK基因突变阴性、转移性非鳞癌患者的一线治疗[19]。2019年9月,Pembrolizumab 获批用于PD-L1 表达阳性、EFGR/ALK突变阴性或局部晚期转移性NSCLC的单药一线治疗[20]。 PD-1/PD-L1 抑制剂越来越多地被推荐应用于肺癌患者的临床治疗,其中一些已应用于NSCLC 患者的一线治疗,应用前景令人期待。
PD‐1/PD‐L1 抑制剂在肺癌靶向耐药患者中的应用肺癌的生长程度与肺癌细胞基因突变密切相 关,如:EGFR突变、ROSI重 排、KRAS突变、RET重排、EML4-ALK重 排、MET扩增、HER2突变 及BRAF突变等[21]。肺腺癌中约有60% 存在基因驱动突变,鳞癌患者中也存在相关基因驱动突变[22]。 随着表皮生长因子受体(epidermal growth factor receptor,EGFR)敏感突变以及EGFR酪氨酸激酶抑制剂(TKI)的研制成功(后文以EGFR-TKI表示),分子靶向治疗已成为肺癌治疗的一线方案。
自2015年来,很多临床研究均证实肺癌靶向药物能够显著改善患者预后。然而,越来越多的靶向药物被发现可产生耐药性,导致了肿瘤的进展。在LUX-Lung5 临床试验中发现:阿法替尼和埃罗替尼/吉非替尼治疗失败的肺癌患者经阿法替尼和紫杉醇联合化疗后,该组患者的PFS 和ORR 均优于单药患者[23]。然而,也有学者认为EGFR-TKI 联合化疗时,前者使肿瘤细胞停滞在G0 期,而常规化疗药物主要对处于S 期的肺癌细胞具有杀伤作用,因此两者联合使用时会相互拮抗[24]。目前靶向药物联合化疗是否能改善靶向药物耐药性及其机制仍不明确。2017,PACIFIC 报道了对三期不能手术的肺癌患者在使用同步放化疗之后使用PD-L1 抑制剂Durvalumab 的疗效数据:研究组患者的PFS 明显延长(16.8 个月vs.5.6 个月),这一发现将免疫治疗带入了肺癌的临床治疗视线中。
随着免疫治疗越来越多地应用于肺癌患者的临床治疗,很多学者将免疫治疗单药或联合靶向治疗作为一种新的方法来解决靶向耐药这一难题(表1)。Nivolumab 是第一个通过美国FAD 批准的免疫检查点抑制剂,在CheckMate-063 的Ⅱ期临床试验中,Nivolumab 单药治疗提高了晚期耐药肺鳞癌患者的ORR 以及中位生存期(8.2 个月),且1年生存率可达40.8%[25]。有关EGFR-TKI 与PD-1/PDL1 抑制剂联合使用的临床试验发现,靶向治疗联合免疫抑制药能够提高机体抗肿瘤的免疫反应,推迟耐药的发生,其机制可能是PD-1/PD-L1 抑制剂能够通过降低MDSCs(髓源性抑制细胞)和Treg(调节性T 细胞)的活性,重塑肿瘤微环境;使肿瘤周围血管结构正常化,有利于T 细胞浸润于肿瘤组织并进行细胞招募;通过T 细胞介导的肿瘤细胞杀伤作用,提高机体抗肿瘤的免疫反应[26]。 Ⅰ期TATTON 研究(NCT02143466)的初步结果表示:Osimertinib 联 合Durvalumab 治疗EGFRT790M 突变NSCLC 患者的ORR 为57%,然而患者间质性肺病的发生率却比两种药品单独使用高出数倍,因此3 期临床试验随之停止[27]。综上可见,靶向联合免疫治疗并不能完全解决靶向耐药的问题,可能出现疗效没有明显增强,不良反应反而大大增加的情形。 2018年,NCT020847423 临 床 研 究 发 现Durvalumab 能显著提高奥希替尼耐药及肿瘤细胞PD-L1 高表达NSCLC患者 的ORR(12.2%vs.3.6%)[28]。Gainor等[29]发现:EGFR突变及ALK基因重排的NSCLC 患者组使用PD-1/PD-L1 抑制剂后ORR 较低(3.6%vs.23.3%),可能是该部分患者肿瘤微环境中PD-L1 表达及CD8+浓度较低的缘故。Gettinger 等[30]同样发现,EGFR突变及ALK基因重排的NSCLC 患者体内CD8+淋巴细胞浸润浓度低,无法产生炎症性肿瘤微环境,这可能是该类患者对于PD-1/PD-L1 抑制剂反应较差的原因之一。目前更多的免疫治疗相关的临床试验正在紧密开展中。
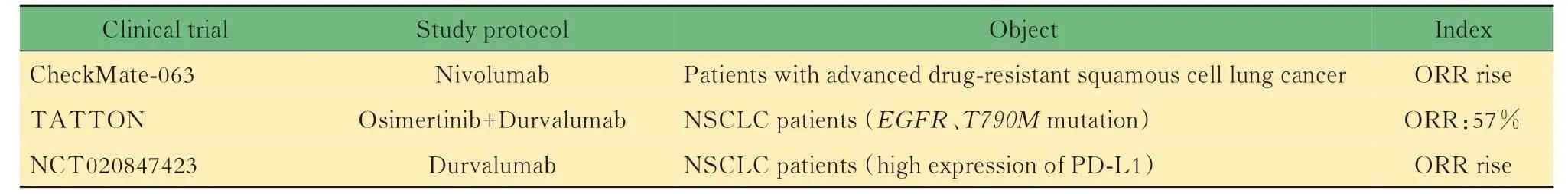
表1 免疫治疗应用于靶向药物耐药性产生患者的相关临床试验汇总Tab 1 Summary of clinical trials of immunotherapy in patients with targeted drug‐resistance
PD‐1/PD‐L1 在术前辅助治疗中的应用在免疫治疗未进入临床应用前,术前辅助治疗一般以化疗为主,又称为手术前化疗,即在手术前经过全身化疗达到有效减灭局部肿瘤和淋巴结转移灶、降低临床分期、提高手术切除率和术后生存率。然而,新辅助化疗却使得患者出现胸内组织纤维化和血管鞘膜增厚,不同程度损伤了肺动脉血管的结构,增加手术并发症的概率和手术风险[31]。术前以铂类为基础的化疗可部分提高生存率(约5.4%),然而超过60% 的患者会出现Ⅲ级以上的严重不良反应[32]。
免疫治疗的诞生使术前辅助治疗有了更多的选择(表2)。2018年4月,关于Nivolumab 应用于新辅助治疗NSCLC 的研究成果首次发表,对于早期可手术治疗的NSCLC 患者,Nivolumab(新辅助治疗)导致的毒副反应较少,对延迟手术时间没有影响,45% 的患者达到显著病理缓解[33]。Nivolumab同时也可成功诱导外周血中的基因突变相关新抗原特异性T 细胞克隆扩增,可能原因是:对于可手术的早期肺癌患者,应用PD-1 抗体作为术前辅助治疗,有利于重新激活抗肿瘤免疫T 细胞的活力,提高清除体内潜在微小转移灶的能力,这些T 细胞在术后仍能抑制患者体内残余肿瘤细胞的增殖过程[34]。 2018年,一项多中心Ⅱ期临床研究(NADIM),对46例可切除的ⅢA 期NSCLC 患者予以术前免疫治疗联合化疗(Nivolumab+紫杉醇+卡铂),发现治疗后患者的主要病理学反应率(MPR)为83%,ORR 达73.9%,表明免疫治疗联合化疗相较于单纯新辅助化疗能提高患者的病理缓解率(pCR)[35]。近期一项Ⅱ期研究(NEOSTAR)旨在评估单纯应用Nivolumab 和联合应用Nivolumab 与Ipilimumab 新辅助治疗对于Ⅰ至ⅢA 期可切除NSCLC 患者的疗效,结果发现单药组和联合用药组的MPR 分别为19% 和44%,由此可见Nivolumab 联合免疫治疗的术前辅助疗效优于单药治疗[36]。一项多中心、单臂Ⅱ期研究(LCMC3)表明,应用Atezolizumab 新辅助治疗对于ⅠB、ⅡA、ⅢA 和部分选择性ⅢB NSCLC 患者较单纯化疗有更好的疗效,患者MPR 可达23%,pCR 为5%[37]。另一项单臂Ⅲ期研究(Impower030)发现,术前Atezolizumab 联合化疗也有很好的治疗效果,MPR为50%,完全缓解率(complete response rate,CRR)为50%[38]。还有研究发现Sintilimab 用于新辅助治疗对于早期可切除NSCLC 患者具有良好的疗效和安全性,ORR 为13.6%,MPR 为45.5%,18.2% 的患者达到完全病理缓解[39]。 以上研究均表明,部分PD-1/PD-L1 抑制剂在肺癌术前辅助治疗中有明显疗效,较传统化疗方案毒性反应和副作用更小,但是具体的用药方案、适应人群以及是否存在潜在毒副反应仍有待于研究。
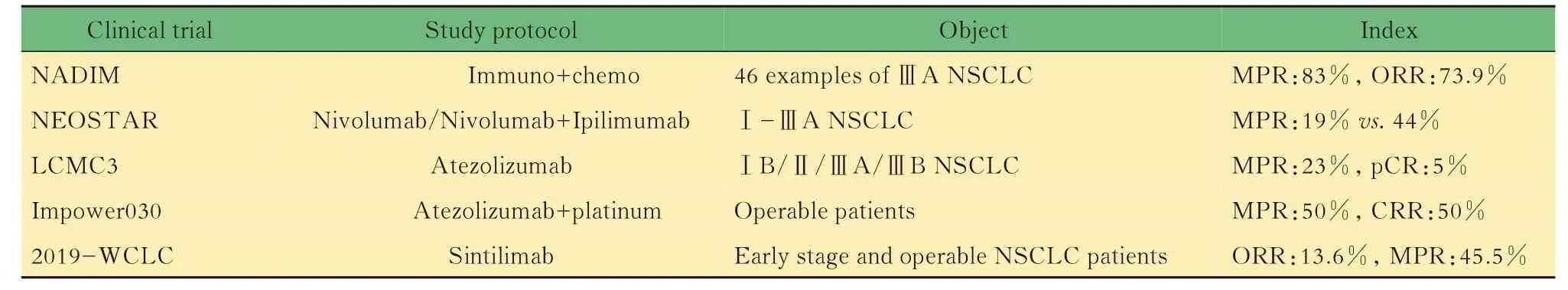
表2 免疫治疗应用于新辅助治疗相关临床试验汇总Tab 2 Summary of clinical trials of immunotherapy applying in pre‐operative adjuvant therapy
结语免疫负性调控分子PD-1 及PD-L1 在已产生靶向治疗耐药的肺癌患者及术前辅助治疗中的应用越来越受到重视。肺癌手术前,应用免疫治疗可激活T 细胞,而这些活化的T 细胞在手术后仍可以干扰体内残余的顽固肺癌细胞的增殖[40]。术前应用Nivolumab 新辅助治疗有望从晚期的一/二线治疗扩展到早期的术前辅助治疗。这些研究由于入组患者较少,术后随访时间较短,仍存在一定的局限性。未来需要开展更大规模、更长时间的临床研究,用以探索Nivolumab 及其他术前免疫联合疗法,明确其疗效和最佳预测指标。然而,一些前期研究发现,免疫治疗应用于某些有驱动突变(EGFR/ALK)的肺癌患者后,实际治疗效果不如化疗,pCR 不升反降[41]。另一方面,对于靶向治疗耐药且PD-L1 高表达的肺癌患者,免疫治疗却能明显提高肿瘤整体缓解率[42]。肺癌的免疫治疗应用于已产生靶向治疗耐药性的肺癌患者及术前辅助治疗仍存在许多问题:(1)如何准确定位适合免疫治疗的肺癌患者群;(2)如何达到免疫治疗的最佳疗效,降低毒性反应和副作用;(3)具体研究机制尚不明确。综上所述,免疫治疗可能是解决肺癌患者靶向耐药和术前辅助的优势选择,但仍需更多的研究试验。
作者贡献声明刘洋 论文构思和撰写,表格制作。唐东方 论文撰写。陈晓宇,朱训夏 查阅文献。 康宁,付文韬 论文修订。 沈晓咏 论文审校。
利益冲突声明所有作者均声明不存在利益冲突。
