MicroRNA-218单核苷酸多态性与结直肠癌易感性的关系*
2021-12-06李天煜庞彩莲徐瑞梅林悠阅吕昕琪范志豪钟展华何俊力袁朝汉魏驰誉黄舒琪谢烷颐廖日煜
李天煜,庞彩莲,徐瑞梅,林悠阅,吕昕琪,范志豪,钟展华,何俊力,袁朝汉,魏驰誉,黄舒琪,谢烷颐,廖日煜
广东医科大学 1外科学教研室,3公共卫生学院,4研究生学院(广东东莞523808);2东莞市大朗医院检验科(广东东莞523770)
结直肠癌(colorectal cancer,CRC)是发生于结直肠上皮的恶性肿瘤,其发病率居恶性肿瘤中的第3位,同时也是癌症致死的第二大原因[1]。到2030年,预计CRC的全球疾病负担将增加60%,新增病例将超过220万,死亡人数将超过110万[2]。结直肠癌的发生、发展是一个多要素的病理变化过程,且涉及多个基因的改变。遗传因素在CRC发病中起重要的作用[3]。然而,CRC的发病机制尚不完全清楚,有待进一步研究。MicroRNAs(miRNAs)是一种参与肿瘤发生、发展的调节性非编码RNA,它通过与蛋白质编码mRNAs的3′端非编码区(3′-UTR)结合,导致靶mRNA分子的翻译抑制,在基因编码转录后调控中发挥重要作用。单个miRNA可调控多个靶mRNAs,miRNA可调控约60%的人类基因[4]。目前研究显示miR-218 rs11134527、miR-25 rs41274221、miR-143 rs4705342、miR-106a rs137881717的基因多态性与不同类型癌症的发生、发展相关[5]。而microRNA-218 rs11134527的GG基因型与多种癌症的发生、发展存在密切相关性,尤其与消化道肿瘤有潜在关联。我们初步筛选实验表明microRNA-218 rs11134527可能与CRC有潜在关系,并影响CRC的发生、发展。在此基础上,应用聚合酶链式反应-连接酶检测反应技术(LDR-PCR)检测上述基因在CRC患者血清中的表达水平,并采用二元逻辑回归分析对miR-218 rs11134527等4个多态位点与CRC易感性的关联程度进行评估,旨在探讨其多态位点在CRC诊断中的临床价值,为CRC的筛查、诊断、治疗及预后提供新思路。
1 资料与方法
1.1 一般资料 选取广东医科大学附属医院、江门市中心医院、东莞市人民医院和东莞市大朗医院2017年8月至2019年7月确诊为CRC并未作任何治疗的66例患者(CRC组)。此外,选择124例来自同期4个医院且体检结果均为正常的健康个体作为对照组。所有CRC患者和正常健康个体均为无血缘关系的人群。所有CRC患者均经过组织病理学证实。本研究收集CRC患者标本时,采集患者静脉血标本2 mL,经EDTA-K2抗凝,-20℃保存,进行后续实验。本研究经严格审查批准,获得相关4个医院医学伦理委员会的批准进行人体组织细胞采集、检查与实验,并与患者签署知情同意书。
1.2 基因组DNA的提取、分型 在受试者知情同意后,提取每个样本的外周静脉血,加入抗凝剂后充分混匀。用TIANGEN血液基因组DNA提取试剂盒提取各样品的基因组DNA,并将提取的DNA保存在-80℃冰箱中,直至下一步的基因分型。对66例结直肠癌患者和124例健康对照者的microRNA-218 rs11134527、microRNA-25 rs41274221、microRNA -143 rs4705342 和 microRNA -106a rs137881717多态位点采用聚合酶链式反应-连接酶检测反应技术(LDR-PCR)进行分型。MicroRNA-218 rs11134527、microRNA-25 rs41274221、microRNA-143 rs4705342 和 microRNA-106a rs137881717四个单核苷酸多态性的基本信息在国家生物技术信息中心(National Center of Biotechnology Information,NCBI)提取,见表1。首先构建PCR反应体系,总体积为20μL,包括50 ng基因组DNA样品、1×PCR缓冲液、3 mmol/LMg2+、2 mmol/L/每个dNTP、0.5 p引物混合物和1 U Taq DNA聚合酶。引物序列见表2。第二步是建立一个LDR反应体系,该反应体系总体积为10μL,其中包含1μL LDR缓冲液、第一步的4μL PCR产物、每种探针混合物2 pmol和2 U Taq DNA连接酶。探针序列见表3。在基因分型过程中,随机选择15%的样品进行重复测定,与先前测定结果一致率为100%。

表1 rs11134527、rs41274221、rs4705342、rs137881717的基本信息
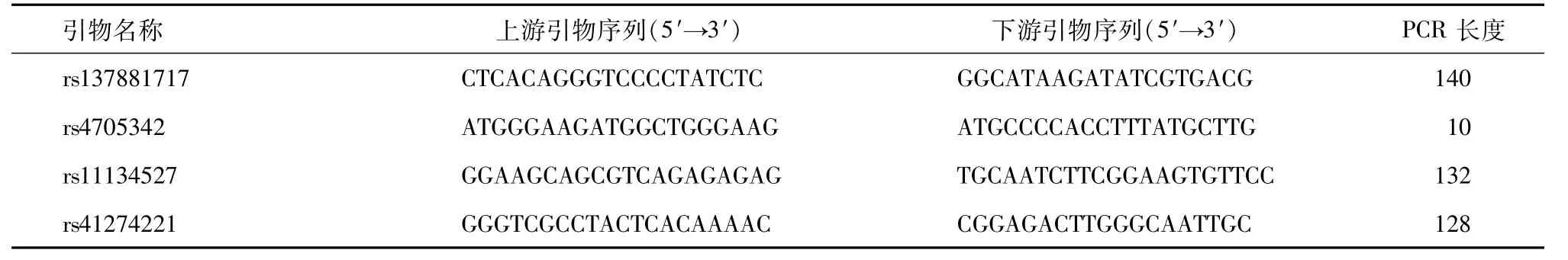
表2 引物的信息

表3 探针的信息
1.3 统计学方法 采用SPSS 21.0统计软件进行数据处理和统计分析,使用SHEsis软件(http://analysis.bio-x.cn/myAnalysis.php)对microRNAs进行单倍体估算和分析。对照组采用χ2检验4个microRNA多态位点的基因型分布是否符合Hardy-Weinberg平衡原则。最后,通过二元逻辑回归分析评估microRNA-218 rs11134527和其他4个单核苷酸多态性与CRC易感性的相关性,以P<0.05为差异有统计学意义。
2 结果
2.1 MicroRNA-218 rs11134527及其他3个单核苷酸多态性的基本信息 与NCBI数据库中国受试者的最小等位基因频率(MAF)对比,本研究对照组中4个单核苷酸多态性的MAF极为相似。结果显示,对照组中除了rs41274221外,Hardy-Weinberg平衡测试均正常(P>0.05),见表4。因此,本研究样本群体的基因型频率分布大多遵循Hardy-Weinberg平衡原则。
2.2 MicroRNA-218 rs11134527及其他3个单核苷酸多态性与CRC易感性的关联分析 基因型关联分析中,CRC组和对照组仅有microRNA-218 rs11134527这一单核苷酸多态性有显著差异。二元逻辑回归分析显示,与AG、AA基因型相比,microRNA-218 rs11134527中GG基因型与CRC易感性增加相关(OR=2.31,95%CI:1.04~5.15,P=0.04),表明携带有GG基因型个体的CRC发病风险比携带AG或AA基因型个体高出2.31倍。在等位基因和基因型分析中并未发现其余3个单核苷酸多态性与CRC易感性有任何关联(P>0.05)。见表4。

表4 MicroRNA-218 rs11134527等4个单核苷酸多态性与CRC易感性的关联分析 数量(%)
2.3 MicroRNA-218 rs11134527和microRNA-143 rs4705342两个单核苷酸多态位点形成的单体型与CRC易感性的关联分析 通过进一步的结构分析,MicroRNA-218 rs11134527和microRNA-143 rs4705342均位于5号染色体上,这2个单核苷酸多态位点位于同一个单体型区。同时,单倍体连锁不平衡测试提示microRNA-218 rs11134527和microRNA-143 rs4705342之间存在连锁关系。因此,本研究进一步对比CRC组和对照组之间两个单核苷酸多态位点形成的单体型频率。纳入本研究的2个单核苷酸多态位点的4种常见单体型(频率>3%)几乎占单体型变异的100%。单体型分析结果显示,microRNA-218 rs11134527和microRNA-143 rs4705342形成的4种常见的单体型均与CRC易感性不存在任何关联(P>0.05)。见表5。

表5 MicroRNA-218 rs11134527和microRNA-143 rs4705342两个单核苷酸多态位点形成的单体型与CRC易感性的关联分析数量(%)
3 讨论
CRC是一种多步骤、多因素、多基因疾病,由多种环境、生活方式和个体的遗传易感因素共同作用的结果,其中个体遗传易感性是CRC发生、发展的主要动因。miRNAs在肿瘤发展过程中特异度较高,稳定性好,因此microRNA对癌症生物学具有重要意义,已有研究证实miRNAs可以作为乳腺癌、肺癌、肾癌等[6-8]肿瘤的生物标志物。越来越多的研究表明,microRNA表达失调在CRC的发展和转移中发挥着功能性的作用[9]。
MicroRNA-218 rs11134527已被有关研究证实与肺癌[10]、宫颈癌[11]、食管鳞状细胞癌[12]等多种癌症的发生、发展密切关联。然而,这些研究均提供了不同的结果。2018年Danesh等[13]报道microRNA-218 rs11134527单核苷酸多态性增加了患乳腺癌的风险。此外,Chuanyin等[11]发现,microRNA-218 rs11134527的GG基因型在宫颈上皮内瘤样变组和对照组中比AA和AG基因型具有更高的宫颈癌风险。在此基础上,我们进行了基因型关联分析研究,结果表明microRNA-218 rs11134527与CRC的易感性增加有关(OR=2.31,95%CI:1.04~5.15),CRC组和对照组之间差异有统计学意义(P<0.05)。而microRNA-25 rs41274221、microRNA-143 rs4705342和microRNA-106a rs137881717与CRC易感性却无关联(P>0.05)。再进一步分析位于5号染色体同一个单体型块上2个单核苷酸多态位点microRNA-218 rs11134527和microRNA-143 rs4705342,结果示2个单核苷酸多态位点形成的单体型与CRC易感性不存在关联。
目前,已有研究发现microRNA-218 rs11134527的AG +GG基因型与非小细胞肺癌的易感性降低有关[10];而本研究表明,与AG和AA基因型相比,携带有GG基因型个体的CRC发病风险比携带AG或AA基因型个体高出2.31倍。He等[14]报道microRNA-218 rs11134527的A>G单核苷酸多态性可降低个体罹患神经母细胞瘤的风险,这提示G等位基因可能是多种疾病发展的保护因子,但其在CRC中的作用有待进一步研究。
近年来有许多microRNA被报道可用于癌症的化学治疗,对降低肿瘤细胞的抵抗性有一定的作用。Nangia-Makker等[15]发现上调microRNA-145的表达和阻断Wnt/β-catenin的信号可抑制CRC耐药干细胞的增殖和克隆。目前CRC的主要化疗方案是奥沙利铂/氟尿嘧啶方案,血清中microRNA-92a-3p的高表达也与CRC的转移和化疗耐药性高度相关[16]。microRNA-218可通过靶向Rictor增加宫颈癌患者对化疗药物雷帕霉素的敏感性[17]。通过靶向Glut1,microRNA-218也增加了膀胱癌对化疗药物顺铂的敏感性[18]。miR-218可通过下调TS的表达,与5-氟尿嘧啶共同抑制CRC细胞的发生、发展,microRNA-218还可通过靶向BIRC5增强5-氟尿嘧啶诱导的细胞凋亡,从而增强药物疗效[19]。除BIRC5外,胸苷酸合酶(TS)也被发现与5-氟尿嘧啶的耐药有关。奥沙利铂作为化疗的基础药物之一,其临床发展也受到CRC细胞耐药性的限制。Fu等[20]发现miR-218的高表达可以抑制CRC细胞的自噬,显著提高肿瘤对奥沙利铂的敏感性。此外,一些研究证实miR-218联合MALAT1(一种长链非编码RNA)应用可以抑制上皮细胞-间充质转化(EMT)过程,从而影响癌细胞对奥沙利铂的敏感性[21]。以上结果表明,microRNA-218有望成为降低CRC细胞耐药性的关键靶点,但需要进一步的研究来证明。
综上所述,本研究通过分析microRNA-218 rs11134527证明了microRNA-218 rs11134527与CRC易感性之间的关联。然而,microRNA-218 rs11134527和microRNA-143 rs4705342单核苷酸多态性位点形成的单倍型与CRC的易感性无关。本研究的结果拓展了CRC易感基因的数据库,并为未来的研究人员提供了研究方向。此外,microRNA-218 rs11134527有望成为未来CRC发生、发展的重要预测指标,为CRC的早期诊断和治疗奠定坚实的分子基础。
(志谢:感谢广东医科大学附属医院、东莞市人民医院、东莞市大朗医院、江门市中心医院胃肠外科的医护人员,在实验中尤其是标本收集提供便利。)
