宫颈锥切术后高危型人乳头瘤病毒转归的相关因素分析*
2021-12-06张琳刘昊刘玉玲
张琳,刘昊,刘玉玲△
1郑州大学第二附属医院妇产科(河南郑州450014);2南昌大学玛丽女王学院(江西南昌330031)
子宫颈鳞状上皮内病变(cervical squamous intraepithelial lesion,SIL)是与宫颈癌密切相关的一组宫颈病变。目前,子宫颈上皮内病变及宫颈癌的公认生物学病因是高危型人乳头瘤病毒(high-risk human papillomavirus,HR-HPV)感染[1]。Srivastava等[2]研究表明锥切术对SIL治疗成功率超过90%,但是仍有约5% ~25%的患者在宫颈锥切术后出现HR-HPV持续感染,彻底清除HR-HPV的效果目前仍存在争议[3]。王雁等[4]有研究发现锥切术可有效切除宫颈上皮内病变组织;亦对HRHPV有一定的清除作用,术后病毒的转阴率可达68.1%。但在宫颈病变被清除而病毒未转阴的患者中,HR-HPV会以隐匿感染的形式再次侵入宫颈组织,造成术后HR-HPV的持续感染。对于术后HR-HPV一过性感染可通过提高免疫力,改变生活方式等转阴。因此,本文主要明确影响术后高危型HPV持续感染的相关因素,为临床干预提供参考。
1 资料与方法
1.1 一般资料 选取2014年1月至2016年1月于郑州大学第二附属医院妇科门诊行高频电刀环形电极宫颈锥形切除术(loop electrosurgcal excision procedure,LEEP)及妇科手术室行冷刀子宫颈锥形切除术(cold knife conization,CKC)治疗的468例SIL患者。患者年龄23~63岁,平均(45.7±7.8)岁,孕次(2.90±1.12)次,产次(1.92±0.46)次。纳入标准:(1)均于术前行HC-Ⅱ法(Hybrid Capture)HPV定量、HPV分型检测及液基细胞学(thinprep cytologic test,TCT)检测;(2)均于电子阴道镜下行宫颈活检确诊为SIL,术后对病变切除标本行病理检测及测量;(3)术后随访时间2年以上。排除标准:(1)资料缺失;(2)不能进行随访或失访者;(3)合并其他生殖系统疾病或全身恶性肿瘤者;(4)术后病理提示切缘阳性或确诊为浸润癌患者。
1.2 治疗方法 患者入院后完善相关检查,明确诊断后根据阴道镜活检病理SIL分级、患者健康情况及自身意愿选择手术方式,做充分术前准备。本研究中182例患者行LEEP,286例患者行CKC。
1.3 随访 468例患者均于术后的3、6、12、18及24个月进行检查,之后改为1年1次。随访方式为高危HPV及TCT检测,必要时阴道镜检查及颈管搔刮。若检查结果显示细胞学异常或电子阴道镜下发现宫颈、阴道异常部位,则需进一步行组织病理学检查,以组织病理学诊断为“金标准”。术后高危型HPV转归临床上的观察指标可简化为:转阴、一过性感染及持续性感染[5]。目前对于术后HR-HPV一过性感染尚无定论,将术前检测HR-HPV阳性,同一患者术后半年复查同一基因型HR-HPV仍为阳性,称为HPV持续感染[6]。
1.4 统计学方法 采用SPSS 23.0统计软件,以均数±标准差(±s)描述计量资料,以例数(n)、百分比(%)描述计数资料。单因素分析采用运用pearsonχ2检验、Bonferroni校正χ2检验、连续校正χ2检验、Fisher确切概率法,多因素采用logistic回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 术后HR-HPV持续感染情况 468例患者术后随访时间26~51个月,平均为(33.4±6.5)个月,55例(11.75%)患者出现HR-HPV持续性感染,见表1。
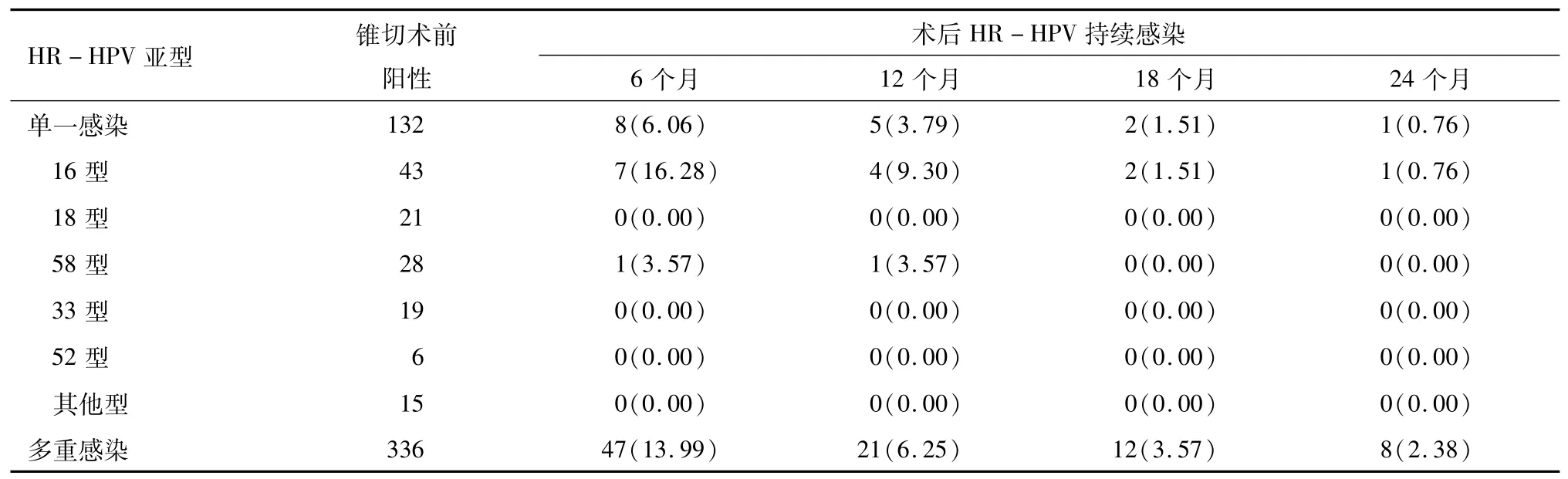
表1 患者术前及术后HR-HPV感染情况 例(%)
2.2 单因素分析 年龄≥45岁、绝经、术前HRHPV分型、术前HR-HPV高负荷量、术前HRHPV多重感染、病变点数≥3、高度鳞状上皮内病变(HSIL)及锥切标本厚度≤1 cm(测量厚度为从间质边缘至切除标本的表面[7]见图1)。与术后HRHPV持续感染密切相关(P<0.05),与孕产次、手术方式及病变累及腺体无关。由于术后病理提示切缘阳性则病变复发风险极高,对此类患者术后随访方式仍有争议,或需重复锥切[3],故切缘阳性不在此讨论范围内。见表2。

表2 SIL患者宫颈锥切术后HR-HPV持续感染单因素分析 例(%)
图1 宫颈锥切标本图
单因素分析发现术前病理分级与术HR-HPV持续感染相关,HSIL患者术后HR-HPV持续感染率比LSIL患者术后HR-HPV持续感染率高,差异有统计学意义(P<0.05)。2014年WHO将宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)改为宫颈鳞状上皮内病变(SIL),并采用二级分类为低度鳞状上皮内病变(LSIL)及HSIL。2014—2016年我院病理诊断SIL仍为CIN,研究将搜集病例级别分为CINⅠ-Ⅱ对应LSIL,CINⅡ-Ⅲ及原位癌对应HSIL。进行Bonferroni校正χ2检验,发现CINⅡ~Ⅲ患者术后HR-HPV持续感染率比CINⅠ~Ⅱ患者术后HR-HPV持续感染率高,差异有统计学意义(P=0.013);原位癌患者术后HR-HPV持续感染率比CINⅡ~Ⅲ患者术后HR-HPV持续感染率高,差异有统计学意义(P=0.009)。见表3。
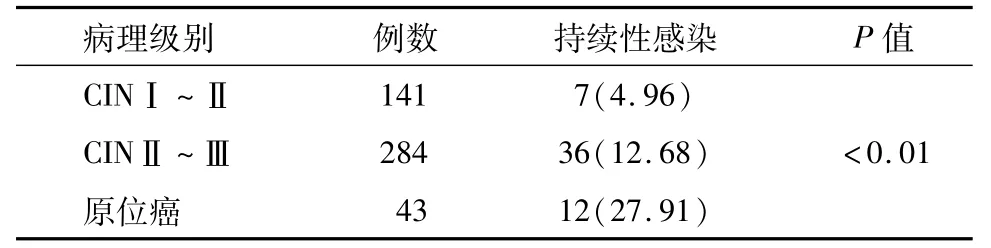
表3 组间比较病理级别对术后HR-HPV持续性感染的影响例(%)
2.3 Logistic多因素分析 通过logistic多因素分析得出锥切标本厚度≤1 cm、病变点数≥3及术前HR-HPV负荷量≥500 RLU/CO为术后HR-HPV持续性感染独立危险因素(OR值分别为2.275、0.244、0.112,P<0.05),见表4。
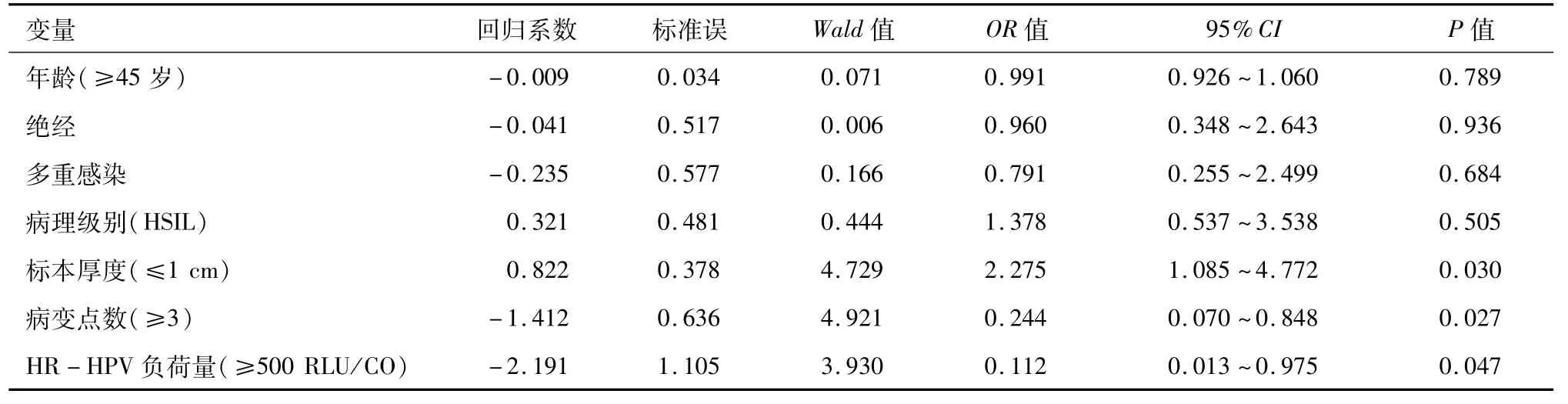
表4 SIL患者宫颈锥切术后HR-HPV持续感染多因素分析
3 讨论
3.1 年龄、绝经对术后HR-HPV持续感染的影响 Giannella等[8]研究发现年龄50岁以上的患者在锥切术前的HR-HPV阳性率低于较年轻者,而术后6个月内HR-HPV阳性率则远大于较年轻者。此外,年龄越大,术前与术后HR-HPV感染亚型的一致率越高,表明随着年龄的增长,锥切后HRHPV清除率降低[8]。对HPV的清除起决定作用的是宿主的细胞免疫,随着年龄增长,绝经妇女因雌激素减退,生殖系统免疫能力下降,机体或病毒的某些特征无法引起细胞免疫,影响了局部HPV的清除,形成了HPV的持续感染[9-11]。考虑到现部分年轻女性性生活过早、多个性伴侣、吸烟、摄取更多酒精、口服避孕药及使用更多免疫抑制剂等从而使得HR-HPV感染人群年龄有年轻化趋势[3],研究中将年龄分界化为45岁,42例≥45岁术后HR-HPV持续感染患者的术后HR-HPV 持续感染率(14.19%)明显高于13例≤45岁患者的感染率(7.56%),差异具有统计学意义(P<0.05)。55例术后HR-HPV持续感染患者36例已绝经,其术后HR-HPV持续感染率高于未绝经者,差异有统计学意义(P<0.05)。年龄≥45岁及绝经为术后HR-HPV持续感染的危险因素。
3.2 锥切标本厚度对术后HR-HPV持续性感染的影响 已有研究发现宫颈锥切术后仍有HRHPV感染或者病变残留或复发的风险与手术范围不足有关,尤其与标本厚度相关,因此术后监测HR-HPV也可反映手术的彻底性[12]。石卓鑫等[13]分析当标本的锥切厚度≤0.6 cm时将导致术后高危HPV持续感染,病变复发的风险增高,提出锥切越宽,HR-HPV持续感染率越小。占总体70%的327例患者的锥切标本厚度≤1 cm,术后55例HR-HPV持续性感染患者锥切标本厚度的范围为0.6~2.7 cm,中位数为1 cm,锥切标本厚度≤1 cm组6个月后HR-HPV持续感染率明显高于厚度>1 cm组,差异有统计学意义(P<0.05)。另研究表明宫颈新鲜组织在制片过程中组织缩水百分比为新鲜组织的15.3%[13],因此锥切时的宽度为测量结果除以0.847再乘以2。在临床工作中由于患者的个体条件及主刀医师的经验不同而导致锥切厚度存在较大差异,研究结果按照缩水比例计算后可知,手术中锥切宽度>2.36 cm可能降低其术后HR-HPV持续感染率。
3.3 病变点数对术后HR-HPV持续感染的影响 目前国内外直接对病变象限数目与锥切术后HR-HPV转归关系的定论较少。龙馨等[14]研究表明,高度宫颈病变常累及多个象限,当病变象限累及3~4个时的复发率是1~2个的3倍。术后若HRHPV持续感染最终导致宫颈病变,增加术后复发的风险。因此,推测病变点数也可能是影响术后HPV持续感染的一种因素。研究中病变点数≥3患者中术后HPV持续感染率为14.74%,约是病变点数<3患者感染率3.28%的4倍,差异有统计学意义(P<0.05)。研究证实推测观点,分析其原因可能与病灶的多点分布,HR-HPV感染宫颈区域分散,术中切除范围不够,虽术后病理提示切缘阴性但HR-HPV的清除率有所下降。
3.4 病理级别对术后HR-HPV持续感染的影响 关于宫颈病变级别与术后HR-HPV感染的关系,目前尚存争议。有研究调查了HSIL术后6个月的HR-HPV转阴情况,称HR-HPV术后6个月转阴率随宫颈病变级别升高而下降[15],也有研究称术前宫颈上皮发生HPV感染后,鳞状上皮细胞处于持续感染状态,细胞恶化不断加重,在子宫病变严重程度逐渐增加的过程中,也会逐渐提高HPV的感染率,降低术后HPV的清除率[16]。在进行宫颈锥切术后虽可以有效清除HR-HPV的感染,但并不能保证彻底清除,且术前宫颈病变级别越高,可能导致术后剩余宫颈正常组织更为敏感,更易感染。本研究将468例患者术前病理结果分为141例LSIL患者及327例HSIL患者,分析时仍采用CIN分级,分为CINⅠ~Ⅱ级,CINⅡ~Ⅲ级及原位癌。单因素分析得出病理级别与术后HR-HPV持续性感染相关(P<0.05),再进行3种级别两两组间比较时发现CINⅡ~Ⅲ级患者术后HR-HPV持续感染率高于CINⅠ~Ⅱ级患者,差异有统计学意义(P<0.016);原位癌患者术后HR-HPV持续感染率高于CINⅡ~Ⅲ级患者,差异有统计学意义(P<0.016)。证实上述研究所说的术后HR-HPV清除率随着宫颈病变级别升高而降低。
3.5 术前HR-HPV感染情况对术后HPV持续感染的影响 De等[17]进行的一项前瞻性研究表明长时间多种高危HPV的合并感染会降低术后HPV的清除率,增加术后HPV持续感染导致细胞学异常和宫颈肿瘤形成的风险。李惠等[18]发现持续感染多为混合型HPV感染,而一过性感染多为单一型HPV感染。另有多项研究表明[19],术前HR-HPV分型与术后转归情况密切相关。HPV16单一感染及HPV16合并其他亚型的多重感染较其他亚型感染更常发生于术后2年HR-HPV持续感染患者。本研究468例患者术后HR-HPV持续感染55例(11.75%),宫颈病变患者单一感染亚型排名前2位的分别为HPV16型、HPV58型分别占单一高危型别感染组的32.58%、21.21%。感染HPV16型患者的HR-HPV负荷量明显高于其他患者,且不同HR-HPV型别感染的持续性感染率不同,其中感染HPV16型别者术后HPV持续感染率显著高于感染其他型别者,差异有统计学意义(P<0.05)。
研究得出术前HR-HPV多重感染与HRHPV术后清除率负相关,推测可能为术前感染HPV种类越多,机体清除病毒时间越长,术后HR-HPV持续感染风险增加。有研究称当HPV-DNA>1 000 RLU/CO表示高HPV病毒负荷量,病毒表现为持续感染状态[20]。55例术后HR-HPV持续感染患者有9例其术前的HR-HPV的负荷量在500~1 000 RLU/CO之间,1例患者HPV负荷量<500 RLU/CO,随访过程中发现术前病毒载量在500~1 000及≥1 000 RLU/CO的患者术后6、12、24个月HRHPV持续感染率均显著高于1~499 RLU/CO的患者,术前病毒载量在500~1 000 RLU/CO及≥1 000 RLU/CO的两组患者术后HR-HPV持续感染率组间比较差异无统计学意义(P>0.05)。因此,得出术前HR-HPV负荷量≥500 RLU/CO即可为术后HR-HPV持续感染的危险信号。但根据随访发现术前越高病毒载量SIL患者术后HR-HPV清除率越低。有研究表明宫颈锥切术后高危型HPV持续感染者容易再次出现宫颈病变,同时当术前高危型HPV病毒负荷量增加时,术后宫颈浸润性癌的发生风险也会提高,出现这种情况主要因为术前HRHPV高负荷不利于手术彻底清除HPV,导致术后持续感染产生新的病变后激活潜在的HR-HPV感染,继而增加继续感染,出现正反馈效应[21-22]。
综上所述,监测HR-HPV的转归对锥切术后患者随访具有重要的指导意义。年龄45岁以上,病灶较多、术前HR-HPV高负荷量、多种亚型合并感染的患者术后更易形成HR-HPV持续感染,术前单一感染患者术后易造成持续感染的HR-HPV型别前2位分别为HPV16型、HPV58型,对于具有上述高危风险的患者应考虑有残留疾病的风险;另外术者于术前应对患者全方面条件进行系统评价,对于宫颈条件较差的患者更应注意锥切范围,尤其是锥切的组织厚度。
