宫颈癌根治性放疗期间肿瘤退缩率对患者预后的影响*
2021-12-06杨利徐志渊王骞陈仙
杨利,徐志渊,王骞,陈仙
香港大学深圳医院临床肿瘤中心(广东深圳518053)
宫颈癌是最常见的女性生殖系统恶性肿瘤[1]。根治性同期放化疗是局部晚期宫颈癌的标准治疗[2]。然而,宫颈癌同期放化疗的3年生存率只有70%左右[3]。找到治疗前或治疗期间的疗效或预后的影响因子,就有可能通过调整治疗方案改善患者的预后。因此,在常规临床实践中寻找疗效或预后的相关因子具有重要的临床实践意义。研究显示外照射放疗期间肿瘤的缩小程度可影响宫颈癌患者的生存时间[4-5],但是对于肿瘤大小的定义、影响预后的阈值尚没有统一的结论。Nam等[4]发现宫颈癌外照射36~45 Gy时肿瘤体积退缩率≥75%是能区别出患者预后差异的最佳阈值。Mayr等[6]研究显示宫颈癌外照射45~50 Gy时残留体积>20%的患者比<20%的患者的5年局部控制率(53% vs.97%,P<0.001)及5年疾病特异性生存率均更低(50% vs.72%,P=0.009),即该阈值为80%。Mongula等[7]的研究提示,末次后装治疗时肿瘤退缩率<77%与治疗结束后肿瘤局部残留显著相关(P<0.02)。这些研究都是测量肿瘤体积的变化,然而临床上测量肿瘤体积更复杂,不及测量单径方便,并且目前通用的抗肿瘤治疗疗效评价标准RECIST v1.1也是使用肿瘤单径作为评价方式。因此本研究旨在以最大单径代表肿瘤大小,评估宫颈癌根治性放(化)疗期间肿瘤退缩率(tumor regression rate,TRR)与预后的关系,找出临界值,为后续开展个体化治疗提供指导。
1 资料与方法
1.1 一般资料 选择2015年1月至2019年9月于我院接受根治性放疗的初诊宫颈癌患者进行回顾性分析。患者入选标准:(1)年龄≥18岁;(2)ECOG(Eastern Cooperative Oncology Group)评分0~2分;(3)经病理证实的宫颈鳞癌、腺癌或腺鳞癌;(4)国际妇产科联盟(The International Federation of Gynecology and Obstetrics,FIGO)分期ⅠB1-ⅣA期;(5)治疗方案为外照射(EBRT)+三维后装放疗(three dimensional brachytherapy,3D-BT)±顺铂单药同期化疗;(6)既往未进行过盆腔放疗。术后放疗或因局部复发行放疗的患者未纳入分析。患者资料从医院临床使用的相关系统中收集,门诊或电话随访获得生存数据。治疗前基线检查包括:(1)采集病史及体检;(2)血常规,肝功能及肾功能;(3)盆腔磁共振增强扫描;(4)PET/CT或胸腹盆腔增强CT扫描;(5)有临床指征时行乙状结肠镜或膀胱镜检查。外照射的第4或5周第1次后装放疗前复查盆腔磁共振平扫。所有患者在治疗前均签署知情同意书。
1.2 治疗
1.2.1 外照射 采用三维适形(3D-CRT)或容积旋转调强(RapidArc)技术,增强CT定位,采集膀胱充盈及排空2套定位CT图像。肿瘤区(gross tumor volume,GTV):结合体格检查、定位CT、盆腔磁共振及PET-CT等多种检查结确定,转移淋巴结单独勾画为GTVn。临床靶区(clinical target volume,CTV):CTV45:包括全宫颈、部分阴道、宫体、宫旁及区域淋巴结引流区,若肿瘤累及阴道下1/3则包括双侧腹股沟淋巴结区;CTV55:GTVn外扩3 mm。内靶区(internal target volume,ITV):根据膀胱充盈及排空2套定位CT图像上靶区的移动范围确定ITV的边界。计划靶区(plan target volume,PTV):CTV外扩5 mm。外照射处方剂量:3D-CRT技术分两阶段,第一阶段PTV45:45 Gy/25次;第2阶段:宫旁加量,ⅢB期及以上16 Gy/8次、ⅡB~ⅢA期10 Gy/5次;RapidArc采用同步缩野加量技术,PTV45:45 Gy/25次,PTV55:55 Gy/25次。所有外照射均5次/周。
1.2.2 后装放疗 外照射开始后第4~5周行第1次后装放疗。采用CT或MRI引导,192Ir(铱)高剂量率,每周1次,共4次。外照射加后装放疗高危临床靶区(high risk clinical target volume,HRCTV)累积生物剂量要求≥84 Gy。后装放疗当天不予外照射或同期化疗。
1.2.3 同期化疗 外照射期间顺铂40 mg/m2,1次/周,最多6周。若患者年龄>70岁,肾功能差,一般情况欠佳,由主管医生评估后可予单纯放疗。若放疗等待时间较长,给以紫杉醇+卡铂方案新辅助化疗。
1.3 肿瘤测量 对基线及后装治疗前的盆腔MRI所显示的宫颈肿物进行横断面及矢状面三维方向的测量,取最大测量值代表肿瘤大小。TRR=(基线肿瘤大小-后装前肿瘤大小)/基线肿瘤大小×100%。以TRR 50%或75%将所有患者分别分为两组,按TRR 75%分组后两组患者的治疗结果具有统计学差异,结合Nam等[4]的研究,本研究以TRR 75%将所有患者分为两组进行分析。
局部失败定义为放疗后局部未控制或随访期间出现宫颈局部复发,局部控制生存定义为外照射开始至局部失败的时间,总生存(overall survival,OS)定义为外照射开始至任何原因导致的死亡之间的时间。
1.4 统计学方法 采用SPSS 19.0统计软件。对患者临床资料、TRR影响因素的单因素分析采用描述性统计分析及χ2检验、t检验,TRR的多因素分析采用二元logistic回归分析。生存率采用Kaplan-Meier及log-rank法分析及比较,生存相关的多因素分析采用COX等比例风险模型。双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 患者临床资料 共107例患者纳入分析。其中鳞癌94.4%,FIGOⅢA~ⅣA期72.0%。36.4%的患者有治疗前贫血(Hb<110 g/L),16例患者(15.0%)在放疗前接受过新辅助化疗,同期化疗患者比例85.0%。外照射采用3D-CRT技术的占26.2%。32.7%的患者治疗后体重减轻≥5%。见表1。

表1 患者临床资料及放疗期间TRR的单因素分析 例(%)
2.2 放疗期间TRR及影响因素 所有患者的基线肿瘤大小为(5.0±1.8)cm,后装放疗前肿瘤大小为(2.4±1.7)cm,TRR为(51.3±34.0)%,后装放疗前肿瘤较基线时明显退缩(P=0.000)。单因素分析显示基线贫血(P=0.007)、放疗后体重减轻百分比(P=0.006)、基线中性粒细胞/淋巴细胞比值(P=0.000)、基线血小板/淋巴细胞比值(P=0.005)与TRR≥75%相关;年龄(P=0.756)、ECOG评分(P=1.000)、FIGO分期(P=0.479)、病理类型(P=0.989)、新辅助化疗(P=0.361)、同期化疗(P=0.773)、放疗技术(P=0.636)、基线肿瘤大小(P=0.136)与TRR≥75%不相关(表1)。将单因素分析中与TRR≥75%相关的因素纳入二元logistic回归分析,基线血小板/淋巴细胞比值及放疗后体重减轻百分比与TRR≥75%相关(表2)。

表2 放疗期间肿瘤退缩率相关因素的二元logistic回归分析
2.3 治疗结果 中位随访时间27.6个月(3.0~59.0个月),共有23例患者死亡,15例出现局部失败,其中4例合并区域淋巴结转移,6例合并远处转移。放疗期间TRR≥75%的27例患者没有局部失败,TRR<75%的80例患者中15例局部失败。TRR≥75%与<75%患者的2年局部控制率(LCR)分别是100%和80.9%(P=0.018)(图1),COX单因素分析显示,患者年龄(P=0.05,HR=0.950,95% CI 0.902~1.000)、基线肿瘤大小(P=0.022,HR=1.383,95% CI 1.048~1.826)、TRR(P=0.027,HR=0.983,95% CI 0.969~0.998)与LCR相关,将这3个因素纳入COX多因素分析,结果显示TRR(P=0.005,HR=0.972,95% CI 0.953~0.991)及基线肿瘤大小(P=0.007,HR=1.460,95% CI 1.109~1.922)与LCR相关。
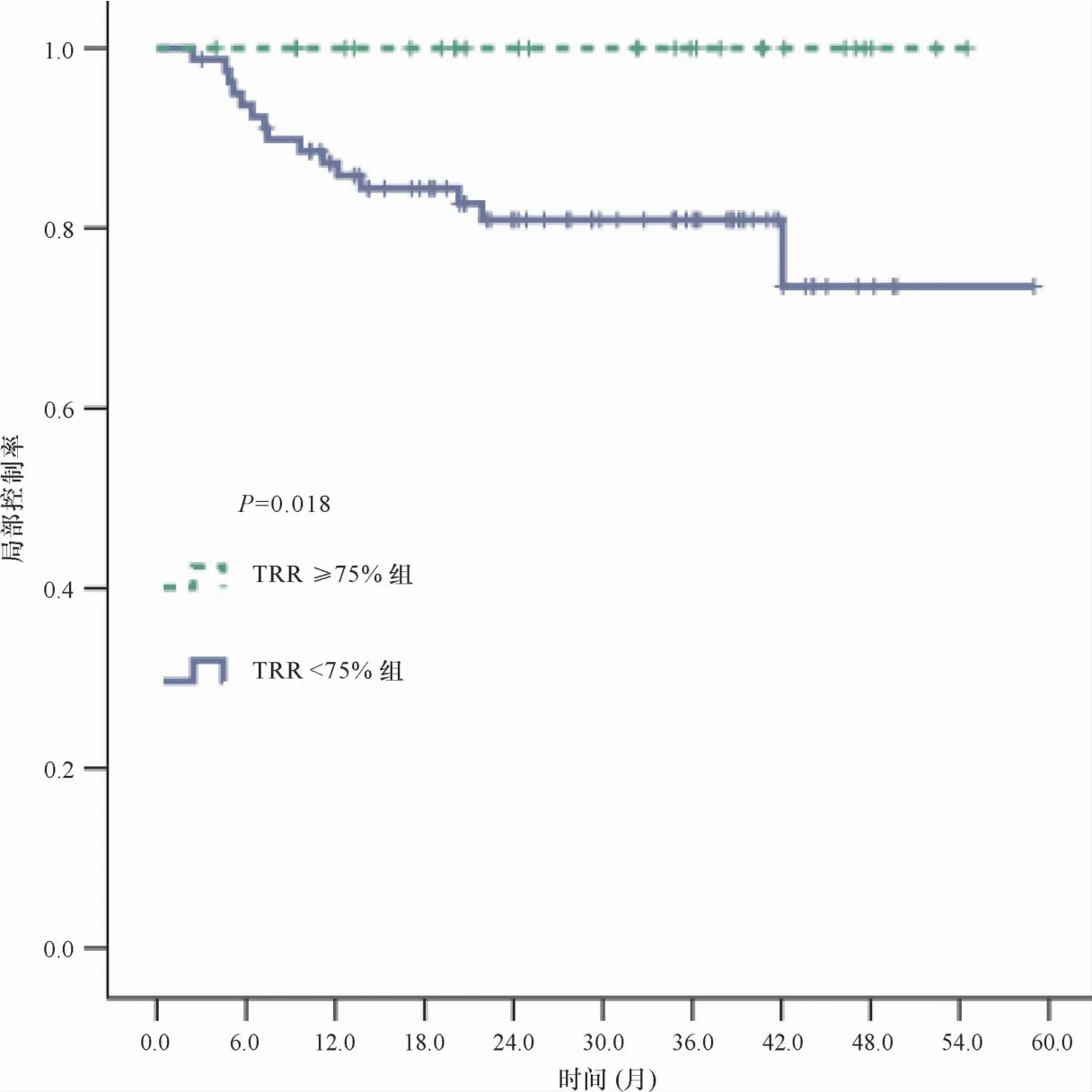
图1 两组患者局部控制率的Kaplan-Meier曲线及log-rank比较
TRR≥75%比TRR<75%患者的2年OS率高(96.0% vs.77.6%,P=0.012)(图2)。COX单因素分析显示,基线肿瘤大小(P=0.001,HR=1.471,95% CI 1.170~1.849)、TRR(P=0.029,HR=0.986,95% CI 0.974~0.999)、基线贫血(P=0.004,HR=0.282,95% CI 0.119~0.667)、基线NLR(P=0.003,HR=1.219,95% CI1.070~1.390)与OS相关,将这4个因素纳入COX多因素分析,结果显示TRR(P=0.031,HR=0.981,95%CI 0.964~0.998)及基线肿瘤大小(P=0.027,HR=1.416,95% CI 1.041~1.926)与OS相关。
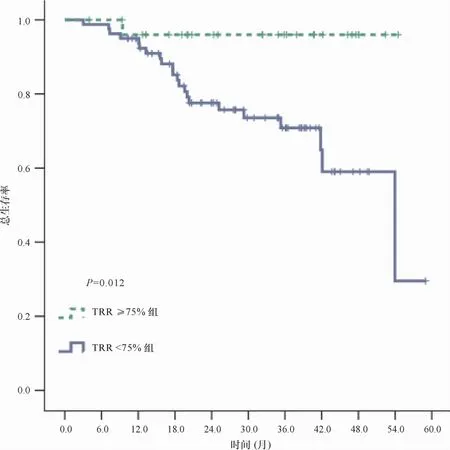
图2 两组患者总生存率的Kaplan-Meier曲线及log-rank比较
3 讨论
局部晚期宫颈癌的标准治疗方案是同期放化疗[2],然而,仍然有不少患者放化疗后出现复发转移。本研究按TRR 75%分组两组患者的治疗结果差异有统计学意义(P<0.05),TRR<75%的患者具有更差的2年LCR及OS。其他学者研究多采用肿瘤体积评估肿瘤退缩率。Nam等[4]发现宫颈癌外照射放疗36~45 Gy时肿瘤体积退缩率≥75%是能区别出患者预后差异的最佳阈值。Mayr等[6]研究发现,宫颈癌外照射45~50 Gy时残留体积>20%的患者比<20%的患者的5年LCR(53% vs.97%,P<0.001)及5年疾病特异性生存率均更低(50% vs.72%,P=0.009),即该分界值为80%。Mongula等[7]的研究提示,末次后装治疗时TRR<77% 与治疗结束后肿瘤局部残留显著相关(P<0.02)。Mayr等[8]的研究显示,宫颈癌根治性治疗期间(45~50 Gy)MRI上采用体积评估的TRR是能预测治疗结果的最佳方式,而根据肿瘤三维方向最大径(d1,d2,d3)估算的肿瘤体积(d1×d2×d3×pi/6)却不能预测治疗结果。本研究采用最简单的三维方向上肿瘤的最大径评估TRR,得出能区分预后的TRR的分界值与其他学者采用体积的研究结果相似。我们认为本研究的结果具有重要的临床意义:(1)虽然肿瘤体积能更准确地反映肿瘤负荷的大小,但是测量肿瘤体积更复杂,远不及测量单径方便。目前肿瘤学最广泛采用的疗效评价标准RECIST v1.1也是采用单径测量作为评价指标,至今尚未采用肿瘤体积作为疗效评价指标。因此单径测量具有临床实用价值。(2)我们使用最大径代表肿瘤大小所获得的TRR不仅与局部控制率及总生存率相关,获得的临界值也与其他研究采用体积分析得出的临界值相似[4,6],因此本研究结果可作为临床上评估患者预后的参考指标。对于预后差的患者,可设计自适应放疗等个体化治疗方案以改善患者预后。
虽然有多项研究发现宫颈癌放疗期间或放疗后TRR与局部控制或总生存相关,但对于放疗期间或放疗后评估TRR的时间点并未明确,常见的有同期放化疗开始后2周[9]、外照射36~45 Gy时[4]、外照射45~50 Gy时[6,8]、后装治疗时[7]、放疗结束后1个月[4]以及放疗前后及放疗期间连续动态监测肿瘤大小[6]。从临床应用的角度分析,治疗结束后数月的预后指标的实践意义较小,因为已经错过了可以早期调整治疗计划的时机;频繁的监测虽然有助于提高准确性,但增加医疗资源的使用,不能获得最佳的成本效益结果。本研究中后装治疗前盆腔MRI检查为临床常规实践,旨在指导后装治疗,该时间点获得的TRR能有效鉴别出不同预后的分组,在该时间点尚有调整治疗方案的时机。因此,我们认为利用后装治疗前的MRI检查指导个体化治疗是切实可行的。
本研究初步显示基线PLR及放疗后体重减轻百分比与TRR≥75%相关。研究表明基线PLR升高是宫颈癌生存期的负性预测指标[10-11],宫颈癌同期放化疗期间营养状态转差也与肿瘤的不良预后相关[12],本研究仅发现基线PLR及放疗期间体重减轻与TRR相关,没有检测出这两个指标与生存之间的关系,可能与回顾性研究的性质、不同的研究人群等相关。本研究中单纯放疗组患者与同期放化疗组患者相比,放疗期间TRR没有差别,该结果与Nam等[4]的研究结果一致,Nam等[4]的研究中单纯放疗组与同期放化疗组能区别出患者预后差异的最佳阈值都是肿瘤体积退缩率≥75%。
本研究是一项回顾性分析,具有回顾性研究本身的缺陷。治疗期间的MRI检查在后装治疗前,不是固定的时间点;患者的随访不规律等,都可能影响分析结果。后续需要设计严谨的前瞻性研究进一步验证本研究的结果。
综上所述,放疗期间的TRR部分反映了肿瘤对射线的内在敏感性。宫颈癌根治性放疗期间的TRR与肿瘤的LCR及OS相关,第4~5周时根据MRI测量的TRR<75%的患者具有更差的局部控制及总生存,放疗期间TRR 75%的分界值可用于指导实施开展宫颈癌个体化治疗。
