白藜芦醇对人角膜上皮细胞炎症和氧化应激损伤的保护作用
2021-12-06韩瑞芳王培红
朱 琳,韩瑞芳,王培红,李 轩,
0引言
目前,眼表炎症的患病率仍然较高,且重度的眼表炎症对患者生活质量造成了极大的影响,使其治疗成为日益严重的医疗保健问题。临床上许多眼科疾病与眼表炎症相关,包括感染、干眼、眼睑疾病、理化损伤等[1]。眼表炎症中往往伴随着氧化应激的发生[2-3]。氧化应激中过量产生的活性氧(reactive oxygen species,ROS)可通过靶向DNA、蛋白质和细胞内通路诱导细胞损伤[4]。因此,细胞内ROS的过度生成被认为是眼表炎症在内的眼表疾病发病机制的关键因素[5]。白藜芦醇(resveratrol,RSV)是一种植物多酚。研究证实,RSV在葡萄膜炎、糖尿病视网膜病变、年龄相关性黄斑变性等眼部疾病中可发挥抗氧化和抗炎的保护作用[6-8]。但目前,RSV在眼表炎症中的研究鲜有报道。因此,本研究应用人角膜上皮细胞(human corneal epithelial cells,HCECs)探讨了RSV的抗炎和抗氧化作用,以期为眼表炎症的治疗提供新的思路。
1材料和方法
1.1材料
1.1.1细胞HCECs细胞(美国ATCC)。
1.1.2主要试剂肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α,美国R&D SYSTEMS)、RSV(美国SIGMA)、RPMI-1640培养基(美国Hyclone)、胎牛血清(fetal bovine serum,FBS,美国Gibco)、青链霉素混合液(青霉素10×103U/mL,链霉素10×103μg/mL,美国Gibco)、2.5g/L胰蛋白酶(美国Gibco)、细胞总RNA提取试剂盒(北京天根生化科技有限公司)、实时定量PCR引物(北京赛百盛基因技术有限公司)、MMLV逆转录酶、Taq DNA聚合酶(美国Promega)、TB Green Premix Ex TaqII(日本Takara)、人IL-6/IL-8酶联免疫检测(enzyme-linked immunosorbent assay,ELISA)试剂盒(安徽巧伊生物科技有限公司)、BCA蛋白浓度测试试剂盒(美国Thermo)、核蛋白-胞浆蛋白提取试剂盒(美国Thermo)、蛋白marker(美国Biotopped)、核因子-κB p65(nuclear factor-κB p65,NF-κB p65)抗体(ab 16502,美国Abcam)、Histone H1抗体(ab 134914,美国Abcam)、GAPDH抗体(ab 181602,美国Abcam)、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔二抗(A11034,美国Thermo)、RDye 800CW山羊抗兔二抗(C70926-05,美国LI-COR)、MTT溶液(美国Soiarbio)、ROS检测试剂盒(美国Soiarbio)。
1.1.3主要仪器设备CO2培养箱(德国Heraeus)、酶标仪(美国Bio Tek)、实时荧光定量基因扩增仪(美国Roche)、荧光显微镜(日本Nikon)、双色红外激光成像系统(美国LI-COR)、荧光分析仪(美国Bio Tek)。
1.2方法
1.2.1细胞培养HCECs每2d换液1次,细胞生长至近融合状态时,用胰蛋白酶消化细胞并进行传代。培养条件:RPMI-1640培养基+10% FBS+1%青链霉素混合液,置于37℃,饱和湿度,5% CO2培养箱中无菌培养。
1.2.2研究RSV的抗炎作用
1.2.2.1实验分组实验分设3组:对照组、TNF-α组(10ng/mL TNF-α刺激)、RSV+TNF-α组(10μmol/L RSV预处理2h)。
1.2.2.2MTT法检测细胞活力细胞用不同浓度(0、5、10、25、50、100μmol/L)RSV分别处理HCECs 24h,更换培养基,加入MTT(5mg/mL)孵育4h后,去除各孔内液体,加入二甲基亚砜(dimethyl sulfoxide,DMSO)溶液,震荡10min后采用酶标仪测定波长570nm处吸光度(optical delnsity,OD)值,按公式计算得各组的细胞活力:细胞活力=实验组OD值/对照组OD值×100%。
1.2.2.3RT-qPCR法检测炎症因子IL-1和IL-6及IL-8mRNA的相对表达量细胞按实验设计分组并做相应处理。TNF-α组用TNF-α处理18h。使用细胞总RNA提取试剂盒提取总RNA,逆转录成cDNA后-20℃保存。采用实时荧光定量基因扩增仪对各组cDNA进行目的基因扩增。IL-1上游引物:GCTTCTCTCTGGTCCTTGG,下游引物:AGGGCAGGGTAGAGAAGAG;IL-6上游引物:CAAACTTCCTGGAGTTCΑCC,下游引物:TGTCCAATGGΑCAGGATG;IL-8上游引物:ACCTCACTGTGCAAATTCAG,下游引物:TATGACTCTTGCTGCTCAGC;GAPDH上游引物:TGCCCTCAACGACCACTTTG,下游引物:CTGGTGGTCCAGGGGTCTTA。扩增程序:95℃预变性3min,95℃变性12s,62℃退火延伸45s,共40个循环。熔解曲线:95℃反应10s,65℃反应1min,97℃反应1s,37℃冷却降温30s。以GAPDH为内参,采用2-ΔΔCt法计算目的基因mRNA的相对表达量。
1.2.2.4ELISA法检测各组细胞培养液上清中炎症因子IL-6及IL-8的质量浓度细胞按实验设计分组并做相应处理。TNF-α组用TNF-α处理24h。按照试剂盒说明书要求进行操作。将细胞培养液上清、浓度梯度稀释标准品及相关抗体药品加入包被了抗体的检测板中,将各组校准后OD值代入标准曲线中,计算得到各组IL-6、IL-8的质量浓度。
1.2.2.5免疫荧光染色法检测NF-κBp65的核转位情况细胞按实验设计分组并做相应处理。TNF-α组用TNF-α处理1h,细胞用PBS洗涤,4%多聚甲醛固定25min,PBS洗涤,0.1% Triton X-100透核膜10min,5% BSA封闭1h,PBS洗涤,4℃下孵育一抗NF-κB p65(Abcam,ab16502,1∶200)过夜,PBS洗涤,室温下孵育HRP标记的山羊抗兔二抗(Thermo,A 11034,1∶200)1h,PBS洗涤,DAPI染核15min,PBS洗涤,50%甘油封片。荧光显微镜拍照,观察各组细胞中NF-κB p65蛋白的核转位情况。
1.2.2.6Westernblot法检测胞质和胞核中NF-κBp65蛋白的表达细胞按实验设计分组并做相应处理。TNF-α组用TNF-α处理1h,提取细胞的胞质和胞核蛋白,采用BCA法测定各组样本蛋白浓度。与5×蛋白上样缓冲液混合,100℃ 10min使蛋白变性。根据测定的蛋白浓度确定各组样本上样量,在聚丙烯酰胺凝胶(SDS-PAGE)中电泳后采用PVDF膜转膜,5%脱脂牛奶室温封闭1h,裁膜,分别加入一抗NF-κB p65(Abcam,ab 16502,1∶1000)、细胞核内参Histone H 1(Abcam,ab 134914,1∶1000)和细胞质内参GAPDH(Abcam,ab 181602,1∶1000),4℃过夜,TBST洗膜后加入山羊抗兔二抗(LI-COR,C70926-05,1∶5000),室温孵育1h,洗膜后使用双色红外激光成像系统曝光,实验至少重复3次。使用Image J软件分析条带。
1.2.3研究RSV的抗氧化作用
1.2.3.1实验分组实验分设3组:正常组、H2O2组(300μmoL/L H2O2刺激HCECs 24h)、RSV+H2O2组(10μmol/L RSV预处理HCECs 2h,300μmol/L H2O2刺激HCECs 24h)。
1.2.3.2MTT法检测细胞活力用不同浓度(0、200、300、400μmol/L)H2O2分别处理HCECs 24h,或按照1.2.3.1中实验分组及给药方式做相应处理,按照1.2.2.2中操作步骤进行实验,检测各组细胞活力。
1.2.3.3应用DCFH-DA探针检测各组细胞的ROS水平细胞按实验设计分组并做相应处理。用含10μmol/L DCFH-DA探针的培养液于37℃培养箱孵育细胞20min。用PBS将多余的探针洗去。显微镜下观察细胞绿色荧光着染的情况。随后,将细胞用胰酶消化后PBS重悬,488nm激发波长,525nm发射波长,荧光分析仪检测各孔荧光强度。
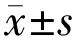
2结果
2.1不同浓度RSV对HCECs活力的影响MTT结果显示,不同浓度(0、5、10、25、50、100μmol/L)RSV分别处理HCECs 24h后,细胞活力分别为(100.00±0.00)%、(106.40±2.76)%、(108.81±4.05)%、(102.20±5.12)%、(96.70±7.51)%、(67.23±2.91)%,差异有统计学意义(F=11.98,P<0.001)。与对照组(0μmol/L RSV)相比,100μmol/L RSV组细胞活力明显下降(P<0.001);其余各组与对照组相比差异均无统计学意义(P>0.05),见图1。本研究选择10μmol/L RSV进行后续实验。
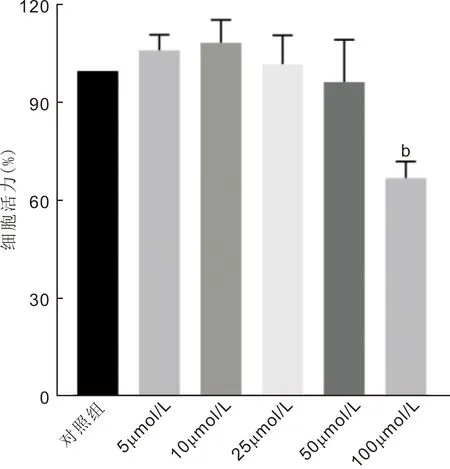
图1 不同浓度RSV作用下HCECs的细胞活力 b P<0.01 vs 对照组。
2.2各组HCECs炎症因子IL-1和IL-6及IL-8mRNA的相对表达量比较RT-qPCR结果显示,比较各组IL-1、IL-6、IL-8 mRNA的相对表达量,差异均有统计学意义(P<0.01)。与对照组相比,TNF-α组IL-1、IL-6、IL-8 mRNA的相对表达量明显升高(均P<0.05);与TNF-α组相比,RSV+TNF-α组IL-1、IL-6、IL-8 mRNA的相对表达量明显降低(P<0.05),见表1。表明RSV有效抑制了HCECs炎症反应中IL-1、IL-6、IL-8的表达。

表1 各组HCECs炎症因子mRNA的相对表达量
2.3各组HCECs培养液上清中炎症因子IL-6和IL-8的蛋白浓度比较ELISA结果显示,比较各组IL-6、IL-8的蛋白浓度,差异均有统计学意义(P<0.01)。与对照组相比,TNF-α组IL-6、IL-8的蛋白浓度明显升高(P<0.05);与TNF-α组相比,RSV+TNF-α组IL-6、IL-8的蛋白浓度明显降低(P<0.05),见表2。表明RSV有效抑制了细胞培养液上清中炎症因子IL-6、IL-8的蛋白分泌。
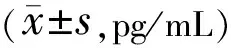
表2 各组HCECs培养液上清中炎症因子的蛋白浓度比较
2.4各组HCECsNF-κBp65的核转位比较免疫荧光检测结果显示,与对照组相比,TNF-α组中NF-κB p65荧光标记主要集中于细胞核,表示NF-κB p65激活从细胞质转移到细胞核;与TNF-α组相比,RSV+TNF-α组NF-κB p65入核量显著减少,见图2。表明RSV有效抑制了NF-κB p65的激活。
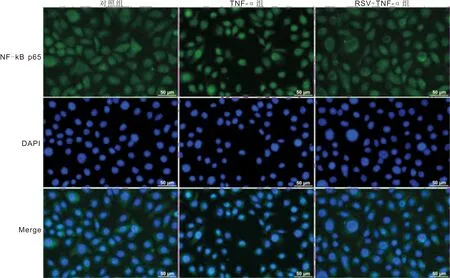
图2 各组HCECs NF-κB p65的核转位情况。
2.5各组HCECsNF-κBp65蛋白的相对表达量比较Western blot结果显示,对照组、TNF-α组、RSV+TNF-α组细胞质中NF-κB p65蛋白的相对表达量分别为1.08±0.07、0.46±0.04、1.22±0.05,差异有统计学意义(F=52.12,P<0.001)。与对照组相比,TNF-α组细胞质中NF-κB p65蛋白的相对表达量明显减少(P<0.001);与TNF-α组相比,RSV+TNF-α组细胞质中NF-κB p65蛋白的相对表达量明显增多(P<0.001)。对照组、TNF-α组、RSV+TNF-α组细胞核中NF-κB p65蛋白的相对表达量分别为0.95±0.09、1.99±0.14、1.04±0.05,差异有统计学意义(F=33.38,P<0.001)。与对照组相比,TNF-α组细胞核中NF-κB p65蛋白的相对表达量明显增多(P<0.001);与TNF-α组相比,RSV+TNF-α组细胞核中NF-κB p65蛋白的相对表达量明显减少(P<0.01),见图3。
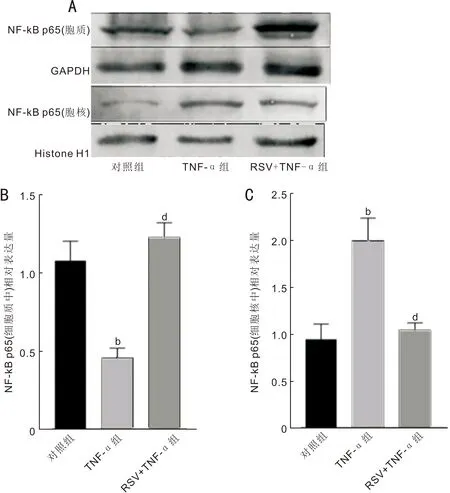
图3 各组HCECs NF-κB p65 蛋白的表达 A:Western blot结果;B:细胞质中NF-κB p65蛋白的相对表达量;C:细胞核中NF-κB p65蛋白的相对表达量。b P<0.01 vs 对照组;d P<0.01 vs TNF-α组。

图4 不同浓度H2O2作用下HCECs的细胞活力 b P<0.01 vs 正常组。
2.6不同浓度H2O2对HCECs活力的影响MTT结果显示,不同浓度(0、200、300、400μmol/L)H2O2分别处理HCECs 24h后,细胞活力分别为(100.00±0.00)%、(90.33±2.57)%、(61.23±6.11)%、(31.36±3.97)%,差异有统计学意义(F=64.32,P<0.001)。与正常组(0μmol/L H2O2)相比,300、400μmol/L H2O2组细胞活力与正常组相比均明显下降(P<0.001);200μmol/L H2O2组细胞活力与正常组相比差异无统计学意义(P>0.05),见图4。本研究选择300μmol/L H2O2进行后续实验。
2.7RSV对H2O2诱导HCECs氧化应激反应细胞活力的影响MTT结果显示,正常组、H2O2组、RSV+H2O2组细胞活力分别为(100.00±0.00)%、(61.23±6.11)%、(94.67±2.03)%,差异有统计学意义(F=31.94,P<0.001)。与正常组相比,H2O2组HCECs活力明显下降(P<0.001);与H2O2组相比,RSV+H2O2组细胞活力明显升高(P<0.01),见图5。

图5 各组HCECs的细胞活力 b P<0.01 vs 正常组;d P<0.01 vs H2O2组。
2.8RSV对HCECsROS水平的影响DCFH-DA探针染色后检测ROS,与正常组相比,H2O2组镜下细胞呈现明显的强阳性着染,ROS的生成明显增多;与H2O2组相比,RSV+H2O2组镜下细胞呈现明显的弱阳性着染,ROS的生成明显减少,见图6A。用荧光分析仪检测各组ROS荧光强度,正常组、H2O2组、RSV+H2O2组的荧光强度分别为722.70±22.76、871.70±12.72、594.00±42.57,差异有统计学意义(F=23.24,P<0.01)。与正常组相比,H2O2组荧光强度明显升高(P<0.05);与H2O2组相比,RSV+H2O2组荧光强度明显降低(P<0.01),见图6B。
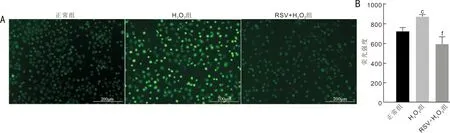
图6 各组HCECs ROS的生成 A:荧光显微镜下各组细胞着染情况;B:荧光分析仪检测各组细胞ROS荧光强度。c P<0.05 vs 正常组;f P<0.01 vs H2O2组。
3讨论
角膜是眼球前部的无血管组织,角膜最外层的角膜上皮层通过其屏障功能以及抗血管生成和免疫调节作用在保护角膜的同时维持角膜的透明性[9-10]。在世界范围内,角膜炎仍然是主要致盲眼病之一[11]。在角膜炎症中,角膜上皮细胞受损会释放炎症因子,导致眼表炎性细胞浸润,而过度的炎症反应会使促血管生成因子大量上调,角膜新生血管生成,进而影响视力[12-13]。研究表明[13-14],TNF-α在体外条件下会破坏HCECs的屏障功能,诱导炎症反应及促炎性细胞因子包括IL-6、IL-8和单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)的炎性应答,在角膜炎症中起关键作用。故本研究采用TNF-α体外诱导 HCECs炎症反应。
RSV是一种天然存在的植物多酚,具有抗氧化、抗凋亡、抗肿瘤、抗炎、抗血管生成和扩张等多种药理作用[15]。已证实RSV通过抑制NF-κB通路激活在多种细胞中发挥其抗炎作用[16-18]。在眼部,RSV可抑制视网膜色素上皮中NF-κB通路的激活,减弱与年龄相关性黄斑变性有关的视网膜色素上皮细胞炎症反应[19]。鉴于NF-κB是炎症级联反应的关键调节因子,可通过调控多种炎性细胞因子(如IL-1β、L-6、IL-8和TNF-α等)的转录而快速响应炎症刺激,靶向NF-κB通路是抑制炎症的一项关键策略[20]。目前,RSV在眼表炎症中的研究鲜有报道。本研究探讨了NF-κB在HCECs炎症反应中的作用。在本研究中,TNF-α刺激细胞后,NF-κB p65入核量显著增加,而RSV预处理细胞后,NF-κB p65入核量显著减少,表明RSV可以抑制HCECs中TNF-α诱导的NF-κB通路的激活。此外,TNF-α诱导细胞炎症因子IL-1、IL-6、IL-8的表达增加,表明TNF-α通过激活NF-κB通路诱导HCECs炎症反应。RSV预处理HCECs后显著降低了炎症因子的表达。因此,RSV对HCECs炎症反应的抑制与RSV抑制NF-κB通路的激活有关。
由于角膜高度暴露在紫外线辐射和高氧张力下,因此易受氧化应激的影响。氧化应激与眼表炎症在内的其他多种眼部疾病的发病机制息息相关,氧化应激相关因子的表达水平可随炎症活动的增加而增加[3]。近年来,已有多项研究集中于探讨RSV对炎症和氧化应激的潜在抑制作用。RSV可以通过阻断Bax-caspase-3依赖性凋亡途径和抑制缺血后灌注损伤后视网膜胶质增生相关的炎症来预防视网膜神经节细胞凋亡[21];RSV可改善氧化应激和炎症反应下视网膜色素上皮细胞的细胞活力和抑制ROS产生[22]。在本研究中,通过H2O诱导HCECs发生氧化应激损伤。一定浓度的H2O2使细胞活力显著下降,RSV预处理细胞后,细胞活性较H2O2组有显著提高。且与H2O2组相比,RSV+H2O2组ROS荧光强度明显降低,表明RSV能有效抑制H2O2诱导产生的ROS,从而保护HCECs免受氧化应激损伤。
综上所述,本研究结果表明RSV对HCECs炎症和氧化应激反应具有抑制作用,其对HCECs炎症反应的抑制与抑制NF-κB通路激活有关。这为临床上防治眼表炎症提供了一种新的思路。
猜你喜欢
杂志排行
国际眼科杂志的其它文章
- 超广角眼底自发荧光在Stargardt病中的特征和应用价值
- lncRNA KCNQ1OT1通过miR-19a-3p/TSHZ3影响高糖诱导的人视网膜上皮细胞增殖与凋亡
- 超声造影在眼眶球后肿瘤诊断中的应用价值
- 国际眼科杂志中文版(IES)近5年影响因子趋势图
- 特别推荐:国际眼科理事会原主席Peter Wiedemann教授和Andreas Bringmann教授的最新专著
——The FOVEA - Preoperative intravitreal Ranibizumab with panretinal photocoagulation followed by conventional trabeculectomy without drainage device for neovascular glaucoma
