lncRNA KCNQ1OT1通过miR-19a-3p/TSHZ3影响高糖诱导的人视网膜上皮细胞增殖与凋亡
2021-12-06张妮红侯定善乔建治王洪亮
张妮红,侯定善,乔建治,付 珂,王洪亮
0引言
糖尿病视网膜病变是糖尿病的常见并发症,也是糖尿病患者视力障碍和失明的常见原因,但其发病机制仍有待阐明[1]。越来越多的证据表明,细胞凋亡和氧化应激是参与糖尿病视网膜病变发病机制的主要原因[2]。长链非编码RNA(long noncoding RNA,lncRNA)是长度超过200个核苷酸的非编码转录物[3]。最近研究报道,多种lncRNA作为直接或间接介质在糖尿病等进程中起关键作用[4]。lncRNA KCNQ1重叠转录物1(KCNQ1 overlapping transcript 1,KCNQ1OT1)定位于染色体11p15.5,被认为是多种肿瘤的致癌基因[5-6]。李莹等[7]在糖尿病肾病患者血清中检测出高水平的lncRNA KCNQ1OT1,另一项研究显示,lncRNA KCNQ1OT1在糖尿病视网膜病变患者和人视网膜内皮细胞中上调,通过调节微小RNA(microRNA,miRNA/miR)-1470和表皮生长因子受体影响糖尿病视网膜病变的进展[8]。然而,lncRNA KCNQ1OT1在高糖(high glucose,HG)诱导的视网膜上皮细胞损伤中的机制仍不清楚。miRNA的主要作用是调节翻译后基因的表达,通过与mRNA 3’非翻译区(untranslational region,UTR)结合而导致翻译破坏或抑制。由于miRNA调控的任何变化都与生理异常有关,因此这些分子可用于治疗或诊断诸如糖尿病及其并发症等疾病的生物标记[9]。糖尿病患者的miR-19a-3p水平显著降低,miR-19a-3p靶向细胞因子信号转导抑制因子3促进胰腺β细胞增殖和胰岛素分泌[10]。TSHZ3(teashirt zinc finger homeobox 3)作为miR-338-5p的靶基因,减弱miR-338-5p模拟物的侵袭效应[11]。但miR-19a-3p/TSHZ3是否参与lncRNA KCNQ1OT1在糖尿病视网膜病变中的调控机制仍未可知。本研究在人视网膜上皮细胞(ARPE-19)中利用HG构建糖尿病视网膜病变模型,研究lncRNA KCNQ1OT1在HG诱导的细胞增殖、凋亡和氧化应激中的作用,并进一步探讨了lncRNA KCNQ1OT1在糖尿病视网膜病变发病机制中的潜在机制。
1材料和方法
1.1材料ARPE-19(深圳豪地华拓),细胞计数试剂盒-8(cell counting kit-8,CCK-8)、膜联蛋白V-异硫氰酸荧光素(annexinv-fluorescein isothiocyanate,AnnexinV-FITC)/碘化丙啶(propidium iodide,PI)试剂盒、RIPA溶液、BCA蛋白质分析试剂盒(上海碧云天),活性氧(reactive oxygen species,ROS)酶联免疫吸附测定法(Enzyme-linked Immunosorbent Assay,ELISA)试剂盒、丙二醛(malondialdehyde,MDA)ELISA试剂盒(上海瓦兰),Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体、活化-含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved-cysteinyl aspartate specific proteinase 3,Cleaved-caspase-3)抗体、TSHZ3抗体(上海艾博抗)。
1.2方法
1.2.1细胞培养将ARPE-19细胞在37℃和5% CO2条件下含有10%胎牛血清的DMEM培养基中孵育。
1.2.2CCK-8法检测细胞存活率将ARPE-19细胞接种于96孔板,24h后分别以5、15、45、135mmol/L HG刺激细胞,同时以不加HG的ARPE-19细胞为NC组(对照)。48h后,以10μL CCK-8试剂孵育细胞2h,于酶标仪450nm处测量OD值,以实验组与对照组OD值之比来计算细胞存活率(%),确定最佳HG浓度。
1.2.3细胞转染取对数生长期ARPE-19细胞,将其培养至密度为80%左右,将lncRNA KCNQ1OT1的小干扰RNA(siRNA)(si-lncRNA KCNQ1OT1)和siRNA阴性对照(si-NC),miR-19a-3p模拟物(miR-19a-3p mimics)和阴性对照(miR-NC),TSHZ3 siRNA(si-TSHZ3)和阴性对照(si-con)分别转染至ARPE-19细胞,转染6h后用45mmol/L HG刺激48h,记为si-NC+45mmol/L HG组、si-lncRNA KCNQ1OT1+45mmol/L HG组、miR-NC+45mmol/L HG组、miR-19a-3p mimics+45mmol/L HG组、si-con+45mmol/L HG组、si-TSHZ3+45mmol/L HG组;将TSHZ3过表达载体(pcDNA-TSHZ3)、过表达空载体(pcDNA)分别与si-lncRNA KCNQ1OT1共转染至ARPE-19细胞,转染6h后用45mmol/L HG刺激48h,记为pcDNA+si-lncRNA KCNQ1OT1+45mmol/L HG组、pcDNA-TSHZ3+si-lncRNA KCNQ1OT1+45mmol/L HG组。所有序列均由广州RiboBio合成。45mmol/L HG刺激48h的ARPE-19细胞记为45mmol/L HG组,不加HG培养的正常细胞为NC组(对照)。利用CCK-8法检测ARPE-19细胞存活率,并进行其他实验。
1.2.4qRT-PCR检测lncRNAKCNQ1OT1和miR-19a-3p及TSHZ3mRNA表达使用TRIzol提取ARPE-19细胞的总RNA。在NanoDrop分光光度计检测RNA的浓度。使用逆转录试剂盒对RNA进行反转录。使用SYBR Green试剂盒通过ABI 7500快速实时PCR系统对cDNA进行扩增和检测。根据2-ΔΔCT方法计算基因的相对表达水平。GAPDH用作lncRNA和mRNA的内部对照。U6用作miRNA的内部对照。引物序列如下:lncRNA KCNQ1OT1正向:5’-GCACTCTGGGTCCTGTTCTC-3’,反向:5’-CACTTCCCTGCCTCCTACAC-3’。miR-19a-3p正向:5’-CGCTGTGCAAATCTATGCAA-3’,反向:5’-CGGCCCAGTGTTCAGACTAC-3’。TSHZ3正向:5’-CAGAGGAGCATACG GCAGAT-3’,反向:5’-TGTGTGACTCGCTGTCCATT-3’。GAPDH正向:5’-ATCACTGCCACCCAGAAGAC-3’,反向:5’-TTTCTAGACGGCAGGTCAGG-3’。U6正向:5’-CTCGCTTCGGCAGCACA-3’,反向:5’-AACGCTTCACGAATTTGCGT-3’。
1.2.5流式细胞仪检测细胞凋亡情况收集ARPE-19细胞,在4℃、黑暗中用10μL FITC-Annexin V和10μL PI(0.5mg/mL)对细胞进行染色,然后使用流式细胞仪检测凋亡细胞。以早期和晚期凋亡细胞的百分比来计算凋亡率。使用Flowjo软件通过FACScan流式细胞仪分析数据。
1.2.6WesternBlot检测TSHZ3和Cleaved-caspase-3及Bax蛋白质的表达情况将ARPE-19细胞与RIPA溶液混合以提取总蛋白,并使用BCA蛋白质分析试剂盒进行定量。在100℃沸水中将蛋白质变性10min。然后,通过12% SDS-PAGE分离25μg蛋白,并将其转移到聚偏二氟乙烯膜上。TSHZ3、Cleaved-caspase-3、Bax和β-肌动蛋白(β-actin;对照)抗体在5%封闭缓冲液中以1∶1000的稀释度制备,并用于4℃下与膜过夜孵育。随后,在室温下将膜用辣根过氧化物酶标记的二抗探测1h。冲洗后,将膜转移到Bio-Rad ChemiDoc XRS系统中,并以ECL发光底物产生信号,通过Image Lab软件进行捕获和分析。
1.2.7ELISA检测氧化应激指标ROS和MDA水平各组ARPE-19细胞以2000r/min离心20min,收集细胞上清液,分别按照ROS ELISA试剂盒、MDA ELISA试剂盒的操作说明,检测ROS、MDA水平。
1.2.8双荧光素酶检测活性用LncBase Predicted v.2软件预测lncRNA KCNQ1OT1和miR-19a-3p之间的靶向结合区域,用targetscan软件预测miR-19a-3p和TSHZ3之间的靶向结合区域。分别构建含有miR-19a-3p结合位点的lncRNA KCNQ1OT1-野生型(WT)、突变型(MUT)报告基因载体lncRNA KCNQ1OT1-WT、lncRNA KCNQ1OT1-MUT,以及含有miR-19a-3p结合位点的TSHZ3-3’UTR-WT及MUT报告基因载体TSHZ3-3’UTR-WT、TSHZ3-3’UTR-MUT。随后,利用Lipofectamine 2000在ARPE-19细胞中共转染miR-19a-3p模拟物或miR-NC与lncRNA KCNQ1OT1-WT、lncRNA KCNQ1OT1-MUT、TSHZ3-3’UTR-WT或TSHZ3-3’UTR-MUT报告基因载体,48h后进行双荧光素酶活性检测。另在ARPE-19细胞中转染pcDNA-lncRNA KCNQ1OT1、pcDNA、si-lncRNA KCNQ1OT1、si-NC、miR-19a-3p模拟物、miR-NC、anti-miR-19a-3p、anti-miR-NC,以及共转染miR-19a-3p模拟物与pcDNA-lncRNA KCNQ1OT1、miR-19a-3p模拟物与pcDNA,anti-miR-19a-3p与si-lncRNA KCNQ1OT1、anti-miR-19a-3p与si-NC,利用qRT-PCR、Western Blot检测lncRNA KCNQ1OT1、miR-19a-3p和TSHZ3蛋白表达,分析lncRNA KCNQ1OT1和miR-19a-3p、miR-19a-3p和TSHZ3之间的靶向调控。

2结果
2.1不同浓度HG对ARPE-19细胞存活率的影响5、15、45、135mmol/L HG处理ARPE-19后,细胞的存活率分别为(98.13±6.02)%、(79.03±4.25)%、(55.76±3.27)%、(39.76±2.53)%,均低于NC组的(100.00±8.13)%,其中5mmol/L HG组与NC组之间差异无统计学意义(P>0.05),15、45、135mmol/L HG组与NC组之间差异均有统计学意义(均P<0.05)。后续选择ARPE-19存活率接近一半时的HG浓度45mmol/L。
2.245mmol/LHG处理ARPE-19中lncRNAKCNQ1OT1和miR-19a-3p及TSHZ3表达水平45mmol/L HG组ARPE-19细胞中lncRNA KCNQ1OT1表达水平高于NC组,miR-19a-3p表达水平低于NC组,TSHZ3 mRNA和TSHZ3蛋白表达水平均高于NC组,差异均有统计学意义(均P<0.05),见表1、图1。
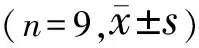
表1 45mmol/L HG处理ARPE-19细胞中lncRNA KCNQ1OT1和miR-19a-3p及TSHZ3表达水平

图1 Western Blot检测TSHZ3蛋白质的表达。
2.3lncRNAKCNQ1OT1低表达抑制HG对ARPE-19细胞存活率和凋亡以及氧化应激的影响与NC组比较,45mmol/L HG组ARPE-19细胞中lncRNA KCNQ1OT1表达水平升高,细胞存活率降低,凋亡率、Cleaved-caspase-3、Bax蛋白表达水平增加,ROS和MDA水平增加,差异均有统计学意义(均P<0.05)。与si-NC+45mmol/L HG组比较,si-lncRNA KCNQ1OT1+45mmol/L HG组ARPE-19细胞中lncRNA KCNQ1OT1表达水平降低,细胞存活率升高,凋亡率、Cleaved-caspase-3、Bax蛋白表达水平减少,ROS和MDA水平减少,差异均有统计学意义(均P<0.05),见表2、图2。
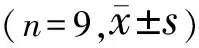
表2 lncRNA KCNQ1OT1低表达抑制HG对ARPE-19细胞存活率和凋亡以及氧化应激的影响
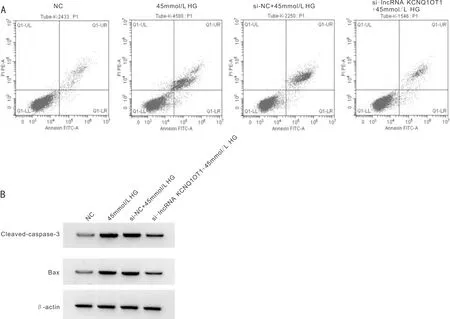
图2 lncRNA KCNQ1OT1低表达抑制HG对ARPE-19细胞存活率和凋亡以及氧化应激的影响 A:流式细胞仪检测细胞凋亡;B:Western Blot检测Cleaved-caspase-3、Bax蛋白质的表达。
2.4miR-19a-3p模拟物抑制HG对ARPE-19细胞存活率和凋亡以及氧化应激的影响与miR-NC+45mmol/L HG组比较,miR-19a-3p mimics+45mmol/L HG组ARPE-19细胞中miR-19a-3p表达水平、细胞存活率升高,凋亡率、Cleaved-caspase-3、Bax蛋白表达、ROS和MDA水平减少,差异均有统计学意义(均P<0.05),见表3、图3。
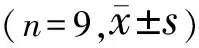
表3 miR-19a-3p模拟物抑制HG对ARPE-19细胞存活率和凋亡以及氧化应激的影响
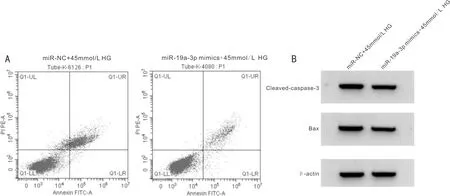
图3 miR-19a-3p模拟物抑制HG对ARPE-19细胞存活率和凋亡以及氧化应激的影响 A:流式细胞仪检测细胞凋亡;B:Western Blot检测Cleaved-caspase-3、Bax蛋白质的表达。
2.5si-TSHZ3抑制HG对ARPE-19细胞存活率和凋亡以及氧化应激的影响si-TSHZ3+45mmol/L HG组ARPE-19细胞中TSHZ3表达水平比si-con+45mmol/L HG组低,细胞存活率比si-con+45mmol/L HG组高,凋亡率、Cleaved-caspase-3、Bax蛋白表达、ROS和MDA水平比si-con+45mmol/L HG组低,差异均有统计学意义(均P<0.05),见表4、图4。
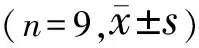
表4 si-TSHZ3抑制HG对ARPE-19细胞存活率和凋亡以及氧化应激的影响
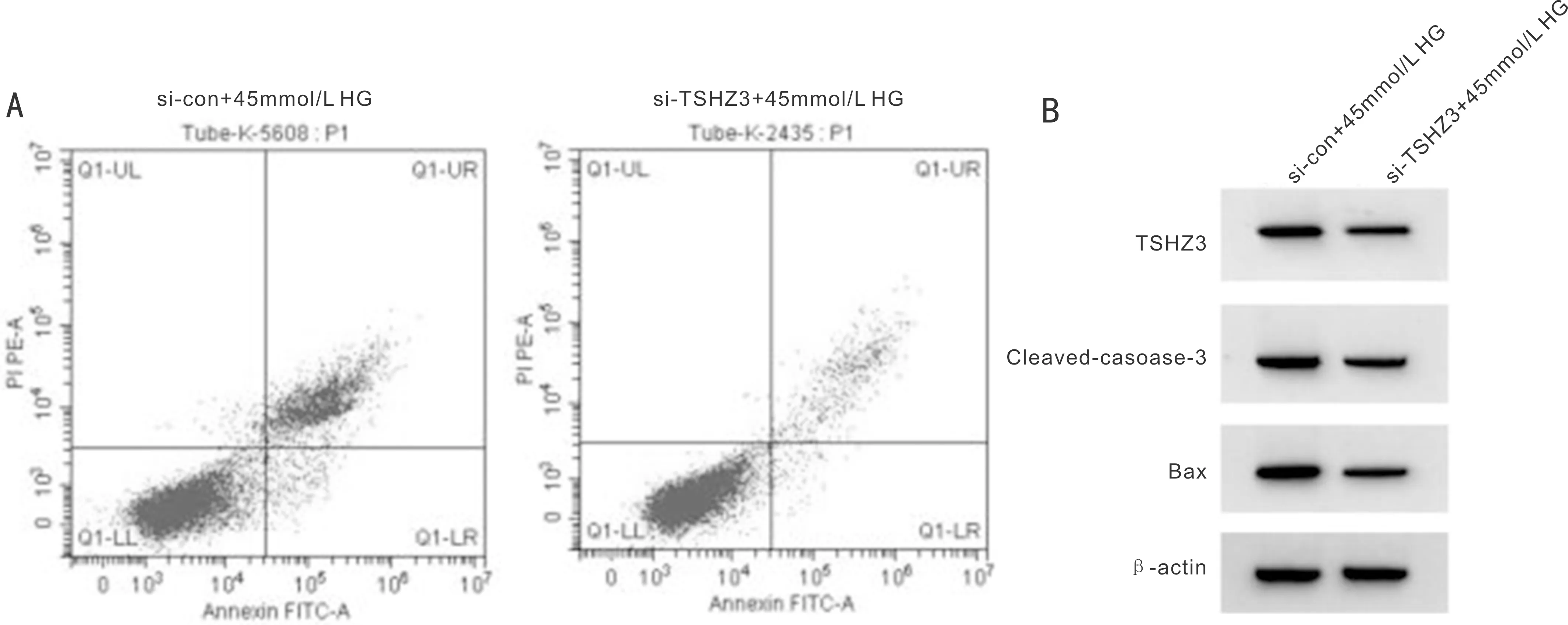
图4 si-TSHZ3抑制HG对ARPE-19细胞存活率和凋亡以及氧化应激的影响 A:流式细胞仪检测细胞凋亡;B:Western Blot检测TSHZ3、Cleaved-caspase-3、Bax蛋白质的表达
2.6lncRNAKCNQ1OT13通过miR-19a-3p调控TSHZ3的表达LncBase Predicted v.2、targetscan分别对lncRNA KCNQ1OT1和miR-19a-3p、miR-19a-3p和TSHZ3之间的靶向结合进行预测,见图5。miR-19a-3p组lncRNA KCNQ1OT1-WT相对荧光素酶活性低于miR-NC组,差异均有统计学意义(均P<0.05);miR-19a-3p组与miR-NC组lncRNA KCNQ1OT1-MUT相对荧光素酶活性差异无统计学意义(P>0.01);miR-19a-3p组TSHZ3-3’UTR-WT相对荧光素酶活性低于miR-NC组,差异有统计学意义(P<0.01);miR-19a-3p组与miR-NC组TSHZ3-3’UTR-MUT相对荧光素酶活性差异无统计学意义(P>0.05),见表5。pcDNA-lncRNA KCNQ1OT1组lncRNA KCNQ1OT1表达水平比pcDNA组高,miR-19a-3p表达水平比pcDNA组低,差异均有统计学意义(均P<0.05);si-lncRNA KCNQ1OT1组lncRNA KCNQ1OT1表达水平比si-NC组低,miR-19a-3p表达水平比si-NC组高,差异均有统计学意义(均P<0.05),见表6。miR-19a-3p组miR-19a-3p表达水平比miR-NC组高,TSHZ3蛋白表达水平比miR-NC组低,差异均有统计学意义(均P<0.05);anti-miR-19a-3p组miR-19a-3p表达水平比anti-miR-NC组低,TSHZ3蛋白表达水平比anti-miR-NC组高,差异均有统计学意义(均P<0.05),见图5C、表7。miR-19a-3p+pcDNA-lncRNA KCNQ1OT1组TSHZ3蛋白表达水平比miR-19a-3p+pcDNA组高,anti-miR-19a-3p+si-lncRNA KCNQ1OT1组TSHZ3蛋白表达水平比anti-miR-19a-3p+si-NC组低,差异均有统计学意义(均P<0.05),见图5D、表8。
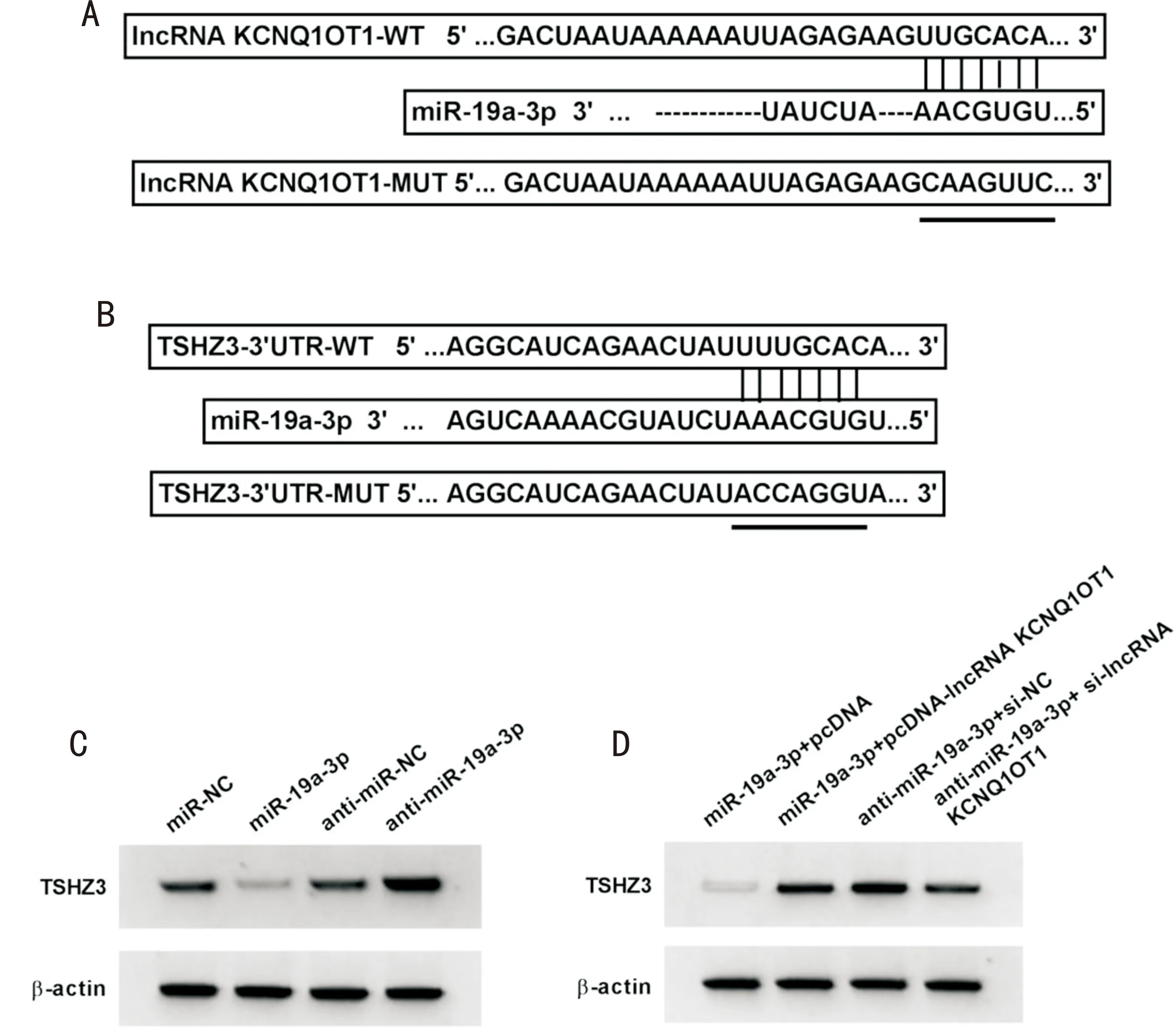
图5 lncRNA KCNQ1OT13通过miR-19a-3p调控TSHZ3的表达 A:LncBase Predicted v.2预测lncRNA KCNQ1OT1和miR-19a-3p之间的靶向结合区域;B:targetscan预测miR-19a-3p和TSHZ3之间的靶向结合区域;C:Western Blot检测miR-19a-3p调控TSHZ3蛋白质的表达;D:Western Blot检测lncRNA KCNQ1OT13通过miR-19a-3p调控TSHZ3蛋白质的表达。
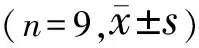
表5 ARPE-19细胞相对双荧光素酶活性检测
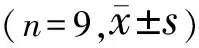
表6 qRT-PCR检测miR-19a-3p的表达
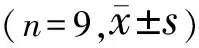
表7 Western Blot检测TSHZ3蛋白表达
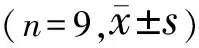
表8 lncRNA KCNQ1OT1通过miR-19a-3p调控TSHZ3蛋白质的表达
2.7TSHZ3过表达可以逆转lncRNAKCNQ1OT1低表达对HG处理的ARPE-19细胞存活率和凋亡以及氧化应激的影响与si-lncRNA KCNQ1OT1+45mmol/L HG组比较,pcDNA+si-lncRNA KCNQ1OT1+45mmol/L HG组ARPE-19细胞TSHZ3蛋白表达、存活率、凋亡以及氧化应激均无统计学意义(均P>0.05);而pcDNA-TSHZ3+si-lncRNA KCNQ1OT1+45mmol/L HG组ARPE-19细胞中TSHZ3表达水平升高,存活率降低,凋亡率、Cleaved-caspase-3、Bax蛋白表达、ROS和MDA水平增加,差异均有统计学意义(均P<0.05),见表9,图6。

图6 TSHZ3过表达可以逆转lncRNA KCNQ1OT1低表达对HG处理的ARPE-19细胞存活率和凋亡以及氧化应激的影响 A:流式细胞仪检测细胞凋亡;B:Western Blot检测TSHZ3、Cleaved-caspase-3、Bax蛋白质的表达。
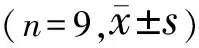
表9 TSHZ3过表达可以逆转lncRNA KCNQ1OT1低表达对HG处理的ARPE-19细胞存活率和凋亡以及氧化应激的影响
3讨论
最近研究显示出lncRNA在眼组织中差异表达,并在诸如青光眼、角膜疾病、白内障、糖尿病视网膜病变和眼肿瘤的眼科疾病的发病机制中起重要作用[12]。证据表明,lncRNA KCNQ1OT1在糖尿病患者、HG诱导的心肌细胞和糖尿病小鼠心脏组织中表达增加[13]。lncRNA KCNQ1OT1促进了ARPE-19细胞的增殖和血管生成,相反,在HG诱导的ARPE-19细胞中,敲低lncRNA KCNQ1OT1诱导细胞的凋亡并抑制其增殖[8]。lncRNA KCNQ1OT1可能作为竞争性内源性RNA结合miR-214来调节caspase-1的表达,诱导HG处理的角膜内皮细胞的焦亡[14]。此外,在HG条件下,lncRNA KCNQ1OT1敲低可通过miR-26a-5p/ITGAV/TGF-β/Smad3轴抑制晶状体上皮细胞的活力、迁移和上皮间质转化[15]。本研究发现了类似的结果,即HG使ARPE-19细胞中lncRNA KCNQ1OT1表达上调,而lncRNA KCNQ1OT1低表达使HG诱导的ARPE-19细胞的增殖升高,细胞凋亡降低,这与之前报道[8]一致,提示lncRNA KCNQ1OT1可能加速糖尿病视网膜病变。且lncRNA KCNQ1OT1低表达后,细胞凋亡的关键执行蛋白Bax、Cleaved-caspase-3水平降低,氧化应激标志ROS、MDA水平同样降低。此前,lncRNA KCNQ1OT1的敲除被证明可以减弱HG导致的细胞ROS、MDA水平升高[16-17]。这些结果说明lncRNA KCNQ1OT1低表达通过促进视网膜上皮细胞的增殖、减弱细胞凋亡与氧化应激,来保护HG诱导后视网膜上皮细胞的损伤。
越来越多的证据表明,lncRNA与miRNA竞争性结合以调节靶基因的表达[18]。在线预测软件预测miR-19a-3p可能是lncRNA KCNQ1OT1的下游靶标。先前的研究表明,糖尿病患者的血浆miR-19a-3p水平和血糖浓度之间显著负相关,表明miR-19a-3p的负调节与糖尿病的进展有关[10]。miR-19a-3p过表达减轻缺血再灌注损伤模型中神经元细胞的氧化应激和凋亡[19]。在这项研究中,HG诱导ARPE-19细胞后,miR-19a-3p表达降低,miR-19a-3p模拟物提高HG诱导的ARPE-19细胞增殖,降低凋亡和氧化应激水平。这与以前的报道[10, 18]相似。此外,lncRNA KCNQ1OT1直接靶向miR-19a-3p,并通过使miR-19a-3p海绵化来调节HG诱导的视网膜上皮细胞损伤。
TSHZ3编码锌指转录因子,并在发育中的人类新皮层中高度表达[20]。研究表明,在DNA损伤的神经干细胞中,TSHZ3的表达与DNA损伤程度有关,并且TSHZ3作为miR-125b-1-3p的靶基因,介导大鼠椎间盘退变[21]。在本研究中,miR-19a-3p在ARPE-19细胞中直接靶向TSHZ3,并对TSHZ3表达起负调控作用。si-TSHZ3提高HG诱导的ARPE-19细胞增殖,降低凋亡和氧化应激水平。lncRNA KCNQ1OT1通过靶向miR-19a-3p来调节TSHZ3表达,lncRNA KCNQ1OT1低表达对HG诱导的ARPE-19细胞存活率、凋亡以及氧化应激的影响被TSHZ3过表达所逆转。这些结果说明,lncRNA KCNQ1OT1通过miR-19a-3p/TSHZ3来调节HG诱导的视网膜上皮细胞增殖、凋亡和氧化应激。
总之,lncRNA KCNQ1OT1可以通过靶向miR-19a-3p来调节TSHZ3的表达。此外,lncRNA KCNQ1OT1低表达通过介导miR-19a-3p和TSHZ3改善了高糖诱导的视网膜上皮细胞损伤。提示lncRNA KCNQ1OT1/miR-19a-3p/TSHZ3轴可能是糖尿病视网膜病变的潜在治疗靶标。
猜你喜欢
杂志排行
国际眼科杂志的其它文章
- 超广角眼底自发荧光在Stargardt病中的特征和应用价值
- 白藜芦醇对人角膜上皮细胞炎症和氧化应激损伤的保护作用
- 超声造影在眼眶球后肿瘤诊断中的应用价值
- 国际眼科杂志中文版(IES)近5年影响因子趋势图
- 特别推荐:国际眼科理事会原主席Peter Wiedemann教授和Andreas Bringmann教授的最新专著
——The FOVEA - Preoperative intravitreal Ranibizumab with panretinal photocoagulation followed by conventional trabeculectomy without drainage device for neovascular glaucoma
