建立CBA小鼠隐性听力损失模型的研究
2021-12-04胡金池汪海燕桂飞刘双燕宋丹丹洪玉杨磊
胡金池,汪海燕,桂飞,刘双燕,宋丹丹,洪玉,杨磊,*
(1 石河子大学医学院,新疆 石河子 832000;2 杭州师范大学医学部,浙江 杭州 310036)
噪声性耳聋是我国目前面临的一个潜在的严重的公众健康问题,2020 年国家卫生健康委员会发布的全国职业病报告情况显示,噪声性耳聋已成为我国继职业性尘肺病之后的第二大高发职业病[1-2]。其中备受关注的是 2015 年首次提出的噪声所致的“隐性听力损失”[3]。
隐性听力损失(Hidden hearing loss)表现为适度噪声暴露导致的听力阈值出现暂时性阈移(Temporary Threshold Shift)[4-8],这些变化可在数天或数周内恢复[9]。尽管对安静环境下的听力无明显的影响,但其引起的声音信号的编码问题会导致在嘈杂的环境中语音辨别力及清晰度下降[4,10]。
隐性听力损失的主要病理学表现是听觉传导通路中内毛细胞-螺旋神经节突触部分丢失,而内外毛细胞、支持细胞、神经纤维等无明显损伤。由于脱离噪声环境后,听力阈值可恢复至正常范围内,长期以来隐性听力损失被认为不会引起听觉系统的永久损伤。然而有研究表明,噪声引起的隐性听力损失所导致的内毛细胞-螺旋神经节突触的损伤是不可逆的,破坏了声音信号的精确编码和传导,从而引发听神经功能的缺陷[4,11]。
目前国内外关于隐性听力损失动物模型建立的研究十分有限,且不同课题组所用噪音强度等条件存在一定差异,尚未形成公认、可靠的动物模型建立的噪声条件[12]。本文将探索对隐性听力损失动物模型建立的噪声条件,为隐性听力损失的研究奠定重要实验基础。
1 材料与方法
1.1 实验动物饲养及分组
CBA小鼠(4~6周龄)根据噪声强度不同分为8个级别,强度分别为100、98、96、94、93、92、91、90 dB SPL,每种噪声强度分别分为pre-noise/post-noise、1 d/post-noise、3 d/post-noise、7 d/post-noise、14 d 5组,每组各8只,用于建模。CBA小鼠购自上海斯莱克公司,于杭州师范大学实验动物中心SPF 级动物房饲养,适应性饲养1周,饲养环境:温度22 ℃~24 ℃,湿度60%,正常饮食、饮水。本研究的动物实验符合杭州师范大学动物中心动物准则和美国国家健康委员会出版的实验室动物福利和使用准则(NIH Publication NO.85-23,revised 2011),由杭州师范大学实验室动物管理委员会批准实施。
1.2 实验动物CBA小鼠的筛选及纳入标准
每组动物在造模之前运用听性脑干反应测试仪(美国TDT公司auditory brainstem response,ABR)进行听性脑干反应(Auditory brainstem response,ABR)阈值检测,确定其听力正常(即click听力阈值为20±5 dB;Tone听力阈值中8 kHz/16 kHz为30±10 dB,32 kHz为40±10 dB),以明确造模后产生的各指标变化是源于噪声暴露损伤而非先天性耳聋。
1.3 隐性听力损失模型的噪声暴露条件
ABR检测筛选出的听力正常健康CBA小鼠为受试动物,给予高强度脉冲噪音暴露,每次2只。噪音暴露前需用声级计对暴露环境进行噪声校准,以确保暴露条件准确且一致。条件:噪声频率8-16 kHz,噪声强度分别为100、98、96、94、93、92、91、90 dB SPL,噪声暴露时间为2 h。
1.4 听性脑干反应(ABR)检测
造模后1、3、7、14 d时进行ABR检测听力功能。CBA小鼠(4~6周龄)予4.25%水合氯醛腹腔注射(0.01 mL·g-1)麻醉后置标准屏蔽隔音室内,通过美国TDT公司听觉诱发电位仪进行检测。麻醉后的动物置于恒温加热垫上维持体温,以保证电生理检测的稳定性。将听觉诱发电位仪TDT RZ6的记录电极插入皮下置于上述动物两耳连线的中间点颅顶处,测量电极插入皮下置于给声耳部乳突皮下,接地电极置于对侧耳部乳突处皮下,外置放大器放在检测耳一侧,水平放置,距离外耳道约10 cm的位置。检测阻抗,小于3 KΩ 即可开启软件操作。打开系统软件SigGen RP,使用click burst刺激,采用20次·s-1的频率,扫描时间为10 ms,滤波范围为100~3000 Hz,叠加次数为1024次,刺激强度为90~10 dB SPL,从90 dB SPL开始,每10 dB SPL递减,直到特征性的脑电波消失,将该波对应的声音强度记录为该动物的听力阈值,80 dB的Ⅰ波峰值记录潜伏期,波峰到波谷为振幅。每只动物的左右耳分别检测听力阈值。
1.5 耳蜗基底膜样本的制备
造模后CBA小鼠进行ABR听功能检测后,脱颈椎处死,用剪刀于动物后颈部剪开,然后依次剪开头部皮肤,沿颅骨中线剪开颅骨,去除脑部组织部分,找到颞骨,将两侧颞骨往外翻折,暴露两侧听泡。用剪刀去除周围组织,打开听泡,取出耳蜗。用1 mL注射器于蜗尖钻一个小孔,置于4% PFA溶液中,4 ℃条件下固定24 h 以上,用1×PBS清洗3次,每次15 min,再用0.5 M EDTA(pH 7.0)常温脱钙3~4 d。然后在解剖显微镜(Zeiss,Stemi 508)下,去除蜗壳、螺旋韧带、前庭膜及盖膜,得到基底膜,浸泡于1×PBS中,待行组织免疫荧光检测。
1.6 基底膜免疫荧光染色
取出的基底膜用1×PBS室温清洗3次,每次15 min。封闭液(10% 马血清+0.03% 皂苷,用0.1% TritonX-100的1×PBS配置)室温封闭1 h。用抗体稀释液(3% 马血清 + 0.03% 皂苷 + 3% BSA,用0.1% TritonX-100的1×PBS配置)按比例稀释一抗(Recombinant Anti-Myosin VIIa,abcam,ab150386,1∶1000;Anti-SOX2 antibody,abcan,ab79351,1∶500;Anti-Neurofilament heavy polypeptide antibody,abcam,ab4680,1∶500;mouse anti-CtBP2 IgG1,BD,612044,1∶200;mouse anti-GluA2 IgG2a,Millipore,MABN1189,1∶2000)后,于4 ℃ 冰箱放置过夜。0.1% PBST清洗3次,每次30 min。用抗体稀释液按比例稀释二抗(Alexa Fluor 633 goat Anti-Rabbit IgG(H+L),Invitrogen,A21070,1∶500;山羊抗鼠TRITC,中杉金桥,ZF0313,1∶500;Alexa Fluor© 488-AffiniPure Donkey Anti-Chicken,Invitrogen,A11039,1∶500;Goat anti-mouse IgG 1,Invitrogen,M32018,1∶100;Goat anti-Mouse IgG2a Secondary Antibody Biotin,Invitrogen,M32315,1∶5000)后于常温结合2 h。弃二抗,用1×PBS清洗3次,每次15 min。若内外毛细胞、支持细胞、神经纤维免疫荧光染色,直接将组织转移到载玻片上,正面朝上,加入20 μL 含DAPI封片剂(abcam,ab104139),盖玻片封片(注意尽量不要有气泡存在),暗盒中放置12 h左右,待封片剂凝固,进行共聚焦拍摄(蔡司,LSM710)。若突触免疫荧光染色,链霉亲和素(Streptavidin,Alexa FluorTM568 conjugate,Invitrogen,S11226)用1×PBS按1∶500稀释后室温结合1 h,用1×PBS清洗3次,每次15 min,然后将组织转移到载玻片上,正面朝上,加入20 μL 含DAPI封片剂,盖玻片封片(注意尽量不要有气泡存在),暗盒中放置12 h左右,待封片剂凝固,进行共聚焦拍摄。
1.7 统计学分析
数据运用 SPSS statistics 22 软件处理,首先分析其正态性,满足正态分布后,采用独立样本 t 检测,分析各组数据之间的差异,*P< 0.05,**P< 0.01,***P< 0.001,认为有显著性差异。
2 结果
2.1 不同噪声暴露条件下CBA小鼠的ABR 听功能检测结果
CBA小鼠经ABR 听功能检测结果显示均为听力正常小鼠,可用于建立隐型听力损失动物模型。
将筛选出的听功能正常的CBA小鼠(4~6周龄)在8~16 kHz范围内于100、98、96、94、93、92、91、90 dB SPL条件下进行2 h的噪声暴露。ABR听功能检测结果统计学分析显示,100、98、96、94、93、92 dB建模后ABR click听力阈值在1 d均有大幅度上升,3、7 d有部分恢复,但14 d后未恢复至正常;Ⅰ波振幅1 d大幅度减小,3、7 d基本无回复,14 d有较小恢复(图1A,B);潜伏期无明显变化(结果未显示)。ABR Tone听力阈值与ABR click听力阈值趋势相同,在建模后1 d听力阈值均有大幅度上升,3、7 d有较小程度的恢复,但14 d后听力阈值未恢复至正常;Ⅰ波振幅1 d大幅度减小,3、7 d基本无回复,14 d有较小恢复(图1C,D);潜伏期无明显变化(结果未显示)。
91 dB 条件下ABR click听力阈值在1 d有大幅度上升,3、7 d有部分恢复,14 d后恢复正常(图1A,B);Ⅰ波振幅有显著减小,3、7、14 d均有一定的恢复,但14 d并未恢复至正常(图2A);潜伏期无明显变化(图2B)。ABR Tone听力阈值在1 d有大幅度上升,3、7 d有部分恢复,14 d后恢复正常(除32 kHz外)(图1C,D);Ⅰ波振幅1 d 有显著减小,3、7、14 d均有一定的恢复,但14 d并未恢复至正常(图2C);潜伏期无明显变化(图2D)。
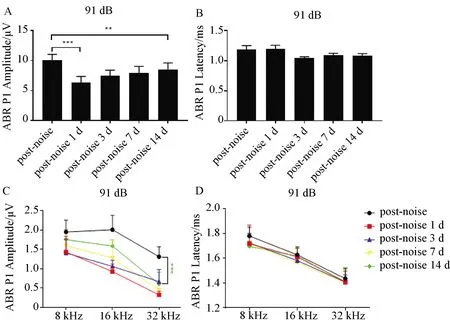
A:91 dB组ABR click在80 dBⅠ波振幅在噪音损伤后明显变小,14 d后有一定的恢复;B:91 dB组ABR click在80 dBⅠ波潜伏期在无明显变化;C:91 dB组ABR Tone在80 dBⅠ波振幅在噪音损伤后明显变小,14 d后有一定的恢复32 kHz未恢复;D:91 dB组ABR Tone在80 dBⅠ波潜伏期在无明显变化,(N=8),*P<0.05,**P < 0.01,***P < 0.001。
90 dB ABR click听力阈值在1 d时只有10 dB听力阈值的上升;3、7、14 d 恢复至正常;Ⅰ波振幅1 d有显著减小,3、7、14 d均有一定的恢复,但14 d并未恢复至正常(图1A,B);潜伏期无明显变化(结果未显示)。ABR Tone听力阈值在1 d时只有10 dB左右的听力阈值的上升(图1C,D);Ⅰ波振幅1 d 有显著减小,3、7、14 d均有一定的恢复,但14 d并未恢复至正常;潜伏期无明显变化(结果未显示)。
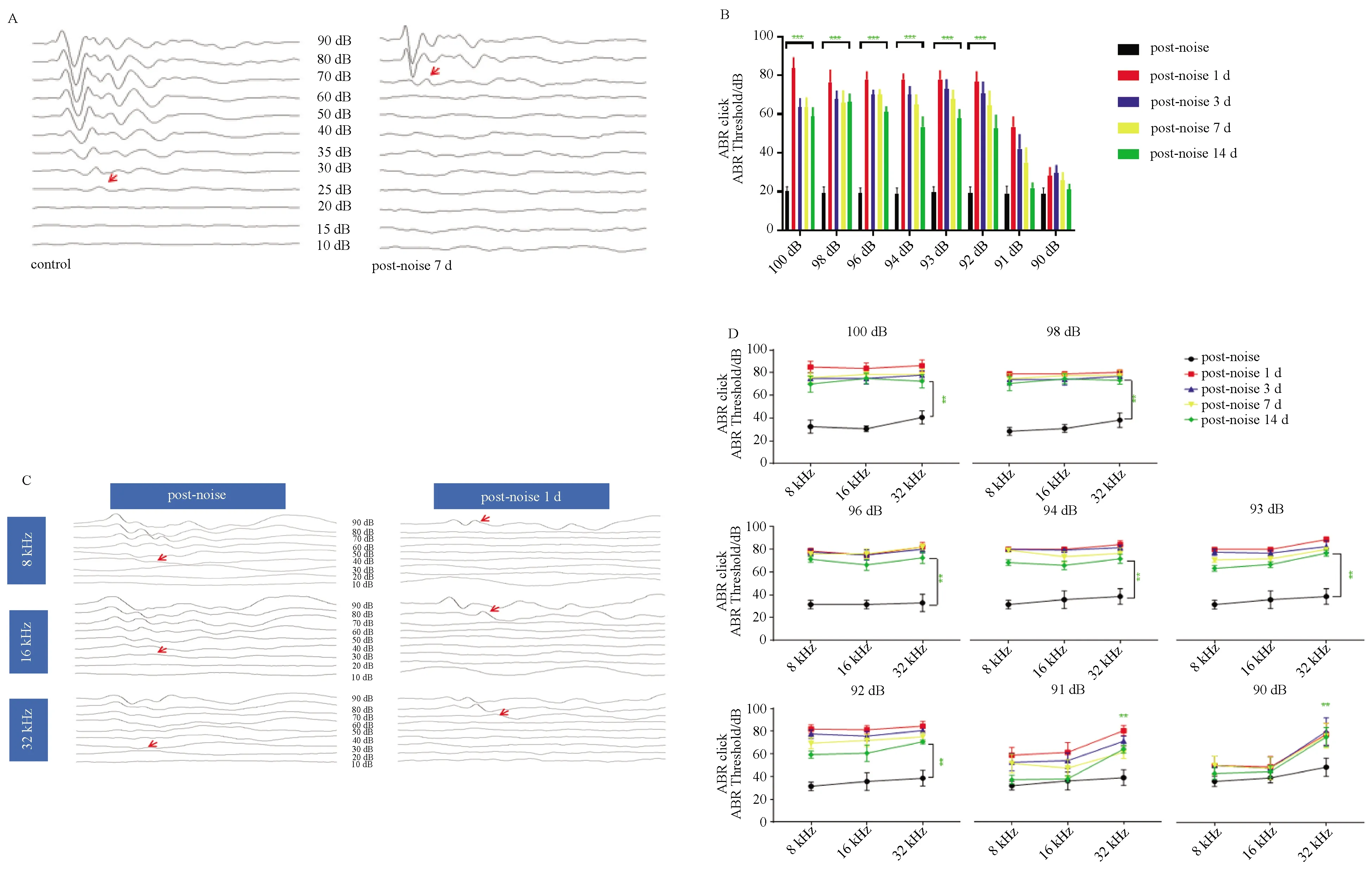
A:噪音损伤前后CBA小鼠ABR click 波形图变化(以94 dB为例),红箭头标记为各自对应阈值;B:不同噪音损伤条件后各时间点CBA小鼠click听力阈值的变化情况;C:噪音损伤前后CBA小鼠ABR Tone 波形图变化(以94 dB为例),红箭头标记为各自对应阈值;D:100-90 dB条件下损伤前后CBA小鼠各频率听力阈值变化,(N=8),*P<0.05,**P < 0.01,***P < 0.001。
综合分析以上结果,8~16 kHz,91 dB SPL的噪音损伤2 h可用于建立可逆的隐性听力损失模型。
2.2 耳蜗基底膜各组分形态学检测
将8~16 kHz,91 dB SPL噪音曝露2 h的动物处死后,取耳蜗,固定、脱钙、去蜗壳、分离螺旋韧带后取出基底膜进行铺片,免疫荧光染色观察噪音损伤前后,耳蜗内外毛细胞、支持细胞、神经纤维以及内毛细胞与螺旋神经节间突触的改变。经统计学分析,结果显示噪声损伤后,CBA小鼠的内外毛细胞、支持细胞、神经纤维均无明显变化(如图3A~G)。噪音损伤后1 d突触数量明显减少,且出现单独 CtBp2或 GluA2信号点;3、7 d突触数量有一定的恢复,14 d后发现突触数量并没有恢复至正常水平,出现部分永久性丢失,且恢复的突触中单独CtBp2或 GluA2信号点较多,有效突触对较少(如图4A~D)。
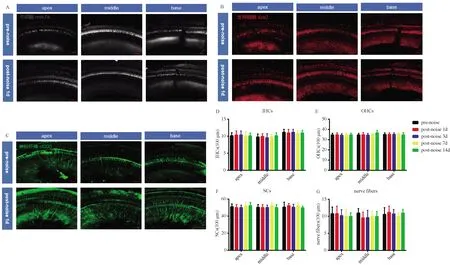
A~C:pre-noise组与post-noise 1 d组基底膜内外毛细胞、支持细胞、神经纤维免疫荧光检测。内外毛细胞为灰色;支持细胞为红色;神经纤维为绿色,bar=50 μm;D~G:pre-noise组与post-noise 1 d组基底膜内外毛细胞、支持细胞、神经纤维数量统计。(N=8)
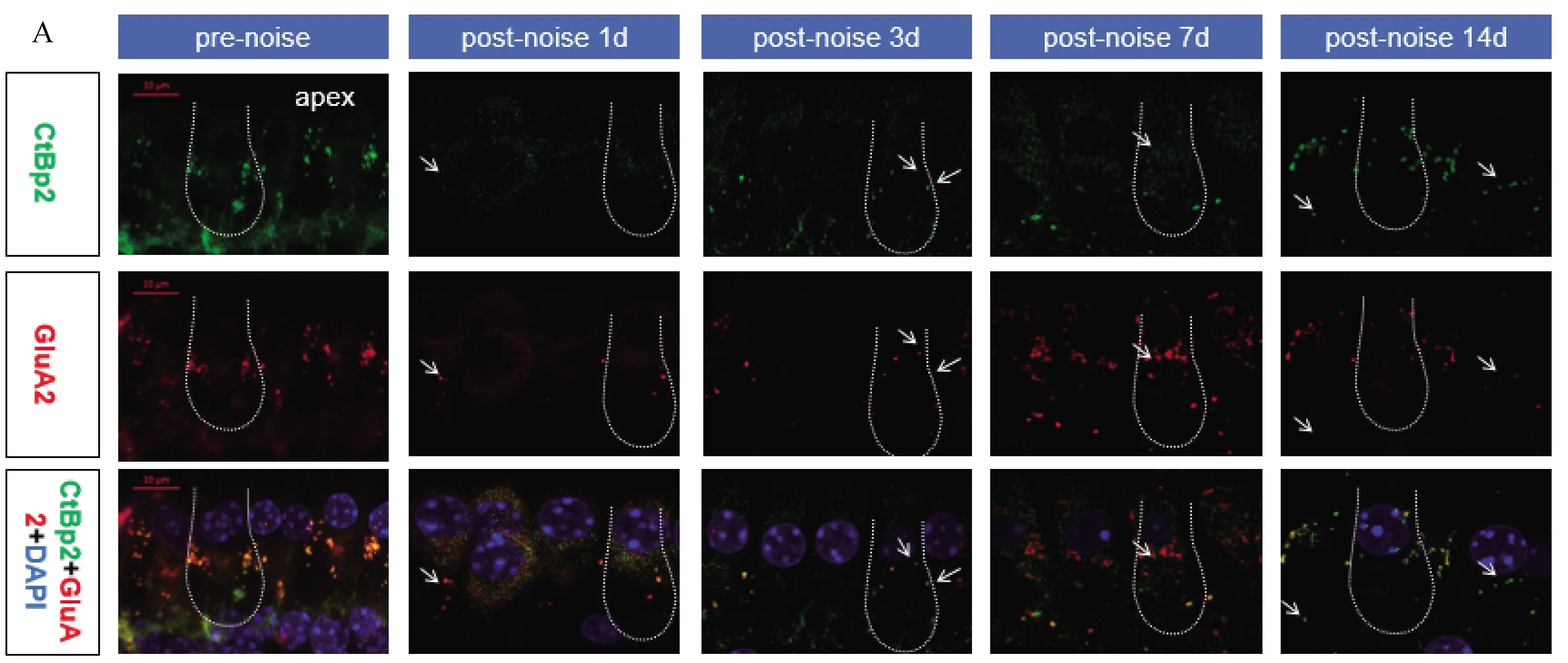
A~C:pre-noise组与post-noise 1、3、7、14 d组基底膜apex/middle/base内毛细胞突触免疫荧光检测。突触前膜标记物CtBP2为绿色;后膜标记物GluA2红色;虚线所圈为一个内毛细胞;白色箭头所指为单独CtBP2/GluA2信号点;bar=10 μm。D:pre-noise组与post-noise 1、3、7、14 d组基底膜apex/middle/base内毛细胞突触数量统计图。(N=8),*P<0.05,**P< 0.01,***P < 0.001。
3 讨论
本研究利用CBA小鼠,探索在不同噪声强度下建立隐性听力损失模型,最终确定造模噪声条件为频率8~16 kHz,噪声强度91 dB SPL,暴露时间2 h。
在人类疾病研究中,选择合适的动物、建立与人类疾病发病机制相近的动物模型至关重要。目前在听力研究领域,常见的模式动物有豚鼠、沙鼠、大鼠、小鼠。CBA 小鼠因其不会随着年龄的老化产生老年性听力减退,近来在噪声性耳聋中广泛应用,成为研究听力相关领域的理想选择[13-15]。实验室前期实验显示CBA小鼠建模后死亡率低且实验数据稳定,形态学染色特异性好。因此,本实验最终选择CBA小鼠,作为研究隐性听力损失的模式动物。
隐性听力损失表现为适度噪声暴露导致的听力阈值出现暂时性阈移,可在数天或数周内恢复,主要病理学表现是听觉传导通路中内毛细胞-螺旋神经节突触部分丢失,而内外毛细胞、支持细胞、神经纤维等无明显损伤。然而,目前关于隐性听力损失的造模条件尚未形成公认、可靠的标准,不同课题组所用噪声强度等条件均存在一定差异,石林等以110 dB SPL的白噪声暴露2 h建立隐性听力损失模型[5];宋强等[16]以105 dB SPL的单剂量宽带噪声下2小时造模;Kujawa等将小鼠暴露于98 dB的8-16 kHz八度频段噪声2 h建立模型[17]。
本研究初期参考Kujawa和Liberman文献[18]中隐性听力损失模型条件,用CBA小鼠在100 dB,8-16 kHz暴露2 h建立隐性噪音性耳聋模型。多次实验结果显示,14 d时,ABR click及ABR Tone听力阈值无法恢复正常听力阈值,说明该条件对CBA小鼠造成了永久性听力阈移(图1),损伤程度超过了隐性听力损失的诊断标准,考虑造模分贝值过高。因此,我们将造模的噪声分贝值范围扩大为100、98、96、94、93、92、91、90 dB,探索CBA小鼠隐性听力损失合适的造模条件;8个级别共计40组CBA小鼠的ABR听力检测分析结果显示(图1),≥92 dB条件下,造模14 d后,ABR click及ABR Tone听力阈值均无法恢复到正常听力阈值,说明这些条件对CBA小鼠造成了永久性听力阈移,不符合隐性听力损失的判断标准;90 dB条件下,1 d后ABR click及ABR Tone听力阈值与正常组比较无统计学意义,说明该条件未造成暂时性听力阈移,未达到隐性听力损失模型的判断标准。而91 dB 条件下,ABR click听力阈值在1 d有大幅度上升,3、7 d有部分恢复,14 d后恢复正常(图1A,1B),说明小鼠整体听功能水平出现暂时性听力阈移,并在14 d后恢复至正常;但Ⅰ波振幅有显著减小,3、7、14 d均有一定的恢复,但14 d并未恢复至正常(图2A),潜伏期无明显变化(图2B),而I波振幅的减小,与声音激活的突触数量减少呈正相关[19],提示可能存在突触的损伤。ABR Tone听力阈值在1 d有大幅度上升,3、7 d有部分恢复,14 d后恢复正常(除32 kHz外)(图1C,D),说明在8 kHz和16 kHz频率下,出现暂时性听力阈移,并在14 d后恢复至正常;而32 kHz频率出现永久性听力阈移,表明其主要损伤部位为高频区;Ⅰ波振幅1 d 有显著减小,3、7、14 d均有一定的恢复,但14 d并未恢复至正常(图2C),潜伏期无明显变化(图2D),与click结果趋势一致,提示存在突触的损伤。以上数据分析结果表明,91 dB可能是隐性听力损失合适的噪声暴露条件,但需要进一步的组织学结果的支持。
耳蜗基底膜形态学检测显示,1 d时内外毛细胞、支持细胞、神经纤维均未出现丢失,而内毛细胞与螺旋神经节间突触的数量明显下降,且出现单独 CtBp2或 GluA2信号点,说明无效突触增多;尽管3~14 d随着时间的延长,突触数量有一定的恢复,但突触数量并没有恢复至正常水平,出现部分永久性丢失。
综上所述,本研究根据现有文献设置了8个级别5个检测时间点共计40组CBA小鼠在90~100 dB的噪声范围,探索了隐性听力损失合适的噪声暴露条件,最终确定在8~16 kHz,91 dB SPL的噪声损伤2 h条件下,听功能的改变(出现暂时性听力阈移并在14 d后恢复至正常水平),以及形态学检测(出现部分突触永久性丢失),均符合隐性听力损失的判断标准。该条件的确立为隐性听力损失的研究奠定了重要的实验基础,为本课题组开展后续的听力损失相关研究提供了重要的条件保障。
