水产品荧光假单胞菌双组分信号转导系统的序列分析和功能预测
2021-12-03李秋莹徐瑾秀张婧阳励建荣
李秋莹,徐瑾秀,张婧阳,孙 彤,励建荣
(渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013)
荧光假单胞菌(Pseudomonas fluorescens)是化能异养型的革兰氏阴性菌,呈杆状,无菌毛,有数根极端鞭毛,能分泌黄绿色荧光色素发出荧光,广泛存在于土壤、水生环境和高蛋白高脂肪食品中[1]。其在4 ℃仍能生长繁殖,是引起低温条件下水产品腐败变质的一种优势腐败菌[2]。荧光假单胞菌具有较强的水解蛋白质和脂肪的能力,可以产生吲哚、苯酚、腐胺、尸胺、硫化氢等有毒物质,并导致水产品感官不可接受性的黏液、异味[2]。荧光假单胞菌可在水产品生产设备表面形成生物膜,增强了其对水产品加工过程中各种环境压力的耐受性,使其难以抑制[3]。此外,作为一种条件致病菌,荧光假单胞菌能够导致诸如败血症、感染性休克及血管内凝血等危害人体健康[4]。这严重降低了水产品的品质和安全性。因此,控制荧光假单胞菌的生长对延长水产品货架期、提高水产品的安全性具有重要意义。
细菌的双组分信号转导系统(two-component signal transduction system,TCS)能够感应环境变化,应对环境变化引起的负面效应[5],参与调控细菌的趋化性、渗透压、形态分化、营养物质代谢、耐药性等诸多生理过程[6]。通常TCS由组氨酸激酶(histidine kinase,HK)和对应的应答调节蛋白(response regulator,RR)组成[7]。当感受到胞外信号时,HK C端的组氨酸残基(His)发生自磷酸化反应,并将磷酸基团转移到对应RR位于N端的天冬氨酸残基(Asp)上,磷酸化的RR可与靶基因结合并调控其转录表达[8]。鉴于这种能识别和应对多种环境刺激的信号转导机制在细菌生存适应中的重要作用,研究其在水产品荧光假单胞菌的作用机制,可为该腐败菌的靶向控制提供新思路。
随着高通量测序技术的发展,越来越多微生物的基因组序列被公布。为进一步探究荧光假单胞菌对水产品腐败的致腐机理,本实验室前期对分离自冷藏大菱鲆的荧光假单胞菌PF08菌株进行全基因组测序和功能基因注释。然而,TCS蛋白一般包括几个互不相关的功能域,基因组注释常常会因为整个编码区相似度不高而导致注释不准确[9]。目前,关于假单胞菌属TCS的研究多集中在某个基因上,而缺少对于基因组中所有TCS的全面分析。因此,本研究采用生物信息学方法从全基因组范围预测PF08菌株的TCS基因,将预测到的TCS与假单胞菌属其他模式菌进行比较,并对其结构、功能和进化关系进行分析,以期为进一步探究水产品荧光假单胞菌PF08菌株中TCS对环境适应的调控机制及其致腐机制提供参考。
1 材料与方法
1.1 材料与试剂
荧光假单胞菌PF08菌株分离自腐败大菱鲆,是其优势腐败菌,已完成全基因组测序,其序列(CP032618.1)可从美国国立生物技术信息中心网站(National Center for Biotechnology Information,NCBI,https://www.ncbi.nlm.nih.gov/)下载。荧光假单胞菌F113、铜绿假单胞菌PA01和恶臭假单胞菌KT2440的基因组信息来自NCBI,其相应的TCS信息由微生物信号传导数据库MiST(http://mistdb.com/)检索获得[10]。
1.2 方法
1.2.1 TCS的鉴定
参照师舷等[11]的方法,利用TCS中HK和RR蛋白的保守结构域筛选荧光假单胞菌PF08中可能存在的HK和RR。HK的保守结构域HATPase_c(Pfam02518)和RR的保守结构域Response_reg(Pfam00072)下载自Pfam数据库(http://pfam.xfam.org/),并用HMMER软件(下载自http://hmmer.org/download.html)构建该保守结构域的隐马尔科夫模型(hmmbuild),然后在荧光假单胞菌PF08全基因组序列中用上述的隐马尔科夫模型分别搜寻可能的HK和RR(hmmsearch)。通过NCBI的BLASTp程序确认搜到的HK和RR,确认标准如下:1)催化结构域HATPase_c必须位于HK的C末端,且其上游具有二聚化或磷酸化结构域HisKA;2)RR的N-末端具有磷酸受体结构域REC[11]。基因间距小于300 bp的HK和RR为成对TCS;同时拥有HisKA和REC结构域的蛋白为融合HK;单个的HK或RR定义为孤儿HK或RR[12]。
1.2.2 生物信息学分析
蛋白保守结构域的分析利用SMART(Simple Modular Architecture Research Tool,http://smart.embl-heidelberg.de)完成;蛋白跨膜结构域采用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)进行预测;采用Clustal X分别对HK和RR进行多重序列比,并利用MEGA7.0(Molecular Evolutionary Genetics Analysis)建立系统发育树;从京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG,https://www.kegg.jp/)数据库中获取TCS的功能信息,同时参考已研究细菌TCS的功能对荧光假单胞菌PF08中各TCS的功能进行预测。
2 结果与分析
2.1 荧光假单胞菌PF08基因组中TCS的鉴定
利用保守结构域HATPase_c(Pfam02518)和Response_reg(Pfam00072)对荧光假单胞菌PF08菌株全基因组中的TCS进行了搜索。结果表明,荧光假单胞菌PF08共有147 个TCS基因,63 个基因编码HK蛋白(38 个经典HK和25 个融合HK),其中32 个经典HK和7 个融合HK与相应RR组成了39 个成对TCS(表1)。另外84 个基因编码RR蛋白,包括39 个HK-RR对和45 个孤儿RR。其中,AYG05564.1、AYG05979.1、AYG05997.1、AYG06213.1、AYG07392.1、AYG08306.1、AYG09608.1、AYG010767.1等基因所编码的蛋白质只有HATPase_c结构域而缺少HisKA结构域,本研究没有将它们归为TCS基因;AYG06573.1和AYG07073.1仅有HATPase_c结构域和REC结构域而缺少HisKA结构域,因此本研究将其归为RR而非融合HK[11-12]。
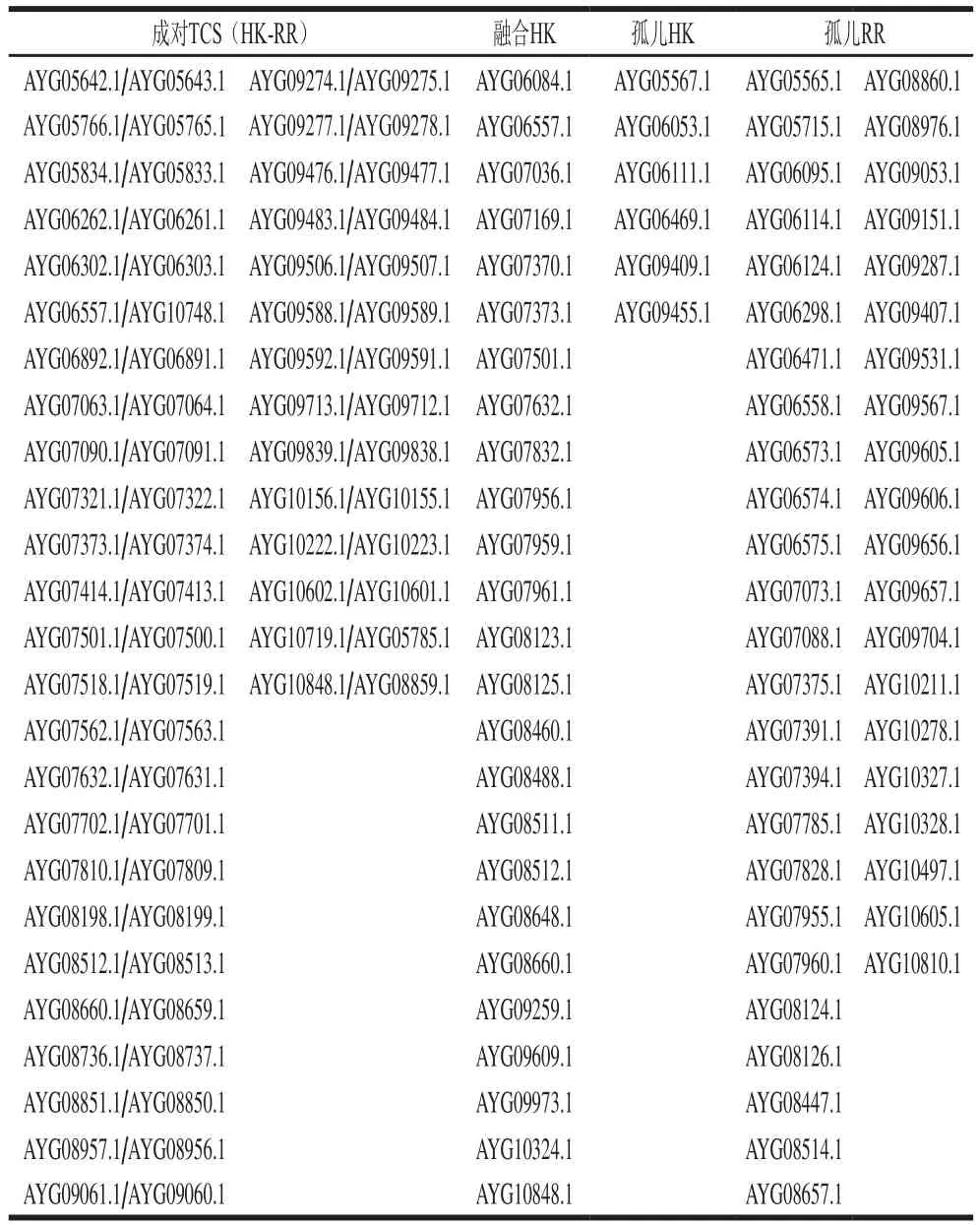
表1 荧光假单胞菌PF08全基因组中TCSTable 1 TCSs in the whole genome of P.fluorescens PF08
MiST数据库检索到假单胞菌属其他菌株TCS信息,并与荧光假单胞菌PF08菌株在基因组大小、TCS基因数量、HK和RR组成情况进行比较分析(表2)。有研究表明TCS总蛋白数目与基因组大小呈正比[13]。荧光假单胞菌PF08菌株的基因组大小、基因组中蛋白数目均小于荧光假单胞菌F113、铜绿假单胞菌PA01和恶臭假单胞菌KT2440,然而其TCS基因数目却更接近于基因组最大的荧光假单胞菌模式菌株F113,分别多于铜绿假单胞菌PA01和恶臭假单胞菌KT2440 27 个和20 个,这可能是因为荧光假单胞菌PF08和F113亲缘关系更近,此外TCS基因数目差异也与菌株的生存环境及进化的不同有关[14]。

表2 荧光假单胞菌PF08菌株与假单胞菌属其他模式菌的基因组信息和TCS基因比较Table 2 Genome information and TCS genes of P.fluorescens PF08 and other members of Pseudomonas genus
2.2 荧光假单胞菌PF08中HK结构域组成及分类
大部分HK是具有多个结构域且能够形成同型二聚体的跨膜蛋白[15]。HK的跨膜区与胞外信号感受有关。TMHMM Server v.2.0对HK蛋白跨膜区的预测结果显示,39 个成对TCS中32 个HK具有至少1 个跨膜区,6 个孤儿HK中有3 个具有跨膜区,25 个融合HK中有13 个具有跨膜区,表明以跨膜区来看成对TCS的HK蛋白是监测胞外环境变化的主要蛋白。根据结构域的不同,荧光假单胞菌PF08菌株中的HK可以分为25 种。38 个经典HK分为10 种(图1a),其中17 个HK蛋白含有HAMP、HATPase_c和HisKA 3 个结构域,9 个HK蛋白仅含有HATPase_c和HisKA 2 个结构域,4 个HK蛋白含PAS、HATPase_c和HisKA 3 个结构域,2 个HK蛋白同时含有HAMP、PAS和HATPase_c和HisKA 4 个结构域,其余6 个HK蛋白含有各异的结构域组合。25 个融合HK分为15 种(图1b)。这表明与经典HK相比,融合HK的数目虽少,但其结构域组成及功能更为复杂。该菌株中所有的HK的C端均具有HK的典型结构域HATPase_c和HisKA(部分HK的HATPase_c和HisKA位于N端),其中AYG07090.1、AYG10324.1中H-kinase_dim结构域是HisKA形成二聚体的区域。HATPase_c结构域是位于胞内的HK的催化结构域,负责将ATP的磷酸基团转移到组氨酸上,HisKA是接受磷酸的受体结构域,它们是磷酸基团传递的重要基础。在HK的N端,除跨膜区外,大部分HK还存在不同结构域,使HK的结构和功能具有多样性[11],如HAMP、PAS、HPT、PBPb、PAC、CHASE2、CheW、GAF。
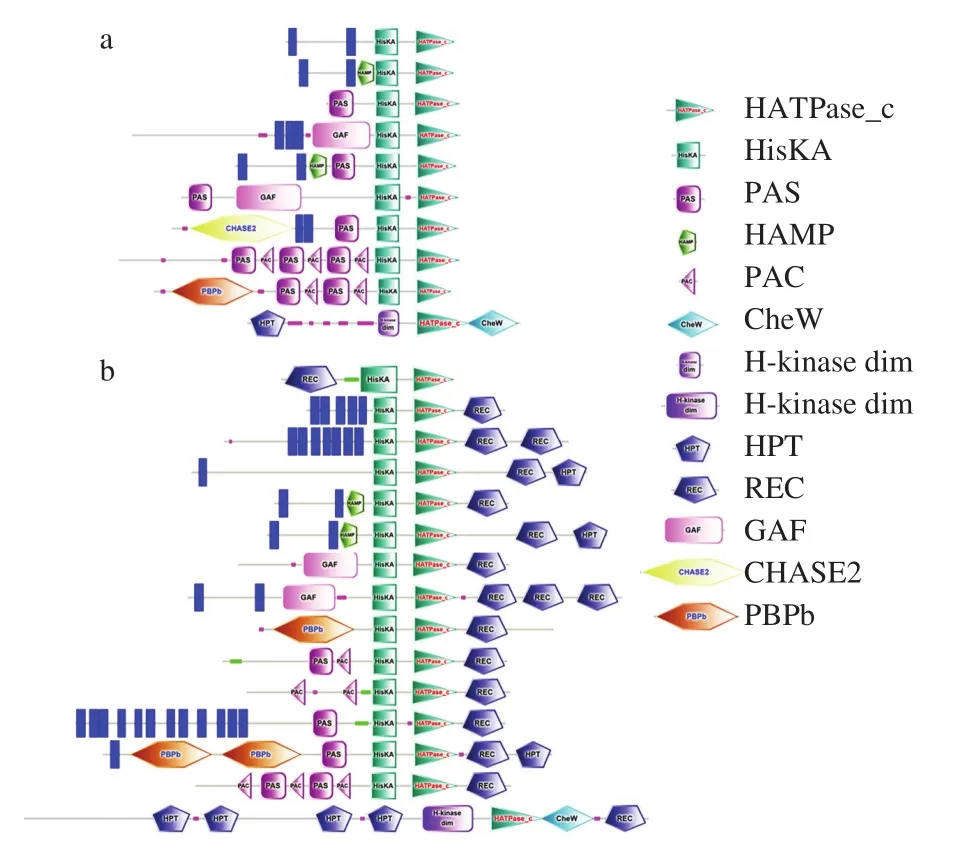
图1 PF08菌株中部分HK的结构域组成Fig.1 Structural domains of part of histidine kinases in P.fluorescens PF08
HAMP结构域是一个约50 个氨基酸的α-螺旋区,存在于HK、腺嘌呤环化酶、甲基接受蛋白和磷酸酶中,主要功能可能是感应与细菌细胞渗透相关的信号。PAS结构域作为一种信号传感器结构域可通过相关辅助因子感应外界氧、氧化还原电位和光的变化,参与调控细菌氧化还原反应;此外,AYG10156.1、AYG06111.1、AYG08460.1、AYG08660.1中除PAS结构域外还含有PAC结构域,PAC结构域常与PAS结构域结合形成保守的三维PAS折叠。HPT结构域主要参与磷酸基团的转移反应。PBPb是细菌周质底物结合蛋白,通常与溶质结合的性质有关。PAC结构域有助于三维PAS折叠形成。CHASE2结构域是一个胞外信号感应区域,存在于细菌信号转导通路上游的各种跨膜受体中,但由其识别的环境因素目前尚不清楚。CheW结构域存在于参与细菌趋化性调控的TCS中,参与调控细菌趋化性。GAF结构域主要对环核苷酸结合发挥作用。除N端的功能结构域外,部分HK的C端也存在结构域,如HPT结构域、CheW结构域及所有融合HK均存在的REC结构域(部分融合HK的REC结构域位于N端),其中融合HK AYG10324.1中CheW结构域和REC结构域相邻,该结构域组成与有些细菌含有的一种双结构域融合蛋白CheV相似[16],因此推测其可能具有相似的功能,都是通过与趋化受体蛋白的相互作用来调节细菌趋化性。
2.3 荧光假单胞菌PF08中RR结构域组成及分类
RR可以通过与下游基因结合调控基因的表达[17]。利用SMART预测荧光假单胞菌PF08菌株中RR的结构域组成,并对其进行功能预测。根据结构域的差异,PF08菌株中的RR蛋白可以分为15 类(图2),其中含有REC和Trans reg_C结构域的RR蛋白最多,共24 个;其次为含REC和HTH LUXR的蛋白,共19 个,只含REC的蛋白16 个,这3 种蛋白占总RR的70%以上。
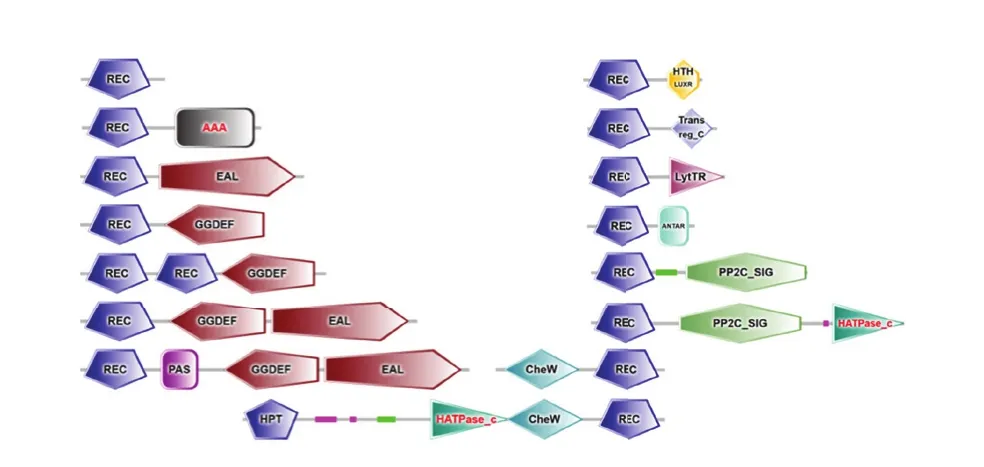
图2 PF08菌株中部分RR的结构域组成Fig.2 Structural domains of part of response regulators in P.fluorescens PF08
位于N端的磷酸受体结构域REC是所有RR蛋白所必需的(AYG07785.1、AYG09151.1、AYG06573.1的磷酸受体结构域位于C端),此结构域中含有一个保守的天冬氨酸残基,可接收由对应HK传递的磷酸基团。此外,RR蛋白的C端一般还具有一个输出结构域(AYG07785.1、AYG09151.1、AYG06573.1的输出结构域位于N端)。PF08菌株的输出结构域主要包括DNA结合输出域(AAA、HTH LUXR、Trans reg_C、LytTR)、RNA结合输出域(ANTAR)、蛋白质结合输出域(CheW)和酶功能域(EAL、GGDEF、PP2C_SIG),不同输出结构域具有不同的生物学功能。如AAA输出结构域参与细胞膜融合、蛋白质水解和DNA复制等多种细胞活动。ANTAR发挥转录抗中止作用。CheW调控细菌趋化性。EAL输出结构域可以刺激第2信使环鸟苷二磷酸的降解,并且是二鸟苷磷酸二酯酶功能的一个很好的候补者,其与GGDEF结构域共存时可能与细菌细胞表面黏附性有关。GGDEF参与信号转导,并可能催化环二鸟苷二磷酸的合成或水解。HTH LUXR可以作为群体感应调控发光的转录激活因子;Trans reg_C可能在DNA结合中发挥作用。PP2C_SIG作为一个模块存在于不同的结构环境中,并通过靶向和调节亚基进行调控。LytTR常存在于GC含量较少的革兰氏阴性菌中,参与细胞的自溶调控。此外,CheY亚家族的RR蛋白无输出结构域,其可能通过其他方式发挥作用。
2.4 荧光假单胞菌PF08的HK和RR蛋白进化分析
利用MEGA 7.0软件采用邻接法对荧光假单胞菌PF08菌株的HK和RR构建系统发生树。从进化关系看,HK共分为3 个聚簇(图3a)。融合HK中除AYG07832.1、AYG07961.1、AYG08460.1、AYG08488.1、AYG09609.1和AYG10324.1外,其余19 个融合HK皆位于同一聚簇;除AYG05642.1外,其余经典HK皆位于其余2 个聚簇。这表明典型HK和融合HK的亲缘关系较远,其行使不同的功能。与HK相比,RR在长度和组成上都相对保守[18]。荧光假单胞菌PF08菌株的RR的系统发生树共分为6 个聚簇,含有REC和Trans reg_C结构域的RR白皆位于同一聚簇;除AYG06114.1外,含REC和HTH LUXR的RR蛋白皆位于相邻的2 个聚簇;其他具有相同结构域的蛋白也多位于同一聚簇(图3b)。基因共同聚簇显示了高度同源性,表明这些位于同一聚簇且结构域相同的蛋白可能具有相近的功能。

图3 HK(a)和RR(b)的蛋白进化分析Fig.3 Phylogenetic analysis of histidine kinases (a) and response regulators (b) in P.fluorescens PF08
2.5 荧光假单胞菌PF08的TCS功能预测
基于KEGG数据库,对荧光假单胞菌PF08菌株的39 对TCS进行的同源性分析,并结合相关文献报道对其功能作出预测。目前,KEGG数据库中TCS可分为OmpR、NarL、Spo、CitB、LytTR、NtrC、CheA、Cell cycle、Lux、LuxR和其他家族11 个亚家族。荧光假单胞菌PF08中25 对TCS分别来自于NtrC(KinB-AlgB、GlnL-GlnG、DctB-DctD)、OmpR(EnvZ-OmpR、CusS-CusR、TctE-TctD、KdpD-KdpE、QseC-QseB、PfeS-PfeR、ParS-ParR、PhoQ-PhoP、RstB-RstA、CreC-CreB、PhoR-PhoB)、CheA(CheA-CheYBV、RstB-RstA)、NarL(EvgS-EvgA)和其他家族(FlrBFlrC、AauS-AauR、RegB-RegA),此外,还有14 对TCS未在KEGG数据库中搜索到相关信息。
由表3可知,荧光假单胞菌PF08中TCS的功能主要包括参与营养元素代谢,如调控海藻酸合成、酸性氨基酸的利用、氮调控、氧化还原反应、磷酸盐调控;参与生物体内物质运输,如柠檬酸转运、C4二羧酸转运、钾镁离子运输;调节细胞形态分化及应对不利环境,如极性鞭毛合成、趋化性、群体感应、渗透压胁迫响应、缺磷响应;与细胞抗性和毒力相关,如铜离子抗性、耐酸和耐药性、多黏菌素抗药性、肠杆菌素依赖性铁获取。其中,由经典HK与相应RR组成的32 对TCS中有23 对的功能作出了预测,而7 对由融合HK组成的TCS只有2 对发现了生物学功能,这可能是因为融合HK同时具有HK的信号传导结构域和RR的信号接收结构域,在感应外界信号、传导及接受信号过程中具有更加灵活的调控功能[38]。荧光假单胞菌之所以能成为冷藏水产品的优势腐败菌,不仅得益于其超强的水解蛋白质和脂肪能力,还来源于其应对逆境时的多种生理机能。预测分析结果表明TCS可以调控荧光假单胞菌PF08的多种生理生化过程。存在参与荧光假单胞菌PF08营养元素代谢和生物体内物质运输的TCS,这对荧光假单胞菌生长繁殖所需的营养物质摄取及能量利用十分重要。此外,部分TCS还可以调控荧光假单胞菌PF08的细胞抗性和毒力及环境适应性,这些调控通路对研究荧光假单胞菌的靶向控制十分重要。当前对荧光假单胞菌腐败机理研究最为广泛的是群体感应,这是细菌之间信息交换的一种机制,依赖菌群密度调节细菌的许多生理功能,影响荧光假单胞菌的腐败能力[39]。而本研究也发现了2 对与群体感应有关的TCS,AYG07414.1/AYG07413.1和AYG08957.1/AYG08956.1。对TCS的功能预测有利于这些与荧光假单胞菌PF08腐败机理有关的基因的进一步的研究,同时为该腐败菌的靶向控制提供新思路。
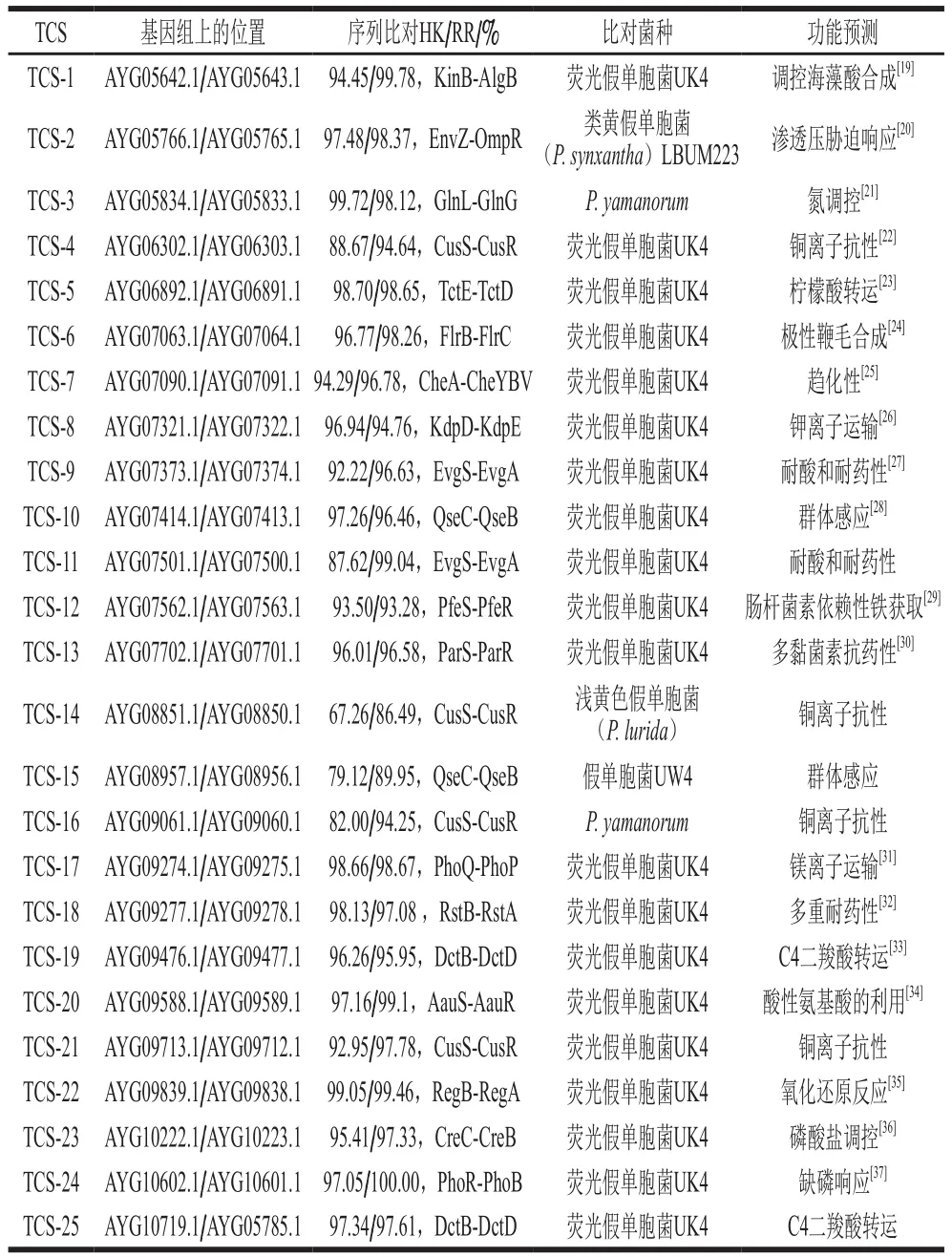
表3 荧光假单胞菌PF08的TCS功能预测Table 3 Functional prediction of TCSs of P.fluorescens PF08
3 结 论
本研究利用生物信息学方法在全基因组范围内系统分析了水产品荧光假单胞菌PF08菌株中TCS的数量、类型及功能。荧光假单胞菌PF08菌株中共存在39 对TCS。虽然系统发育分析表明这些TCS在进化上存在较近的亲缘关系,但它们的结构域组成呈现多样化,是其功能多样化的基础。25 对TCS预测到生物学功能,主要为参与调控营养元素代谢、生物体内物质运输、细胞形态分化、应对不利环境及细胞抗性和毒力等,表明TCS在荧光假单胞菌的生存适应过程中起到至关重要的作用。对于这些TCS在荧光假单胞菌中的调控机制仍需要通过实验进一步验证,特别是尚未获得功能预测的TCS。本研究分析结果为进一步探究荧光假单胞菌生存适应及致腐机制提供了一定的参考,并且TCS可以作为一种有潜力的荧光假单胞菌的新抑制靶点。
