发酵剂对泡萝卜品质的影响
2021-12-03经骐源曾凡坤索化夷王洪伟宋佳佳
经骐源,李 婷,曾凡坤,索化夷,王洪伟,宋佳佳,张 玉,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学 食品科学与工程国家级实验教学示范中心,重庆 400715)
泡菜是中国传统发酵食品,具有悠久的历史文化,其中四川泡菜堪称为中国“国粹”[1]。四川泡菜原料种类多样,泡萝卜是四川泡菜的典型代表[2]。新鲜萝卜经密封发酵后,口感脆嫩,风味独特,不仅可以作为佐餐食用,更是川菜制作过程中必备的调味菜[3]。除此之外,泡萝卜富含乳酸菌,并具有抗癌、抗肥胖、抗氧化、抗衰老和抗糖尿病的特性[4]。从最初的家庭自制,到目前的工业化生产,泡萝卜在中国乃至全世界都非常受欢迎[5]。
泡萝卜在发酵过程中,微生物群落对其品质起至关重要的作用[6]。发酵过程中微生物利用原料组分作为底物代谢产生多种营养和风味物质,最终使产品具有独特的营养价值和风味品质[7]。乳酸菌是发酵过程中起关键作用的微生物种群,其在发酵过程中产生的有机酸和二氧化碳能够抑制腐败菌的生长,从而提高产品的安全性[8]。但乳酸菌的生长代谢受多种因素的影响,如生长环境条件、发酵底物以及与其他微生物之间的相互作用等[9]。因此,工业化的泡萝卜生产,除了控制发酵环境和发酵底物的稳定性之外,发酵剂的选择显得尤为重要。目前国内泡萝卜的生产多采用自然发酵,得到的泡萝卜品质参差不齐,因此,有针对性地开发泡萝卜专用发酵剂对泡萝卜工业化发展至关重要。
本研究选择经过筛选能够发酵得到较好品质的6 种泡萝卜原液,经分析确定其微生物群落组成后,将其作为发酵剂接种发酵新的泡萝卜,对比分析泡萝卜发酵过程中的基本理化指标、质构特性,测定亚硝酸盐、氨基酸、有机酸的含量,探索发酵过程中泡萝卜品质的变化规律,以期获得高品质泡萝卜生产的专用发酵剂类型。
1 材料与方法
1.1 材料与试剂
新鲜的白萝卜、食盐购于重庆永辉超市;6 种不同微生物群落组成的泡菜原液来自重庆地区家庭制作(分别标记为发酵剂1、2、3、4、5和6)。
发酵剂1主要由布氏乳杆菌(66.26%(相对丰度,下同))、毛榛毕赤酵母(99.93%)和未分类的乳杆菌(12.58%)组成,菌落总数为1.04×106CFU/mL,pH 3.98,盐度为5.5%。
发酵剂2主要由布氏乳杆菌(68.65%)、植物乳杆菌(28.64%)和毛榛毕赤酵母(99.99%)组成,菌落总数为7.35×106CFU/mL,pH 5.07,盐度为3.0%。
发酵剂3主要由植物乳杆菌(30.79%)、布氏乳杆菌(14.81%)、未分类的乳杆菌(20.90%)和毛榛毕赤酵母(100.00%)组成,菌落总数为1.55×107CFU/mL,pH 3.99,盐度为5.0%。
发酵剂4主要由植物乳杆菌(56.50%)、布氏乳杆菌(26.40%)、毛榛毕赤酵母(99.84%)和耐乙醇片球菌(15.65%)组成,菌落总数为5.45×106CFU/mL,pH 3.95,盐度为3.0%。
发酵剂5主要由植物乳杆菌(43.63%)、布氏乳杆菌(39.87%)、耐酸乳杆菌(12.34%)和Issatchenkla orientalis(85.52%)组成,菌落总数为9.92×106CFU/mL,pH 2.54,盐度为6.5%。
发酵剂6主要由植物乳杆菌(61.57%)、食窦魏斯氏菌(14.18%)、副银念珠菌(10.14%)和其他(21.45%)组成,菌落总数为2.91×107CFU/mL,pH 2.55,盐度为3.0%。
氢氧化钠、亚硝酸钠、亚铁氰化钾、乙酸锌、盐酸萘乙二胺、乙酸钠、四硼酸钠、对氨基苯磺酸、磷酸二氢钾(均为分析纯) 成都科龙化工试剂厂;苯异硫氰酸酯(phenyl isothiocyanate,PITC)、酚酞、三乙胺、正己烷、醋酸、磷酸(均为分析纯),甲醇、乙腈(均为色谱纯) 重庆钛新化工有限公司。
1.2 仪器与设备
LC20A型高效液相色谱仪 日本岛津公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司;CT3物性测定仪 美国Brookfield公司;5810台式高速离心机 德国Eppendorf公司;PB-10精密pH计德国Sartorius公司;HH-4恒温水浴锅 常州澳华仪器有限公司;C21-SN216多功能电磁炉 广东美的生活电器制造有限公司。
1.3 方法
1.3.1 泡菜的制备
将新鲜白萝卜清洗沥干后切成长宽25 mm、厚10 mm的块状,与等质量6%食盐的凉开水溶液混合装坛后,分别接种6 种泡菜原液(菌落数108CFU/mL,接种量见表1),在25 ℃恒温条件下密封发酵,每天取样测定各项指标,连续测定7 d。

表1 发酵剂接种量Table 1 Inoculum amounts of starters
1.3.2 pH值的测定
取25 g泡萝卜与等量水混合匀浆,用pH计测定pH值[10]。
1.3.3 总酸的测定
取25 g泡萝卜样品,加入煮沸过的蒸馏水,捣碎后置于密闭玻璃容器中,转移至250 mL容量瓶中,沸水水浴加热30 min,中途摇动3 次,冷却,定容后取25 mL滤液,用标准碱液进行滴定[11]。
1.3.4 质构特性测定
取长宽25 mm、厚10 mm泡萝卜样品置于质构仪下进行质构测定。质构测定参数:探头AT44,测试速率1 mm/s,压缩量50%,压缩力7 g[12]。
1.3.5 亚硝酸盐含量测定
参考GB 5009.33—2016《食品中亚硝酸盐与硝酸盐的测定》。
1.3.6 游离氨基酸含量的测定
参照文献[13]方法。
氨基酸提取:取10 g泡萝卜于80 ℃烘干后,置于研钵中研磨溶于25 mL去离子水,超声处理30 min后离心取上清液待衍生化处理。
衍生:取上清液500 μL,分别加入衍生剂A(精密量取PITC 2 mL,用乙腈定容至10 mL)125 μL和衍生剂B(精密量取三乙胺2 mL,用乙腈定容至10 mL)500 μL,室温暗处孵育1 h,加1 mL正己烷萃取2 次,每次10 min,吸取下层溶液与20 μL醋酸溶液混合,过0.22 μm滤膜。
色谱条件:C18氨基酸专用分析柱(250 mm×4.6 mm,5 μm),流动相A为乙腈-水(4∶1,V/V),流动相B为0.1 mol/L乙酸钠溶液(乙酸调pH 6.5)-乙腈(97∶3,V/V),流速1 mL/min,检测波长254 nm,柱温36 ℃,进样量20 μL,梯度洗脱:0~11 min,0%~1.5% A,100%~98.5% B;11~21.7 min,1.5%~7.6% A,98.5%~92.4% B;21.7~23.9 min,7.6%~11% A,92.4%~89% B;23.9~39 min,11%~30% A,89%~70% B;39~42 min,30%~70% A,70%~30% B;42~45 min,70%~100% A,30%~0% B;45~52 min,100% A,0% B;52~55 min,100%~0% A,0%~100% B;55~70 min,0% A,100% B。
1.3.7 有机酸含量测定
参照文献[14]方法。
有机酸提取:取一定质量泡萝卜样品,加等质量去离子水混合,制备成匀浆,称取5 g匀浆于离心管中,4 000 r/min离心15 min,准确吸取上清液15 mL加入10 mL超纯水,于75 ℃超声处理20 min,再以12 000 r/min离心15 min,上清液经0.22 μm滤膜过滤至2 mL进样瓶中待色谱测定。
色谱条件:C18色谱柱(250 mm×4.6 mm,5 μm),紫外检测器,流动相A为0.01 mol/L磷酸二氢钾-水(3∶97,V/V)(pH 2.8),流动相B为甲醇,波长为210 nm。
1.4 数据统计分析
实验数据采用SPSS Statistics 25软件进行统计分析,结果以±s表示;采用Origin 2018软件进行作图。质构测定重复6 次,其他指标分析均重复3 次。
2 结果与分析
2.1 不同发酵剂对泡萝卜pH值与总酸含量的影响
pH值和总酸含量是泡萝卜发酵过程中重要的理化指标,与泡萝卜品质和微生物生长情况密切相关[15]。由图1可知,在发酵过程中,所有接种发酵剂萝卜在发酵前期pH值显著下降(P<0.05),总酸含量显著上升(P<0.05),这与发酵剂中乳酸菌丰富、在发酵初期迅速成为优势菌群而不受其他杂菌影响、产生大量酸有关[16]。所有泡萝卜样品在接种4~7 d pH值趋于稳定,这是由于产酸的增加,使乳酸菌的代谢活动受到一定的抑制作用[17]。接种发酵剂1、5、6泡萝卜在接种6~7 d总酸含量下降,发酵剂1接种泡萝卜总酸质量分数降低至(0.43±0.18)%,这是由于高盐度的发酵剂的作用会使萝卜组织细胞因渗透作用而脱水,萝卜中所含有的一些可溶性酸就会随着水分进入到泡萝卜水中,导致泡萝卜的总酸含量降低[18]。当泡萝卜pH<4、总酸质量分数>0.3%时可认为发酵成熟[19]。由此可见,接种发酵剂1的泡萝卜在接种3 d成熟,接种发酵剂2、4、5、6泡萝卜在4 d成熟,接种发酵剂3泡萝卜在5 d成熟。综上,6 种发酵剂接种的泡萝卜pH值和总酸含量的变化趋势相同,且这6 种发酵剂在发酵7 d时对泡萝卜的总酸含量的影响差异不显著(P>0.05)。
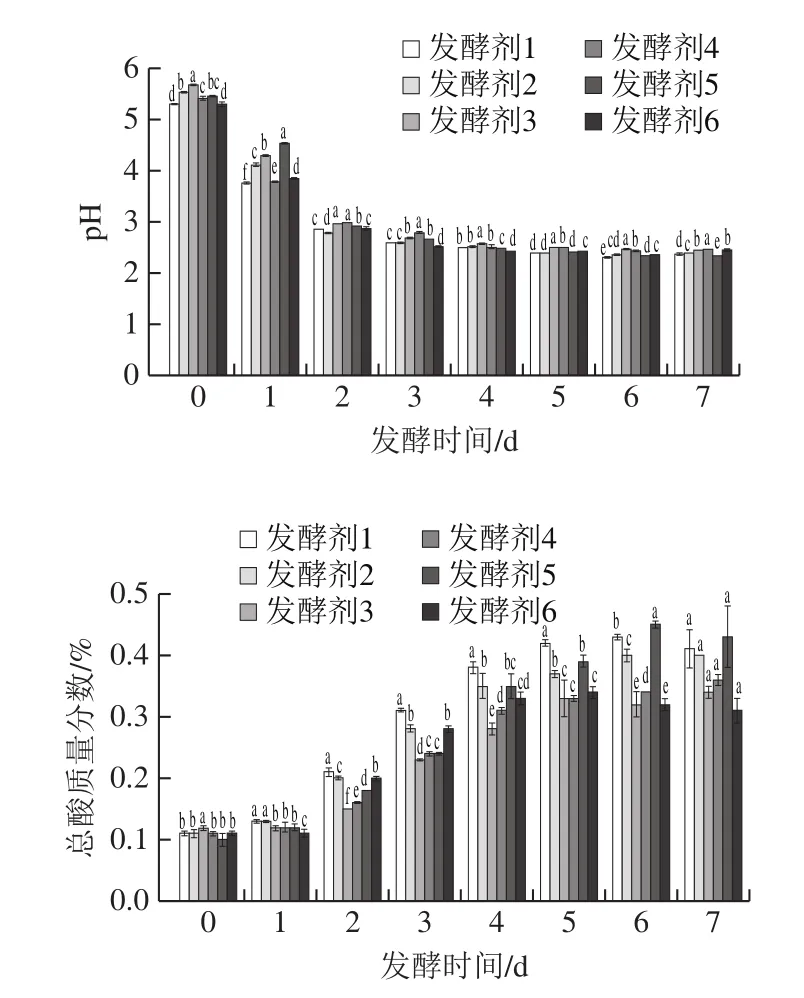
图1 发酵过程中pH值和总酸含量的变化Fig.1 Changes in pH and total acid content during fermentation
2.2 不同发酵剂对泡萝卜质构的影响
质构是评价泡萝卜品质的重要指标之一[20]。本研究从硬度和咀嚼性2 个指标反映泡萝卜在不同发酵剂下发酵过程中质构的变化。泡萝卜硬度主要与细胞壁原果胶成分有关,原果胶不溶于水且有黏着性,能黏连细胞并使萝卜组织保持硬脆[21]。由图2A可知,在发酵0 d,不同发酵剂接种泡萝卜硬度差异不显著(P>0.05),发酵剂2接种泡萝卜硬度(1 085.33±16)g略低于其他实验组(P>0.05)。发酵5 d,各实验组萝卜硬度下降,其中发酵剂5接种泡萝卜硬度下降率为42.05%,其他组下降率在30%左右。发酵7 d,6 种发酵剂接种萝卜硬度差异不显著(P>0.05),其中发酵剂3接种泡萝卜硬度(1 022.67±226)g略高于其他组(P>0.05)。
咀嚼性可以描述食品在口腔中被吞咽所需时间或咀嚼的次数,与硬度、弹性、凝聚性有关,反映了在咀嚼食物时牙齿对外力的抵抗作用[22]。由图2B可知,发酵剂1、2、3、4、5接种泡萝卜咀嚼性先增加后下降最后趋于稳定,发酵剂6接种泡萝卜咀嚼性先迅速下降后趋于稳定。张慧敏等[23]将0.1%直投式发酵剂(主要菌种为植物乳杆菌550)与纯乳酸混合发酵萝卜,发现泡萝卜咀嚼性有类似的变化趋势。不同实验组在发酵7 d后咀嚼性不显著(P>0.05),但发酵剂6对泡萝卜咀嚼性影响最大。
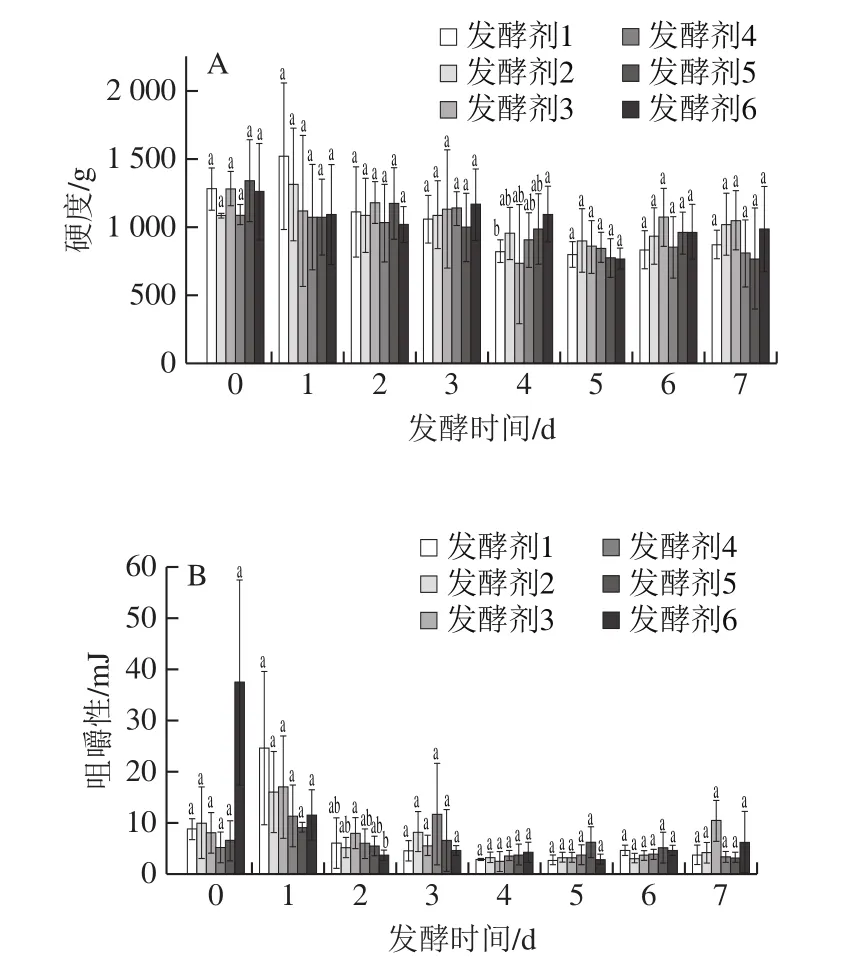
图2 发酵过程中硬度(A)和咀嚼性(B)变化Fig.2 Changes in hardness (A) and chewiness (B) during fermentation
2.3 不同发酵剂对泡萝卜亚硝酸盐含量的影响
饮食中约80%的硝酸盐来自蔬菜消费[24]。由图3可知,所有发酵剂接种泡萝卜亚硝酸盐含量基本呈先上升后下降再上升的趋势(0、4 d和5 d未检测到)。在发酵7 d,发酵剂5和6接种泡萝卜显著低于其他实验组亚硝酸含量(P<0.05),其中发酵剂5接种泡萝卜亚硝酸盐含量最低,为(1.28±0.2) mg/kg。Xiang Wenliang等[25]的研究表明食窦魏斯氏菌WC018和植物乳杆菌LP067共同接种发酵在抑制泡菜亚硝酸盐的形成方面具有协同作用,这可能是发酵剂6接种泡萝卜亚硝酸盐含量较其他组低的原因。所有实验组泡萝卜在发酵过程中的亚硝酸盐含量都处于较低水平,其中最高的是发酵剂3接种的泡萝卜,在发酵第6天时,亚硝酸盐含量为(4.69±0.2)mg/kg。因此,所有实验组所用发酵剂都能使泡萝卜亚硝酸盐含量在国标限量范围内(20 mg/kg)。
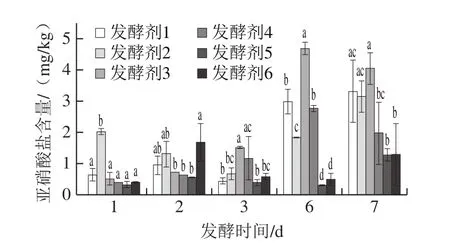
图3 发酵过程中亚硝酸盐含量的变化Fig.3 Changes in nitrite content during fermentation
2.4 不同发酵剂对泡萝卜氨基酸含量的影响
共检测了17 种氨基酸,其中包含5 种甜味氨基酸(苏氨酸、丝氨酸、丙氨酸、甘氨酸和脯氨酸)、3 种鲜味氨基酸(天冬氨酸、谷氨酰胺和谷氨酸)、9 种苦味氨基酸(蛋氨酸、异亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、组氨酸、精氨酸、赖氨酸和缬氨酸)的含量[26]。如表2所示,所有实验组泡萝卜甜味氨基酸的总含量在发酵前期波动较大,发酵后期稳定,其中丙氨酸占比最大。接种发酵剂2的泡萝卜在发酵7 d总甜味氨基酸含量显著高于其他组(P<0.05),其中苏氨酸含量最高为(0.09±0.03)mg/g。发酵过程中,所有实验组天冬氨酸在鲜味氨基酸中占比较低,微生物对天冬氨酸的利用率较高[27]。所有样品泡萝卜中苦味氨基酸总含量在发酵4 d达到峰值,在随后的发酵过程中逐渐下降。其中苯丙氨酸和酪氨酸都含有苯环,在酶的催化下形成酚类化合物,是重要的风味前体物质[28-29]。在发酵第7天时,各实验组氨基酸总含量差异显著(P<0.05),发酵剂6接种泡萝卜甜味、鲜味、苦味氨基酸含量均偏低,发酵剂2接种泡萝卜甜味和鲜味氨基酸显著高于其他组(P<0.05),其中谷氨酸含量最高,为(0.18±0.01)mg/g。

表2 发酵过程泡萝卜中游离氨基酸的含量Table 2 Contents of free amino acids in pickled radish during fermentation
2.5 不同发酵剂对有机酸含量的影响
有机酸是泡萝卜风味和滋味的重要因素[30]。在泡萝卜发酵过程中,有机酸的产生和消耗以及种类由微生物群落的组成和生长环境所决定[31]。本研究主要分析了8 种有机酸,包括草酸、苹果酸、酒石酸、抗坏血酸、乳酸、乙酸、琥珀酸、柠檬酸(表3)。

表3 发酵过程泡萝卜有机酸含量Table 3 Contents of organic acids in pickled radish during fermentation
新鲜萝卜中草酸含量较高,发酵剂4接种泡萝卜在0 d草酸含量高达(11.74±3.62)mg/g。随着发酵时间的延长,所有泡萝卜的草酸含量均有下降。发酵7 d,各实验组草酸含量差异不显著(P>0.05),含量最高是发酵剂3接种泡萝卜,为(3.64±0.39)mg/g。在发酵过程中,泡萝卜酒石酸含量均呈先下降后稳定的趋势,发酵剂3接种泡萝卜发酵7 d后,酒石酸含量最高为(0.10±0.07)mg/g。泡萝卜抗坏血酸变化趋势与酒石酸类似,终含量最高的是接种发酵剂1的泡萝卜,达(0.24±0.02)mg/g。琥珀酸在所有发酵剂发酵过程中的含量始终处于低水平,呈下降趋势。琥珀酸作为三羧酸循环的中间产物,参与微生物的代谢过程,除此之外,还会与亚硝酸盐进行反应,生成微溶性盐等,都会导致其含量的降低[32]。
苹果酸、乳酸、乙酸和柠檬酸是泡萝卜发酵过程含量上升的有机酸,也是发酵过程中主要生产有机酸。乳酸是泡萝卜中的主要有机酸,它的产生和积累主要取决于糖的代谢和接种物的底物供应[33],在本研究中,乳酸主要是由植物乳杆菌产生。所有实验组中乳酸含量呈先增加后稳定趋势。发酵7 d时,各实验组之间差异不显著(P>0.05),其中接种发酵剂2泡萝卜所含有的乳酸含量较其他组略高,为(0.19±0.13)mg/g。在发酵过程中,各实验组之间乙酸含量差异显著(P<0.05),尤其是在发酵后期。发酵7 d时,发酵剂1、2、3接种泡萝卜乙酸含量分别为(2.39±1.25)、(2.1±0.59)、(2.27±0.33)mg/g,而发酵剂4、5、6接种泡萝卜乙酸含量在1.4 mg/g左右。根据Ozcelik等[34]的报道,在泡菜发酵过程中,乙酸只由肠系膜乳酸菌产生,植物乳杆菌不产生,而在本研究中,植物乳杆菌和布氏乳杆菌或食窦魏斯氏菌组成的体系均可以产生乙酸,且乙酸浓度显著高于乳酸(P<0.05)。
发酵过程中柠檬酸变化趋势均为先增加后降低,发酵剂2接种7 d后柠檬酸含量最高达(1.11±0.03)mg/g。柠檬酸盐和葡萄糖果糖、乳糖或木糖在多种乳酸菌的作用下通过醋酸盐激酶途径代谢,导致柠檬酸含量逐渐降低[35]。所有实验泡萝卜中苹果酸含量在后期较高,其中发酵剂1接种泡萝卜在第5天苹果酸含量达到(3.93±0.11)mg/g。发酵7 d,发酵剂2接种泡萝卜苹果酸含量最高,为(1.31±0.31)mg/g。总之,发酵7 d,发酵剂2接种泡萝卜有机酸含量显著高于其他实验组(P<0.05),且乳酸、乙酸等关键风味物质广泛存在,能给予泡萝卜良好的风味品质[12]。
3 结论与讨论
在泡萝卜发酵过程中,通过接种发酵剂,可以使乳酸菌迅速成为优势菌种,加速泡萝卜成熟。6 种发酵剂对泡萝卜的基本理化指标、质构特性影响差异不显著(P>0.05),均能使泡萝卜亚硝酸盐含量在国家限量标准内,但由布氏乳杆菌(68.65%)、植物乳杆菌(28.64%)和毛榛毕赤酵母(99.99%)组成发酵剂2能使泡萝卜氨基酸和有机酸含量显著高于其他组(P<0.05),赋予泡萝卜良好的风味和营养价值。在本研究中接种的发酵剂被称为“老卤水”,是在泡菜坛内长期厌氧发酵形成的乳酸菌为主体的复合菌群[36]。发酵剂2中所含的植物乳杆菌、布氏乳杆菌是泡萝卜发酵过程中的优势菌群,对各种风味和营养物质的产生具有重要的作用。毛榛毕赤酵母是发酵剂2中的主要真菌,常存在自然发酵食品中(例如葡萄酒、黄瓜、食用橄榄等)[37]。因此,通过对发酵剂2的进一步研究有望得到发高品质泡萝卜专用发酵剂的发酵机制。
