营养胁迫植物乳杆菌KLDS 1.0328的生理特性及其冷冻干燥菌粉贮存稳定性分析
2021-12-03马佳歌姜瞻梅侯俊财
马佳歌,姜瞻梅,姜 瑞,侯俊财,于 微
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
益生菌被定义为“施予一定数量能够对宿主健康产生有益作用的活的微生物”[1]。益生菌已被证实存在多种益生性能,包括抑制致病菌生长、降胆固醇、调节机体免疫、改善胃肠道菌群、促进营养物质的吸收及抗氧化等[2]。植物乳杆菌(Lactobacillus plantarum)是一种被认为安全的一类革兰氏阳性乳酸菌,也是发酵食品和人类健康的重要“参与者”,其作为重要的发酵剂一直被广泛用于发酵乳、肉和植物食品,如酸奶、奶酪、香肠、酱油、谷物饮料、泡菜等[3]。然而,益生菌在其生存环境中常面临非生物性和生物性胁迫,其中,非生物胁迫主要发生在生产、加工、运输及贮存等过程中,如酸、碱、温度、渗透压、氧和乙醇等胁迫;生物胁迫则发生在宿主和复杂的生态系统中,如胃酸、酶和胆盐等胁迫[4]。为增强益生菌对不利环境的抵抗性和贮藏稳定性,常采用微胶囊包埋技术提高菌体的活力。其中,冷冻干燥技术是目前被广泛应用的保护益生菌活性最为有效的方式之一。尽管与其他技术相比其成本较高,但冷冻干燥技术能够提高菌体应对胁迫环境的抵抗力,并且兼具易于贮存和应用的优点[5]。冻干过程可能会引起菌体一定程度上的损伤,这些因素会严重影响益生菌的数量、活力和代谢稳定性,继而影响发酵食品的品质及其益生功效的发挥。
随着益生菌与肠道微生态健康关系的研究日益深入,人们也逐渐认识到益生菌所需营养物质也具有菌株特异性,许多益生菌对其生存环境的营养物质和生长条件均具有特殊的要求[6]。因此,益生菌生态位中由于营养物质缺乏带来的营养胁迫作为一种特定的限制性因素也受到了学者们的重视[7]。众所周知,葡萄糖是益生菌碳源和能源的最常见来源[8]。在葡萄糖耗尽的情况下,菌体遭受葡萄糖营养饥饿胁迫,益生菌则开始分解氨基酸作为替代性的碳/能源并产生芳香化合物;一个典型的例子是一些乳品相关的乳酸菌可能会将支链氨基酸转化为挥发性的支链脂肪酸以合成ATP[9]。聚氧乙烯脱水山梨醇单油酸酯,商品名称吐温80(Tween 80),其作为一种非离子表面活性剂和乳化剂,被广泛地应用于食品、药品和化妆品等领域[10]。由于Tween 80的结构中包含亲油基团——油酸基团,因而也被广泛用作微生物生长培养基中的添加剂,为细菌(如乳酸菌属)提供外源的油酸[11]。此外,Tween 80可通过影响菌体的细胞膜特性,保护菌体并减少不利环境带来的影响[12]。
目前关于环境胁迫对乳酸菌影响的科学研究多集中在单一胁迫的条件下,然而在实际应用中,多种胁迫往往同时发生,且不同胁迫之间可能具有复杂的交叉关联性[13]。由一种胁迫应激所诱导的对另一种环境胁迫的保护作用被称为交叉保护。研究发现,马乳酒样乳杆菌的热、冷、酸和胆盐的胁迫预适应诱导了同源胁迫的耐受性和异源胁迫的交叉保护,蛋白质组学显示在胁迫预适应处理的菌体中发生了27 个蛋白的差异性表达,其中包含参与碳水化合物代谢、平衡pH值、翻译相关和胁迫应激蛋白,这些应激蛋白表达水平的上调可能在菌体抵御之后的胁迫方面发挥关键的作用[14]。近年来,众多研究学者利用交叉保护作用成功改善了食品微生物在冷冻干燥及其贮藏过程中的存活率。甄妮等[15]报道了热休克处理诱发的交叉保护能够使嗜酸乳杆菌在冻干过程的存活率显著增加,并且增强了菌体在不同贮存温度下的抵御能力。Gasaluck等[16]采用冷和渗透交叉保护作为控制性措施,提高贮存期间冻干菌体的稳定性和延长保质期。
由于食品工业中的环境胁迫会导致乳酸菌细胞存活率大幅下降,因此,提高乳酸菌存活率和稳定性的方法和策略越来越受到食品工业的关注。分析乳酸菌在营养胁迫下的应激反应能够更为有效地对其生长及发酵条件进行针对性设计和开发,具有十分重要的意义。然而,通过营养胁迫处理提高冷冻干燥乳酸菌在贮存过程中活力的效果目前研究较少。基于上述原因,本研究采用前期筛选出的具有益生特性的L.plantarumKLDS 1.0328为研究对象,测定葡萄糖胁迫、Tween 80胁迫以及葡萄糖和Tween 80复合胁迫对其活力、产酸、细菌素抑菌活性及形态的影响。并在此基础上,分析经不同营养胁迫处理后冷冻干燥的L.plantarumKLDS 1.0328活力差异,以期为提高益生菌发酵剂贮存稳定性提供参考。
1 材料与方法
1.1 材料与试剂
L.plantarumKLDS 1.0328为东北农业大学乳品科学教育部重点实验室分离筛选自东北传统发酵泡菜并保藏;金黄色葡萄球菌(Staphylococcus aureusATCC 25923)和大肠杆菌(Escherichia coliATCC 25922)美国典型培养物保藏中心;MRS培养基、MRS琼脂培养基 北京奥博星生物技术有限责任公司;脱脂乳粉黑龙江完达山乳业股份有限公司;海藻糖 阿拉丁试剂(上海)有限公司;其余试剂均采用国产分析纯。
1.2 仪器与设备
VD-1320超净工作台 苏州安泰空气技术有限公司;DH4000A电热恒温培养箱 天津泰斯特仪器有限公司;ULT1386-3-V30超低温冰箱 日本Sanyo公司;Allegra X-30R台式高速冷冻离心机 美国Beckman Coulter公司;PHS-3C精密pH计 上海雷磁仪器厂;UV-2600型紫外-可见分光光度计 日本Shimadzu公司;ES-2030真空冷冻干燥仪、SU8010扫描电镜 日本Hitachi公司;6590N-5973N气相色谱仪 美国Agilent公司;HC103/02水分测定仪 瑞士Mettler Toledo公司;LabMaster-aw水分活度仪 瑞士Novasina公司。
1.3 方法
1.3.1 菌种的活化
将保存在-80 ℃及40%(V/V)甘油冻存管中的L.plantarumKLDS 1.0328以2%(V/V,下同)的接种量(约107CFU/mL)接种于已灭菌的MRS液体培养基中,并于37 ℃恒温条件下培养24 h,连续活化2 代以恢复菌种活力。将该菌种接入至MRS固体平板培养基中于37 ℃培养24 h,接种环挑取单菌落移入MRS液体培养基中进行分离纯化,37 ℃培养18 h作为供试菌液备用。
1.3.2 营养胁迫
采用4 种不同的生长培养基(基础MRS、葡萄糖胁迫、Tween 80胁迫、葡萄糖和Tween 80胁迫液体培养基),以探究多种营养胁迫对L.plantarumKLDS 1.0328生理参数,如菌体生长、产酸能力、细菌素生产和菌体形态等的影响。培养基配方如表1所示。将上述培养基的pH值调整至6.2±0.1,于121 ℃高压灭菌15 min。将L.plantarumKLDS 1.0328菌悬液以2%接种量(约107CFU/mL)接种在上述4 种营养胁迫培养基中37 ℃培养24 h,菌液于4 ℃、5 000×g离心10 min,弃上清液,采用0.85 g/100 mL生理盐水洗涤菌泥3 次。

表1 L.plantarumKLDS 1.0328营养胁迫培养基配方Table 1 Nutrient-stress medium formulations of L.plantarum KLDS 1.0328
1.3.3 pH值和菌体生长情况的测定
使用PHS-3C精密pH计测定培养液的pH值;UV-2600型紫外-可见分光光度计用于测定菌液在600 nm波长处的OD值;通过梯度稀释及平板菌落计数法测定活菌数[17]。
1.3.4 抑菌活性的测定
以S.aureusATCC 25923和E.coliATCC 25922为指示菌,根据牛津杯琼脂扩散法[18]稍作改动,每隔3 h对多种营养胁迫L.plantarumKLDS 1.0328的抑菌活性进行测定。以抑菌圈的直径(mm)表示L.plantarumKLDS 1.0328的抑菌活性强弱。
1.3.5 扫描电镜观察营养胁迫菌体
将1.3.2节中所获得的营养胁迫菌体与戊二醛(2.5%,pH 6.8)混合并于4 ℃固定12 h。用0.1 mol/L的磷酸缓冲液(pH 6.8)冲洗3 次(每次10 min)。分别使用体积分数50%、70%和90%的乙醇溶液脱水15 min,再用无水乙醇脱水2 次(每次10 min)。采用无水乙醇∶叔丁醇=1∶1(V/V)和100%叔丁醇分别置换15 min。样品于-20 ℃预冻12 h后进行冷冻干燥。将干燥的菌体粘贴在导电胶带上并镀金,喷金时间120 s,电流强度20 mA,采用扫描电镜观察营养胁迫菌体的形态。从扫描电镜图像中随机选取30 个菌体,通过ImageJ软件测量每个菌体的长度(l)和直径(d),每次测量重复3 次。参照Parlindungan等[19]的方法定义了乳杆菌杆的半径(r=d/2)和高度(h=l-2r),并得到平均菌体体积计算如式(1)所示:

式中:V为平均菌体体积/μm3;r为乳酸菌杆的半径/μm;h为杆的高度/μm。
1.3.6 细胞膜脂肪酸的测定
细胞膜脂肪酸样品制备参照Gandhi等[20]的方法进行。利用配有HP-5弹性石英毛细管柱(30 m×0.25 mm,0.25 μm)的气相色谱仪对L.plantarumKLDS 1.0328菌体的细胞膜脂肪酸进行分离鉴定,进样口温度250 ℃,高纯氦气作为载气,柱流速1 mL/min,柱前压73.0 kPa,起始温度70 ℃运行2 min,5 ℃/min升至230 ℃,保持20 min,5 ℃/min升至280 ℃,保持15 min,分流进样1 μL,分流比20∶1。质谱分析:电子电离源,电子能量70 eV,离子源温度200 ℃,接口温度250 ℃。脂肪酸含量表示为相对物质的量百分比(%)。
1.3.7 冷冻干燥
将10 g脱脂乳粉和5 g海藻糖分散在85 mL已灭菌的去离子水中,于室温下600 r/min磁力搅拌30 min以充分溶解,并于121 ℃灭菌15 min。将1.3.2节中所获得的营养胁迫菌体与上述冻干保护剂混合均匀。将分散在保护剂中的菌悬液置于-20 ℃冰箱内预冻12 h。将预冻好的菌液冷冻干燥处理12 h,将冻干菌粉取出后备用。称取1.5 g左右L.plantarumKLDS 1.0328冻干菌粉,将其疏松分散在水分测定仪托盘中央干燥以便水分迅速蒸发,直到样品小于1 mg的质量变化达到90 s,利用干燥过程中样品质量变化计算水分含量。冻干菌粉的水分活度于室温下使用水分活度仪进行测定。
1.3.8 冷冻干燥存活率的测定
将各胁迫处理的L.plantarumKLDS 1.0328冻干菌粉样品于0.85 g/100 mL生理盐水中复水,而后进行梯度稀释并采用平板菌落计数法测定活菌数。冷冻干燥后细胞存活率的计算如式(2)所示:

式中:S1冻干后的细胞存活率/%;N为冻干后的活菌数/(CFU/g);N0为冻干前的活菌数/(CFU/g)。
1.3.9 营养胁迫冻干菌粉在贮存期存活率的测定
将经营养胁迫处理的L.plantarumKLDS 1.0328按1.3.6节方法进行冷冻干燥。将获得的冻干菌粉置于Eppendorf管中并用封口膜密封,将菌粉样品分别于-18、4、25 ℃和37 ℃贮存42 d。每隔7 d检测其在贮存期间的细胞存活率,其计算如式(3)所示:

式中:S2为贮存期间的细胞存活率/%;NA为冻干后贮存第n周(1~6 周)的活菌数/(CFU/g);NB为冻干后贮存第0周的活菌数/(CFU/g)。
1.4 数据处理
2 结果与分析
2.1 营养胁迫对L.plantarum KLDS 1.0328产酸和生长的影响
如图1所示,由葡萄糖、Tween 80或两种营养缺失带来的胁迫环境对L.plantarumKLDS 1.0328的产酸性能和活力均有不同程度的影响。在培养24 h时,未经胁迫对照组菌液pH值为3.78±0.20,Tween 80胁迫组菌体的产酸能力与对照组相比未产生显著差异,而葡萄糖胁迫及葡萄糖和Tween 80复合胁迫组菌体培养液的pH值至仍保持在6.14±0.20和6.06±0.28。这些结果与文献中报道的葡萄糖是乳酸菌(如嗜酸乳杆菌、保加利亚乳杆菌、干酪乳杆菌、乳酸乳球菌和L.plantarum等)的首选碳水化合物来源一致[21]。对于生长活力而言,经葡萄糖胁迫和复合胁迫处理的L.plantarumKLDS 1.0328菌体的OD600nm和活菌数相较于对照组均显著下降(P<0.05),且复合胁迫组中生长活力降低的趋势更大。此外,Tween 80胁迫组的生长活力与对照组相比未发生明显变化,这表示L.plantarumKLDS 1.0328具有一定自我调控及适应Tween 80缺乏环境的能力,乳酸菌在Tween 80胁迫下的存活取可能决于它们利用其他营养物质的能力[22]。以葡萄糖作为碳源的营养胁迫环境下所产生的较高菌液pH值和较低生长活力的现象,取决于其偏爱有效吸收及利用葡萄糖的代谢途径,因而不存在葡萄糖的培养基的生长及代谢水平与碳水化合物葡萄糖富集的培养基相比较低[23]。Hussian等[24-25]研究营养胁迫下干酪乳杆菌的适应能力时也发现,该菌株在无乳糖所导致的胁迫环境下培养30 d后仍能存活,说明尽管相对于富含碳水化合物培养下的干酪乳杆菌,无乳糖培养的干酪乳杆菌具有较低的生长速率和最终光密度,但该菌株仍具有适应营养胁迫环境的能力。
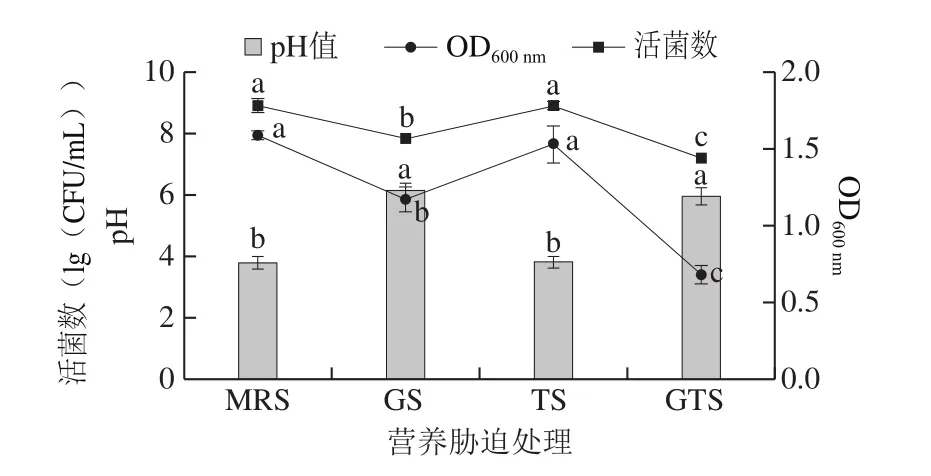
图1 营养胁迫处理后L.plantarumKLDS 1.0328的pH值和生长情况分析Fig.1 pH and growth of L.plantarum KLDS 1.0328 under nutrient stress
2.2 营养胁迫对L.plantarum KLDS 1.0328抑菌活性的影响
如图2所示,在未经营养胁迫处理的基础MRS培养基中,L.plantarumKLDS 1.0328抑菌活性显著高于葡萄糖胁迫处理组(P<0.05),且对S.aureusATCC 25923和E.coliATCC 25922的抑菌圈直径分别为(18.89±0.29)mm和(17.94±0.38)mm。此外,对照组和营养胁迫组中对S.aureusATCC 25923抑菌活性均显著高于E.coliATCC 25922。在Tween 80或葡萄糖和Tween 80复合营养胁迫环境下,未检测到细菌素抑菌活性。这说明Tween 80是L.plantarumKLDS 1.0328细菌素生产中非常关键的物质前提。结合图1,可推测乳酸菌细菌素的抑菌活性和生长活力之间并不一定存在同步关系。此外,对比关于已有Tween 80胁迫下乳酸菌的研究可以发现,乳酸菌细菌素的抑菌活性除了受环境因素影响,还可能具有菌株特异性。Fadahunsi等[26]报道了乳酸菌培养基中Tween 80对乳酸菌生长及细菌素合成具有至关重要的作用。这也与Huot等[27]的结果相似,其分析发现Tween 80的存在使乳酸乳球菌细菌素的产量增加了4 倍。Tween 80造成的影响可以归因于其与乳酸菌细菌素的解聚和脱吸附有关[28]。
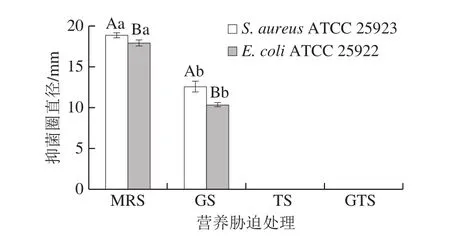
图2 营养胁迫处理后L.plantarum KLDS 1.0328的抑菌活性分析Fig.2 Antimicrobial activity of L.plantarum KLDS 1.0328 under nutrient stress
2.3 营养胁迫下L.plantarum KLDS 1.0328形态的差异分析
通过扫描电镜观察L.plantarumKLDS 1.0328菌体在多种营养胁迫培养基中生长的形态变化。基础MRS液体培养基中菌体呈现出较为平滑和规则的形态(图3A);可直观发现,与未经胁迫处理组相比,葡萄糖胁迫处理得到的菌体普遍变短,部分呈现卵圆形(图3B);Tween 80胁迫下菌体呈现出细长的棒状,且部分产生了略微褶皱的表面(图3C);葡萄糖和Tween 80复合胁迫则导致菌体呈现出短杆乃至卵圆状的形态(图3D)。

图3 营养胁迫处理后L.plantarumKLDS 1.0328的扫描电镜图Fig.3 SEM images of L.plantarum KLDS 1.0328 under nutrient stress
由表2可知,经Tween 80胁迫的菌体具有最大长度2.07 μm;与对照组菌体相比,Tween 80胁迫导致菌体的长度/直径比显著增加,且其体积也由0.40 μm3显著上升至0.48 μm3。研究显示,乳杆菌在没有隔膜生长、侧壁产生肽聚糖的情况下时,由于细胞不完全分裂或细胞分裂异常,可能导致菌体转变为细长丝状杆的形态[19]。葡萄糖胁迫及葡萄糖和Tween 80复合胁迫菌体的长度之间无显著性差异(P>0.05),且均显著低于未受胁迫菌体的长度1.60 μm(P<0.05)。营养胁迫处理的各组菌体直径之间无显著差异(P>0.05)。此外,葡萄糖胁迫及葡萄糖和Tween 80复合胁迫菌体的平均长度、长度/直径比和体积与对照组相比均显著减小(P<0.05)。这可能是因为菌体的短杆或球形形态可使菌体具有较大的营养摄取表面积,从而在营养缺乏的环境中保持其活性[29]。因此,可进一步推测菌体形态上所发生的变化可作为细菌生存及适应营养胁迫环境的重要方式。

表2 营养胁迫对L.plantarumKLDS 1.0328的平均长度、直径、长度/直径比和体积的影响Table 2 Effect of nutrient stress on average cell length, diameter,length/diameter ratio and volume of L.plantarum KLDS 1.0328
2.4 营养胁迫下L.plantarum KLDS 1.0328细胞膜脂肪酸的差异分析
如图4所示,暴露于不同营养饥饿环境下菌体的细胞膜脂肪酸的含量均有不同程度变化。4 组样品中共检测出9 种脂肪酸,其中包含4 种饱和脂肪酸(saturated fatty acid,SFA)和5 种不饱和脂肪酸(unsaturated fatty acid,USFA)。SFA分别包括豆蔻酸C14:0、十五酸C15:0、棕榈酸C16:0和硬脂酸C18:0;USFA分别包括棕榈烯酸C16:1n-9、十八碳烯酸C18:1n-7、油酸C18:1n-9、亚油酸C18:2和环丙烷脂肪酸cycC19:0。与对照组相比可以发现,葡萄糖胁迫及Tween 80胁迫菌体的细胞膜脂肪酸中的C14:0和C15:0含量均显著减少,C18:1n-9和cycC19:0含量显著升高(P<0.05)。葡萄糖胁迫组的C16:1n-9显著高于对照组,而Tween 80胁迫组恰好相反(P<0.05)。此外,葡萄糖和Tween 80复合胁迫组的C16:1n-9显著低于对照组,C18:1n-9和cycC19:0含量显著高于对照组(P<0.05)。研究表明,cycC19:0是一种经油酸甲基化得到的USFA,其产生对于菌体抵御严酷环境的破坏具有重要的价值[30]。值得注意的是,不同营养胁迫处理后菌体的总UFSA和SFA含量比值具有明显差异性。其中,对照组菌体细胞膜的USFA/SFA值为1.26,而葡萄糖胁迫组中USFA/SFA值在4 组样品中最高约为1.41,Tween 80胁迫组和复合营养胁迫组的USFA/SFA值分别为1.35和1.32。这种UFSA占比增加的现象和Haddaji等[31]的研究相似,其也提出细菌可通过改变自身细胞膜脂肪酸的组成和含量作为适应胁迫环境的策略,细胞膜流动性受其USFA/SFA值的变化而调控,以降低其营养胁迫下的损伤。
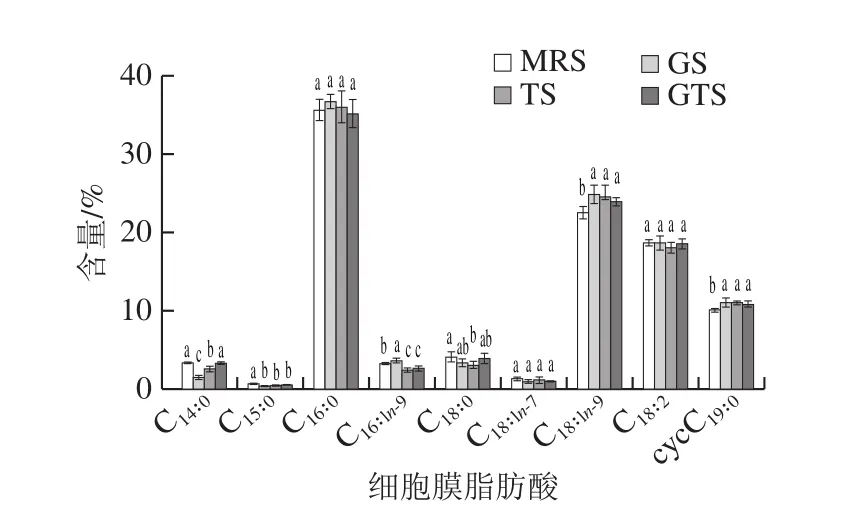
图4 营养胁迫处理对L.plantarumKLDS 1.0328细胞膜脂肪酸成分及含量的影响Fig.4 Effect of nutritional stress on the fatty acid composition and content of cell membrane of L.plantarum KLDS 1.0328
2.5 营养胁迫对冷冻干燥L.plantarum KLDS 1.0328存活率的影响
如表3所示,未受到营养胁迫L.plantarumKLDS1.0328在冷冻干燥后的存活率为(82.49±3.86)%。与未受营养胁迫菌体相比,葡萄糖胁迫处理菌体在冻干后存活率略低,但两者间不存在显著差异(P>0.05);葡萄糖和Tween 80复合胁迫菌体在冻干后存活率显著低于前两者(P<0.05);Tween 80胁迫后菌体在冻干后的存活率也显著降低,为4 组样品中的最低((30.18±4.20)%)。此外,经营养胁迫和未经胁迫处理的各组冻干菌粉的水分质量分数和水分活度之间无显著差异(P>0.05)。水分质量分数及水分活度与益生菌粉的贮存稳定性密切相关[32]。已有研究表明乳基质中的水分质量分数一般应低于5%左右的临界值,水分活度一般为0.1~0.25,以保证微生物菌体的稳定性[33-34],过高或过低的水分活度和含量都会对菌体造成潜在的伤害。本研究结果表明样品的水分质量分数和水分活度均在此范围内。

表3 冷冻干燥L.plantarum KLDS 1.0328的存活率、水分质量分数和水分活度Table 3 Survival rates, moisture contents and water activity of lyophilized L.plantarum KLDS 1.0328
2.6 营养胁迫处理的冻干L.plantarum KLDS 1.0328在不同贮存温度下的存活率
如图5所示,未经胁迫处理和营养胁迫处理的菌体在4 种温度下的存活率,整体上均随贮存时间的延长呈现下降的趋势。与更高的贮存温度实验组和其余营养胁迫处理组菌粉相比,在-18 ℃条件下贮存的葡萄糖胁迫冻干菌粉在贮存42 d的存活率最高,为(64.57±2.60)%。各组营养胁迫冻干菌粉于4 ℃贮存42 d期间,其存活率的变化趋势与-18 ℃贮存环境下的相似。葡萄糖胁迫对于提高L.plantarumKLDS 1.0328冻干发酵剂在42 d贮存期间内的稳定性起到了显著的积极作用(P<0.05),尤其是当贮存温度控制在25 ℃和37 ℃时。当营养胁迫菌粉贮藏于37 ℃时,对照组和3 种营养胁迫实验组在0~7 d期间内的存活率均明显降低,未经营养胁迫和Tween 80胁迫的冻干菌粉在37 ℃贮藏42 d存活率仅分别为(7.54±2.40)%和(2.19±0.98)%,而经葡萄糖胁迫处理后存活率可达(33.17±3.19)%,为对照组的4.40 倍。此外,葡萄糖和Tween 80复合胁迫对冻干菌粉在贮存期内活力的保护也具有一定的益处。据报道,葡萄糖缺失带来的营养胁迫可能导致乳酸菌对其他胁迫条件(如酸、热、渗透压及氧胁迫)的耐受性的增强[8]。Chen等[14]通过蛋白质组学分析揭示了胁迫预适应处理可能会诱导相关应激蛋白合成的增加,从而引起对同源胁迫的保护和对异源胁迫的交叉保护作用。此外,如前所述细菌细胞膜脂肪酸的变化可解释葡萄糖胁迫下L.plantarumKLDS 1.0328冻干菌粉在贮藏期间稳定性和生存能力的提高[35]。
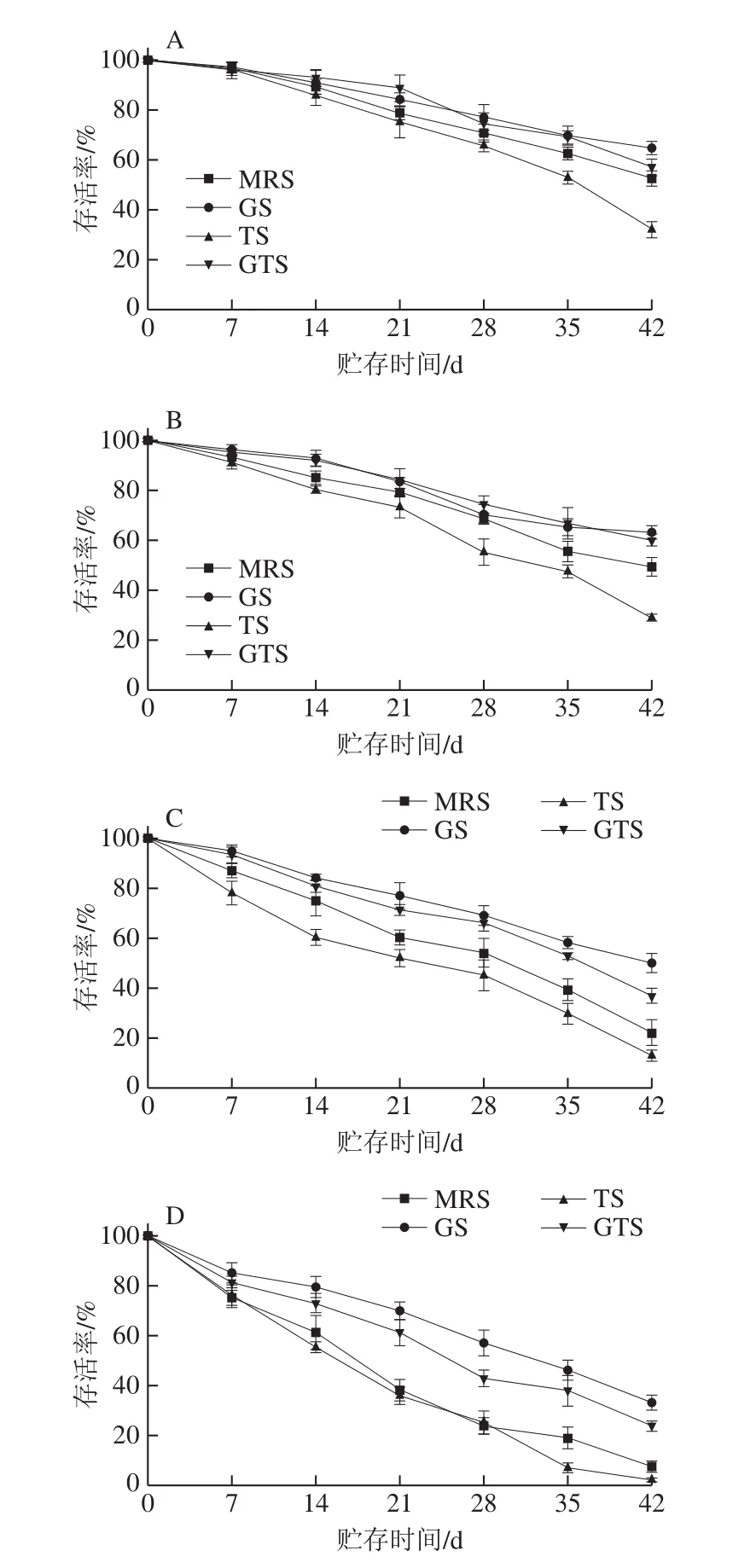
图5 营养胁迫处理冻干L.plantarumKLDS 1.0328在不同温度下贮存42 d的存活率Fig.5 Survival rates of freeze-dried L.plantarum KLDS 1.0328 under nutrient stress stored at −20, 4, 25 or 37 ℃ for up to 42 days
3 结 论
研究发现,与未经胁迫对照组相比,葡萄糖胁迫及葡萄糖和Tween 80复合营养胁迫对L.plantarumKLDS 1.0328的生长、产酸和细菌素抑菌活性方面均有不利影响,并且在复合胁迫培养基中得到的样品未检测出细菌素抑菌活性;尽管Tween 80胁迫下的菌体生长较为旺盛、产酸量较高,但也未检测到细菌素抑菌活性;菌体由短杆状转变为长棒状或卵圆形的形态可作为其暴露于Tween 80胁迫或葡萄糖及复合营养胁迫环境下的生存策略;细胞膜脂肪酸的组成和含量对维持菌体在多种营养胁迫下的存活和形态也具有重要意义;以上指标的检测对于研究菌株的营养胁迫适应和生存机制提供了理论支持。此外,未胁迫和经葡萄糖胁迫的菌体经冷冻干燥后存活率无显著差异,且多种营养胁迫菌粉的水分含量和水分活度均在合理范围内。本研究得出葡萄糖胁迫可显著提高冷冻干燥L.plantarumKLDS 1.0328在不同温度下贮存42 d期间的存活率,且于-18 ℃条件下的存活率较高。该结果为开发和针对性设计L.plantarumKLDS 1.0328培养基及提高其贮存稳定性提供了参考。
