学科关键能力视角认识钠及其化合物
2021-12-03赵玉双博士
■赵玉双(博士)
学科关键能力作为高考重要的考查目标,是测试和评价的核心指标和因素。对化学学科关键能力的评述有很多,可以说是百家争鸣,本文借助王磊教授提出的“3×3”的化学学科能力要素,以钠及其化合物为知识载体,探讨新高考形势下本部分知识内容的命题方向。“3×3”的化学学科能力要素:学习理解(辨识记忆、概括关联、说明论证)、应用实践(分析解释、推论预测、简单设计)、迁移创新(复杂推理、系统探究、创新思维)。
钠及其化合物是常见的无机物及其应用主题下金属及其化合物的典型代表。钠及其化合物的学习目标:
(1)了解钠元素在自然界的存在形式。
(2)掌握钠的结构、物理性质、化学性质、冶炼和用途等方面知识。
(3)掌握钠的重要化合物(如Na2O、Na2O2、NaOH、Na2CO3、NaHCO3)的主要性质和在生产、生活中的应用。
(4)掌握钠及其化合物之间的相互转化规律,并能够正确书写相应的化学(离子)方程式。
(5)掌握用焰色试验检验Na+、K+的方法。
(6)通过以上内容的学习,掌握学习一种物质的一般思路和方法,掌握“结构决定性质,性质反映结构”的学科思想。
下面从学科关键能力视角出发,借助钠及其化合物的“物质类别—元素价态”二维图(如图1),从概念性知识的学习理解(A 层级,A1 辨 识 记 忆、A2 概 括 关 联、A3 说 明 论证)、应用实践(B层级,B1分析解释、B2推论预测、B3简单设计)、迁移创新(C层级,C1复杂推理、C2系统探究、C3创新思维),分析新高考形势下经典命题方向及解题策略。

图1
一、钠及其化合物基础知识
例1 下列关于钠的说法不正确的是( )。
A.银白色、柔软
B.密度比水小
C.与水反应生成氢气
D.在空气中燃烧生成氧化钠
答案:D
考点分析:由钠及其化合物的“物质类别—元素价态”二维图可知金属钠可以转化为氧化钠、过氧化钠、氢氧化钠,需要熟悉相应的反应方程式。钠及其化合物的名称、俗名、物理性质、化学性质、典型实验现象及应用、主要反应的化学方程式均属于A1 辨识记忆类知识,此类试题考查相关题目的难度较小,做此类题目只需关注课本内容,梳理关联知识点,识记即可。
例2 下列有关试剂的保存方法不正确的是( )。
A.Na保存于煤油中
B.过氧化钠应密封保存
C.浓硝酸保存于无色试剂瓶中
D.浓硫酸保存于铁质容器中
由钠及其化合物的“物质类别-元素价态”二维图可梳理出钠及其化合物之间的转化关系,钠可以和空气中氧气、水反应,因此Na不能在空气中放置,钠的密度比煤油大,且不和煤油反应,实验室中常将钠保存在煤油中,A 项正确。过氧化钠易和空气中的二氧化碳、水蒸气反应,应密封保存,B项正确。浓硝酸对光不稳定,见光分解为二氧化氮、氧气、水,应保存于棕色试剂瓶中,C项错误。常温下,铁遇到浓硫酸钝化,故可将浓硫酸保存于铁质容器中进行运输,D 项正确。
答案:C
考点分析:本题中A、B 选项均可利用“物质类别—元素价态”二维图来判断,钠很活泼,极易在空气中被氧化,且在空气中燃烧后生成过氧化钠,过氧化钠还能继续与水、二氧化碳反应。建立钠单质及其化合物的性质、保存方式及应用之间的关联,属于A2概括关联层级,整体考查相关题目的难度较小,做此类题目只需关注课本知识,识记即可。若考查A、B选项的原因,那么难度上升为B1分析解释层级,利用钠及其化合物的性质及转化关系,分析解释生活中的问题。
例3 为研究Na 的性质,进行如下实验。

____________________________________________________________实验装置液体a 现象___________蒸馏水 Ⅰ.Na浮在液面上,剧烈反应,产生少量白雾______images/BZ_44_287_1312_428_1539.png0.1mol·L-1盐酸Ⅱ.Na浮在液面上,反应比Ⅰ中剧烈,产生白雾____浓盐酸Ⅲ.Na浮在液面上,反应比Ⅰ中缓慢,产生大量白______________________________雾,烧杯底部有白色固体
下列说法中,不正确的是( )。
A.Ⅰ中现象说明Na与水反应放热
B.Ⅰ中反应的离子方程式为2Na+2H2O2Na++2OH-+H2↑
C.Ⅲ中白雾比Ⅱ中多,说明Ⅲ中反应放热比Ⅱ中更多
D.推测Ⅲ中反应缓慢可能与c(Cl-)以及生成的白色固体有关
Na投入到蒸馏水中,可与水发生反应,生成氢气和氢氧化钠,教材中该反应典型的现象是“浮、游、响、动、红”,A 项正确。Na与水反应的离子方程式为2Na+2H2O2Na++2OH-+H2↑,B项正确。浓盐酸易挥发,对照实验Ⅲ和Ⅱ,氢离子浓度增加,钠与氢离子反应放热增加,同时除有挥发的水蒸气外,还有挥发出的HCl气体遇到空气中水蒸气呈现更多的白雾,C项错误。对照实验Ⅲ和Ⅱ可知,反应的实质是钠与氢离子反应,之所以反应缓慢,可能与c(Cl-)以及生成的白色固体有关,详细分析白色固体为氯化钠,而氯化钠形成的原因为浓盐酸中c(Cl-)较大,促进氯化钠晶体析出,D 项正确。
答案:C
考点分析:本题利用钠与水的反应和控制变量思想,推论和预测钠和稀盐酸、浓盐酸的陌生反应的实验现象,是对钠及其化合物性质应用的又一提升,属于B2推论预测层级问题。解决此类问题需要掌握钠的基本性质,分析出钠与水反应本质是钠与水电离出的氢离子反应,进而理解稀盐酸中氢离子来源,浓盐酸中氢离子浓度。在关注氢离子浓度的同时还需关注盐酸溶液的整体性,即其中氯离子浓度的变化。因此D 选项的考查相对于前面选项又增加一个思维难度,是对钠与水反应的综合问题的迁移,属于C1复杂推理层级。
二、钠及其化合物转化关系及实验
例4 以不同类别物质间的转化为线索,认识钠及其化合物。
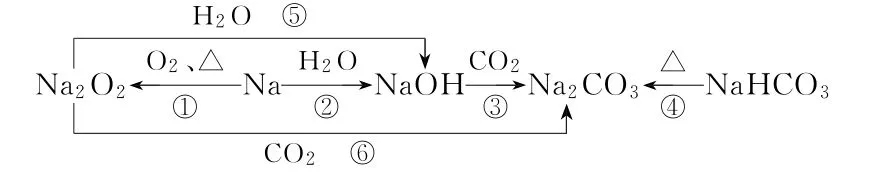
下列分析不正确的是( )。
A.反应③表明CO2具有酸性氧化物的性质
B.反应④说明稳定性NaHCO3强于Na2CO3
C.反应⑤⑥可用于潜水艇中氧气的供给
D.上述转化中发生的反应有分解反应、化合反应、置换反应
碱的通性中,与碱反应生成盐与水的氧化物为酸性氧化物,二氧化碳与氢氧化钠反应生成碳酸钠和水,则反应③表明CO2具有酸性氧化物的性质,A 项正确。碳酸氢钠受热分解生成碳酸钠、水、二氧化碳,则反应④说明稳定性Na2CO3强于NaHCO3,B项错误。过氧化钠与水、二氧化碳反应生成产物中有氧气,日常生活中过氧化钠可用于潜水艇中氧气的供给,C 项正确。钠与O2燃烧生成Na2O2,为化合反应,钠和水反应置换出氢气为置换反应,碳酸氢钠受热分解为分解反应,D 项正确。
答案:B
考点分析:本题借助转化关系将考查内容图表化,主要考查转化关系中的推理关系,比如反应③碱的通性中与酸性氧化物的反应,反应④考查物质的稳定性,通过转化关系碳酸氢钠分解为碳酸钠,推理说明碳酸氢钠不稳定。反应⑤⑥利用反应实现性质的应用,关联真实情境,是对实际生活问题的解释。因此本题整体难度提升为B2 推论预测层级。
例5 某小组同学进行Na2CO3和NaHCO3性质的探究,实验如下(夹持装置已略去,气密性已检验)。_____________________

实验Ⅰ 实验Ⅱimages/BZ_45_256_1254_565_1505.pngimages/BZ_45_634_1271_1016_1482.png
(1)实验Ⅰ,能够证明Na2CO3的热稳定性强于NaHCO3的证据是_____。
(2)实验Ⅱ,方框中为洗气装置,请将该装置补充完整。
(3)实验Ⅱ,试剂a为____。
(4)实验Ⅱ,实验持续一段时间后,观察到饱和Na2CO3溶液中有细小晶体析出,用化学方程式表示产生细小晶体的原因:____。
(1)实验Ⅰ中,能够证明Na2CO3的热稳定性强于NaHCO3的证据是相同条件下,A 试管中无明显现象,B试管中澄清石灰水变浑浊,B 中二氧化碳遇到澄清石灰水,澄清石灰水变浑浊,生成碳酸钙和水,反应的离子方程式是
2OH-+Ca2++CO2H2O+CaCO3↓。
(2)实验Ⅱ中,圆底烧瓶中盛放碳酸氢钠固体,滴加稀盐酸发生反应,生成氯化钠、二氧化碳和水,离子方程式是HCO-3+H+CO2↑+H2O,生成的二氧化碳中含有挥发的氯化氢杂质,通过饱和碳酸氢钠溶液,吸收CO2中的HCl杂质,因此除杂的装置为长管进入,短管导出。
(3)试剂a为饱和碳酸氢钠溶液。
(4)前述生成的二氧化碳与饱和碳酸钠溶液反应的化学方程式是CO2+Na2CO3+H2O2NaHCO3↓,由于相同条件下,饱和溶液中碳酸钠的溶解度大于碳酸氢钠,所以饱和碳酸钠溶液中碳酸氢钠先达到饱和析出晶体沉淀,方程式中标明沉淀符号。
答案:(1)相同条件下,试管A 中无明显现象,试管B 中产生白色沉淀 (2)(3)饱和NaHCO3溶液
(4)Na2CO3+H2O+CO22NaHCO3↓
考点分析:碳酸钠和碳酸氢钠的性质差异是本单元学习的重点,利用含钠元素物质的性质和研究无机物性质的思路方法,设计简单实验研究两者的差异,属于B3简单设计层级。关于除杂装置的绘制实际考查的是实验操作能力,除杂一步将试题难度提升为对整个体系的探究,为C2系统探究层级问题。
三、钠及其化合物与真实情境相联系的实验探究
例6 某课外活动小组设计了如图2所示装置,验证二氧化碳跟过氧化钠反应时需要与水接触。
装置分析:
(1)装置①中反应的离子方程式是_____。
(2)装置②中的试剂是____(填序号)。
a.饱和NaHCO3溶液
b.饱和Na2CO3溶液
c.浓硫酸
(3)装置③中的试剂是____。
进行实验:
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
(1)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是____。
(2)过氧化钠跟二氧化碳反应的化学方程式是_____。
实验反思:
(1)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应。”其理由是____。
(2)需要补充的实验操作是:取⑤中反应后的少量固体,___。
根据装置图和实验目的判断出该装置为证明结论二氧化碳与过氧化钠反应需要水参与,因此在设计实验过程首先制备纯净的二氧化碳,然后通入装置中与过氧化钠固体反应,为探究水的作用,设置对照组实验完成控制变量的实验设计,关键因素是变量水的有和无。由上述分析可得出:装置①是制备二氧化碳的发生装置;装置②为除杂装置,用于除去HCl;要验证二氧化碳跟过氧化钠反应时需要与水接触,装置④⑤中通入的气体应该分含水和不含水两种,本实验中没有额外加入水,而是借助水蒸气作为反应物,从而设置对照组实验。从除杂装置②中出来的气体是带水蒸气的,直接通入装置⑤中,则装置⑤中是有水蒸气的,所以装置④中就是没有水蒸气的,因此装置③是干燥装置,即除去二氧化碳中的水蒸气的装置,由图示可知为液体干燥剂,常用的干燥二氧化碳气体的液体干燥剂为浓硫酸;装置④⑤是对比实验装置,用于判断干燥的二氧化碳是否与过氧化钠反应;装置⑥目的为避免空气中的水、二氧化碳进入装置④⑤,最后用带火星的木条检验是否生成氧气,据此分析解答。
装置分析:(1)装置①中盐酸和碳酸钙反应生成二氧化碳,反应的化学方程式为CaCO3+2HClCaCl2+H2O+CO2↑,离子方程式为CaCO3+2H+Ca2++H2O+CO2↑。
(2)盐酸易挥发,装置②应该是用于除去HCl,装置②中试剂应为饱和碳酸氢钠溶液,离子方程式为 HCO-3+ H+H2O+CO2↑;饱和碳酸钠也能吸收二氧化碳;浓硫酸与氯化氢不反应,不能吸收氯化氢。
(3)实验的目的是验证二氧化碳跟过氧化钠反应时需要与水接触,装置④⑤中通入的气体应该一个有水蒸气,一个没有,从而做对照实验。从装置②中出来的气体带有水蒸气,直接通入装置⑤中,则装置⑤中反应与水接触。装置④中应为不与水接触,因此装置③是除去二氧化碳中的水蒸气的液体干燥装置,装置内液体为浓硫酸。
进行实验:(1)步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,装置④中没有水蒸气,则二氧化碳不能和过氧化钠反应,不能生成氧气,所以a处带火星木条不复燃。步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,装置⑤中有水蒸气,则二氧化碳能和过氧化钠反应生成氧气,所以a处带火星木条复燃。
(2)过氧化钠跟二氧化碳反应的化学方程式是2Na2O2+2CO2Na2CO3+O2。
实验反思:(1)水与过氧化钠也能够发生反应生成氧气,不能证明二氧化碳与过氧化钠反应生成了氧气,由此可见检验氧气的生成与否已不是该反应的特征现象了。
(2)从证明反应发生与否的角度还可以检验另一种生成物碳酸钠,因此需要补充的实验操作是取装置⑤中反应后的少量固体,加入稀盐酸,将产生的气体通入澄清石灰水中,观察是否变浑浊,从而验证过氧化钠与二氧化碳是否反应生成了碳酸钠。
答案:
装置分析:(1)CaCO3+2H+Ca2++H2O+CO2↑ (2)a (3)浓硫酸
进行实验:(1)步骤1 中木条不复燃,步骤2中木条复燃
(2)2Na2O2+2CO22Na2CO3+O2
实验反思:(1)气体中有水,水也可与Na2O2反应产生O2使木条复燃
(2)加入稀盐酸,将产生的气体通入澄清的石灰水中
考点分析:本题作为一道实验探究题目,探究目的在题干中给出:验证二氧化碳与过氧化钠反应时需要与水接触。由此可以看出探究目的也能得到探究结论,但是探究过程需要先理解装置图,根据探究目的思考每一步中装置的作用。本题也是解决真实情境的问题,即二氧化碳与过氧化钠反应是否需要有水参与。因此该题目进而转化为探究反应能否发生,及证明反应发生的证据推理。因此在实验反思步骤中提出证明生成物碳酸钠的方案,属于C3创新思维层级。
