不同卤虫混养比例对生物絮凝系统凡纳滨对虾标粗效果的影响
2021-12-02柳泽锋杨名帆罗国芝谭洪新
柳泽锋 杨名帆 罗国芝,2,3 谭洪新,2,3
(1上海水产养殖工程技术研究中心,上海海洋大学,上海 201306;2农业部淡水水产种质资源重点实验室,上海海洋大学,上海 201306;3水产科学国际级实验教学示范中心,上海海洋大学,上海 201306)
生物絮团(biofloc)是养殖水体中以异养微生物为主体,通过生物絮凝作用结合水体中的有机质、无机物、原生动物和藻类等而形成的絮状物。生物絮凝养殖技术(biofloc technology,BFT)通过培养生物絮团实现对养殖水体的原位控制,可以减少养殖水的排放,提高饲料的利用效率,是近年来广受关注的1种养殖方式[1-5]。
卤虫(Artemia)又名盐水丰年虫,是典型的滤食性生物,其氨基酸组成、脂肪含量、无机盐等营养元素都与虾、蟹幼体的组成相近,是目前最优质的海水生物幼体的开口饵料[2-3,6-7]。针对卤虫的无选择滤食性,有研究者利用生物絮凝技术养殖卤虫,将水产养殖固体废弃物形成的生物絮团作为饵料来促进卤虫生长,提高卤虫的营养价值,取得了良好的效果[8]。同时,卤虫摄食生物絮团能减少絮团中氨氮的再释放,有利于维持养殖水质的稳定[9]。
利用生物絮凝技术养殖凡纳滨对虾(Litopenaeusvannamei)是近年来水产养殖领域研究和实践的热点之一[10-11]。将卤虫幼体与凡纳滨对虾同时放入生物絮凝系统中混养,可以形成卤虫摄食生物絮团、对虾摄食卤虫的食物链,既能给幼虾提供活的开口饵料,又有利于维持良好的水质。本研究在生物絮凝凡纳滨对虾养殖系统中,按不同的比例投喂活的卤虫幼体和配合饲料,比较各处理组的虾苗标粗效果和水质状况,以期为完善相关养殖工艺提供参考。
1 材料和方法
1.1 试验材料
试验用凡纳滨对虾虾苗购自正大有限公司(海南),平均体质量为(0.08±0.02)g,初始放苗密度为200尾/m3。
将卤虫卵(购自山东省滨州市协源生物科技有限公司)置于盐度为30的人工海水中,强光照24 h孵化,获得试验用卤虫幼体。
试验用絮团培养参照柳泽锋等[12]的方法。
试验用虾饲料(通威股份有限公司,四川)含42%粗蛋白质,6%粗脂肪,5%粗纤维和15%灰分。虾片(越群海洋生物研究开发有限公司,广东揭阳)含46%粗蛋白质,8%粗脂肪,5%粗纤维和18%粗灰分。凡纳滨对虾1号饲料(常熟泉兴营养添加剂有限公司,江苏)含42%粗蛋白质,12%粗纤维,4%粗脂肪,18%粗灰分和2.2%赖氨酸。
1.2 养殖设备及试验设计
试验用养殖水槽共9个,其上部为直径110 cm的圆柱体,下部为圆锥体,锥体高38 cm,水槽总高度110 cm,容积500 L。养殖槽中接种已经培养好的絮团后,加入磨碎的虾饲料,使系统中初始悬浮颗粒物质量浓度(TSS)达到200 mg/L。充分曝气1周后,放入孵化好的卤虫和凡纳滨对虾苗。
根据卤虫与饲料投喂比例将养殖槽分为3个处理组,每组设3个平行。第1组(A组)100%投喂卤虫,养殖前10 d日投喂量按5 g/万尾虾苗计算,第10天后,日投喂量为对虾体质量的5%;第2组(AF组)投喂的卤虫与虾片的质量各占50%,日投喂量为对虾体质量的5%;第3组(F组)100%投喂虾片,日投喂量为对虾体质量的5%。1.3日常管理
每天投喂4次,投喂时间分别为8:00、12:00、17:00、22:00。每隔10 d,取5尾对虾称量体质量,以调节投饲量。养殖前10 d投喂虾片,自第11天开始投喂凡纳滨对虾1号饲料。
养殖过程中用加热棒加热,保持水温在26 ℃以上。用1台138 W的罗茨鼓风机为同一处理组的3个养殖槽供氧。除了补充因蒸发或取样损失的水分外,试验全程不换水。由于在含有高浓度絮团的养殖系统中容易出现对虾鳃部被堵塞的情况[9],因此在养殖过程中,每周测定1次絮团浓度,当浓度超过500 mg/L时,取出多余絮团(含水)放在圆桶中沉淀,将上清水重新加入养殖槽。
1.4 试验指标及其测试方法
1.4.1 水质和絮团指标的测定
养殖试验期间,每2 d检测水体的温度(T)、酸碱度(pH)、溶解氧(DO)以及碱度(Alk)、总氮(TN)、总氨氮(TAN)、亚硝酸盐氮(NO2--N)、硝酸盐氮(NO3--N)和溶解性有机碳(DOC)等指标。水质指标根据国家环境保护局的《水和废水监测分析方法》[13]进行测定。TN采用过硫酸钾氧化-紫外分光光度法(型号UV2000,上海尤尼柯,下同)测定;水样经0.45 μm滤膜抽滤后,测定三态氮和DOC;NO2--N质量浓度采用重氮-偶氮法测定;NO3--N质量浓度采用锌隔还原法测定;TAN采用次溴酸钠氧化法测定;DOC使用多功能C/N分析仪(Multi N/C 2100,德国)测定。碱度采用酸碱滴定指示法测定。每7 d测定1次生物絮团的5 min内沉降体积(FV-5 min)和总悬浮固体(total suspended solids,TSS)含量,其中,FV-5 min用英霍夫式锥形管取1 L水样静置5 min后读数测得,TSS采用沉重法测定。
脂肪酸测定:取0.2 g经冷冻干燥后的絮团于离心管中,采用氯仿-甲醇抽提法提取粗脂肪,将提出的粗脂肪用C19内标-正己烷、甲醇等溶液进行甲酯化,然后转入气相色谱安瓿瓶中通过气质联动仪(型号:7890-5977)检测。气相色谱条件为100 m×250 m×0.2 μm Agilent 112-88A7GC Columns,柱箱温度为250 ℃,载气为高纯氮气,压力0.326 MPa,流量1 mL/min,平均线速度20.733 cm/s,滞留时间80.038 9 min。按照面积归一法计算不同脂肪酸组分含量,以占脂肪酸总量百分比的形式呈现。
1.4.2 对虾生长指标
试验30 d后,从每个养殖槽中随机取5尾对虾测量其体长、体质量,并取平均值。对虾体长用游标卡尺测量,体质量用天平(精度为0.1 mg)称量。按以下公式计算对虾的存活率(survive rate,%)、体质量增长率(weight gained,%)、特定增长率(special growth rate,%/d)和饲料转化率(food conversion rate)。
存活率=100×(终末存活尾数/初始放养尾数)
(1)
体质量增长率=100×(终末虾体质量-初始虾体质量)/初始虾体质量
(2)
特定增长率=100×(ln终末虾体质量-ln初始虾体质量)/饲养时长
(3)
饲料转化率=总投饲量/(终末虾体质量-初始虾体质量)
(4)
1.5 数据处理和分析
采用EXCEL软件进行数据统计,采用Origin软件进行相关图表的绘制。数值用“平均值±标准差”形式表示。采用统计软件SPSS 19.0对数据进行ANOVA单因素方差分析,设显著性水平为0.05。
2 结果
2.1 水质指标变化
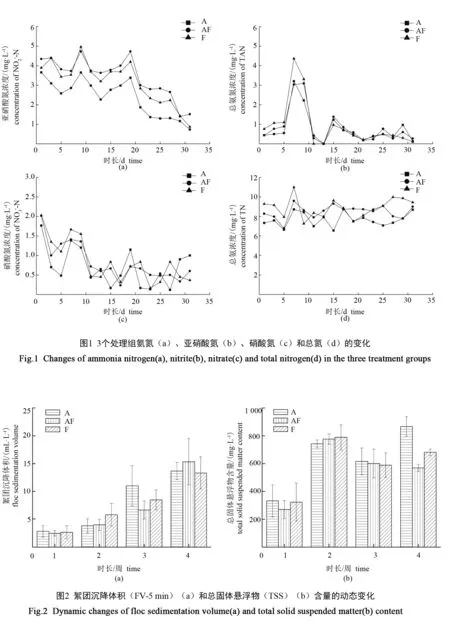
养殖30 d内,各处理组水质参数的平均值、最小值和最大值见表1。pH、DO、水温等常规水质指标均在适宜养殖对象生长的范围内波动。图1为养殖周期内的氮素相关指标的变化情况,结合表1可知,3个处理组的亚硝酸氮质量浓度均呈下降趋势,A组亚硝酸氮质量浓度显著低于另外2个组。各组氨氮浓度在养殖第7天时达到峰值,此后迅速降低,维持在1 mg/L以下,3个处理组间差异不显著(P>0.05)。3组硝酸盐浓度均无明显积累,且略有下降。
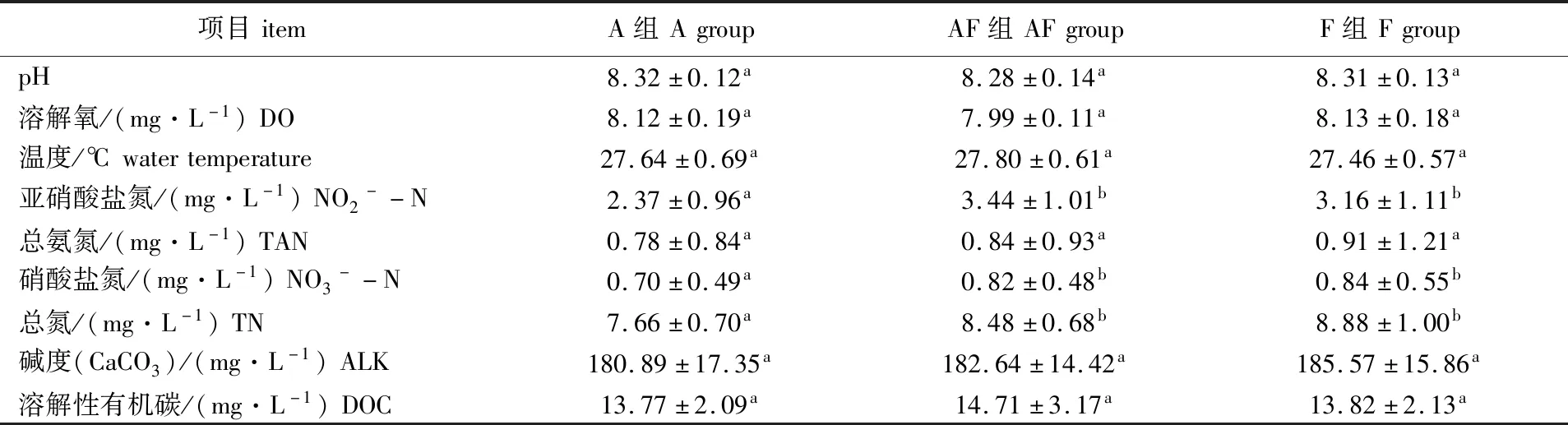
表1 试验期间3个处理组水质指标情况Tab.1 Water quality indices in three treatment groups during the experiment
养殖期间生物絮团沉降指标的变化情况见图2。其中,图2-a为FV-5 min的变化情况,可见各组均随着养殖时长的增加呈上升趋势(P>0.05);图2-b为每周的TSS含量,可以看出,第3、第4周的TSS含量较第2周有所降低,但总体上絮团仍不断增长,测得TSS实际数据均高于500 mg/L。
2.2 不同处理组絮团的脂肪酸含量
养殖结束后,取各组系统中的絮团测量脂肪酸含量,结果见表2。100%投喂卤虫的处理组(A组)中饱和脂肪酸(SFA)有8种,单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)各1种。50%投喂卤虫组(AF组)和0%投喂卤虫组(F组)SFA和MUFA的种类与A组相同,但AF组和F组中均未检测到包括C22∶6n-3(DHA)在内的PUFA,说明A组的絮团营养价值高于另外2个组。3个处理组中含量最高的脂肪酸均为C19∶0,这可能是因为检测脂肪酸含量过程中加入的C19内标-正己烷有较多残留。在3个处理组的絮团中均未检测出二十碳五烯酸(EPA),仅在A组检测到DHA。
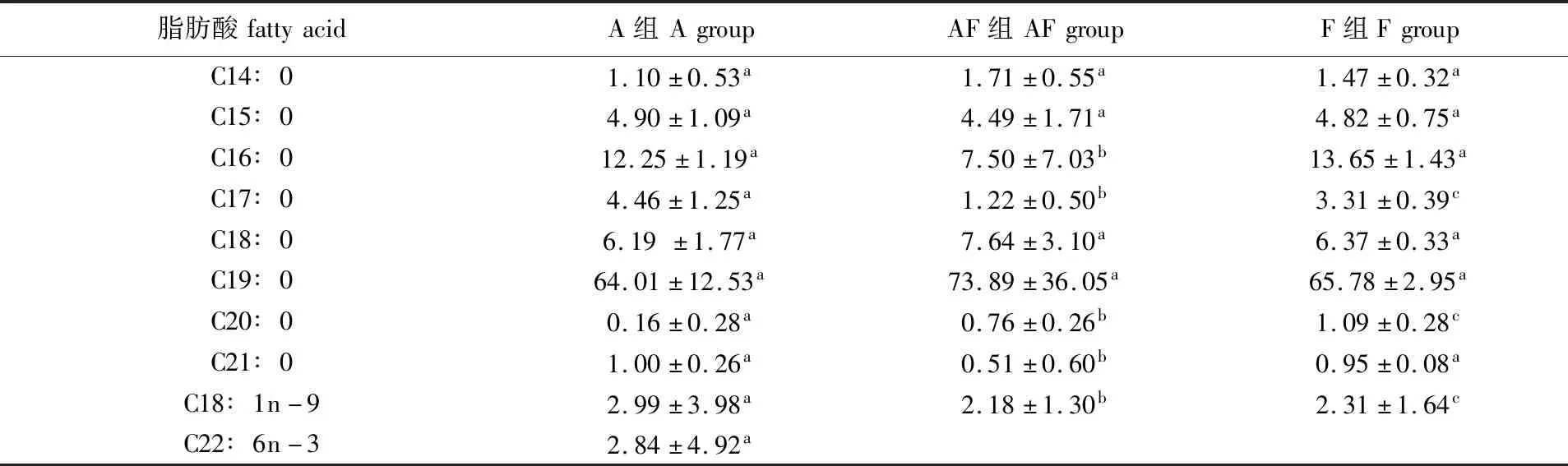
表2 养殖30 d后各组絮团中的脂肪酸组成Tab.2 Fatty acid composition in each group of flocs after 30 days of breeding
2.3 对虾生长参数
试验结束时,各组对虾的生长参数见表3。其中,A组对虾的存活率为35.67%,显著高于其他2组(P<0.05),其余2组存活率均低于30%。A组对虾的体质量仅为(1.92±0.96)g,显著低于AF组的(2.985±1.852)g和F组的(3.254±1.225)g(P<0.05)。3个处理组之间饲料转化率的差异显著(P<0.05),其中A组最高,F组最低。

表3 不同处理组凡纳滨对虾的生长指标Tab.3 Growth indexes of Litopenaeus vannamei in different treatment groups
3 讨论
生物絮凝技术现已成功应用于凡纳滨对虾养殖中[10-11,14-16]。生物絮团既可以直接被养殖系统中的对虾摄食,同时也可以控制水体的氨氮浓度,实现养殖水的原位净化[1]。有研究证明,利用生物絮凝技术将循环水养殖系统排出的固体废弃物转化成絮团喂养卤虫,能够取得较好的养殖效果,既可以实现养殖废弃物的资源化利用,也为卤虫养殖提供了1种新的营养来源[8]。生物絮团主要由细菌组成,细菌的代谢和死亡会造成氨氮的再释放[9]。生物絮团的浓度是生物絮凝水产养殖过程中主要控制指标之一:如果絮团浓度过低,便起不到控制水质的效果;如果絮团浓度过高,则会增加水体耗氧量和碱度,给系统维持增加困难[15-17]。生物絮团的粒径通常在50~1 000 μm[16]。如果在生物絮凝养虾水体中投喂适宜种类和数量的卤虫幼体,这些卤虫便可以摄食对虾不能直接摄食的较小的絮团,避免絮团过度积累,同时还可以将不稳定的细菌蛋白固定下来,有利于水质的维持。在养殖过程中,卤虫还可以作为饵料被凡纳滨对虾直接摄食,既有利于虾的生长,又可降低投饵量。因此,生物絮凝养虾工艺具有很好的应用前景。
本研究并未对卤虫在水体中的存活时间进行观察,卤虫投喂后可能很快被虾苗摄食,因此对水质的净化效果不明显。这说明本次试验卤虫的投放量可能太少,在今后的试验中应适当增加卤虫投放量并展开相关的量化研究。
3.1 凡纳滨对虾的生长情况
本试验表明,仅投喂卤虫幼体可以提高凡纳滨对虾幼虾的存活率,但该组虾的体质量增长率低于其他2个投喂配合饲料的试验组。这可能是由于卤虫幼体可以被幼虾积极摄食,因此幼虾存活率较高,但因卤虫的营养成分不如配合饲料全面,因此不利于对虾后期生长。卤虫本身缺乏高不饱和脂肪酸[6],姚妙兰[8]研究发现,虽然生物絮团作为卤虫饵料具有较高的营养价值,但对于必需脂肪酸含量的提高则没有明显效果。此外,本试验所有处理组形成的生物絮团中多不饱和脂肪酸(PUFA)含量也均较低,无法满足对虾生长的需求。这也说明在凡纳滨对虾养殖过程中不能仅投喂卤虫幼体,还需要混合投喂配合饲料以保证对虾能获得足够的营养。
本试验中卤虫无节幼体的投喂量是以湿质量计算的,与5%的干饲料相比存在投喂不足的情况,这可能是100%投喂卤虫处理组(A组)中对虾终末体质量最小的主要原因之一。
3.2 养殖水体中亚硝酸盐的积累
在养殖初始时,各试验组水体中的NO2--N浓度均较高,这可能是因为本次试验所用生物絮凝系统仅有10%的水体是取自于成熟稳定的生物絮凝系统,系统本身仍需要一定的时间进行构建。本次试验养殖水体盐度为30,有研究证明,在海水中亚硝酸盐对养殖动物的毒性会明显降低,一定浓度(4~5 mg/L)的NO2--N不会对凡纳滨对虾产生明显的负面作用[16]。总体上,本试验3个处理组中的氨氮等主要水质指标均在卤虫和凡纳滨对虾适宜的生长范围内,但对虾的存活率和生长率均低于大部分的研究结果[14-15,18-20],原因可能是本次试验絮团浓度太高(大部分试验时间絮团浓度在500 mg/L以上)。
4 结论
生物絮凝技术已被证明可以实现凡纳滨对虾的封闭式养殖。本研究结果表明,在凡纳滨对虾生物絮凝标粗系统中投放卤虫幼体能够明显提高幼虾的存活率,但是可能因为卤虫幼体的投放量不足,完全投喂卤虫组对虾的生长情况不如营养相对均衡的配合饲料组。本试验探究并证实了凡纳滨对虾和卤虫混养的可行性,但试验仅设置了3种卤虫幼体和配合饲料的投放比例,且梯度较大,今后将进一步研究不同养殖条件下卤虫的适宜添加量和种类等相关问题,以期完善相关养殖工艺。
