闽东海域繁殖期雌性棘头梅童鱼亲鱼不同组织的脂肪酸组成分析
2021-12-02曹平宋炜陈佳谢正丽王鲁民
曹平 宋炜 陈佳 谢正丽 王鲁民
(1 中国水产科学研究院东海水产研究所,农业农村部远洋与极地渔业创新重点实验室,上海 200090;2 上海海洋大学水产与生命学院,上海 201306;3 福建福鼎海鸥水产食品有限公司,大黄鱼育种国家重点实验室,福建宁德 352103;4 中国水产科学研究院渔业机械仪器研究所,农业农村部渔业装备与工程技术重点实验室,上海 200092)
棘头梅童鱼(Collichthyslucidus)俗称梅童、小金鳞等,隶属于鲈形目(Perciformes)、石首鱼科(Sciaenidae)、梅童鱼属(Collichthys),是广泛分布于我国近海和河口的小型经济鱼类,其肉质鲜嫩味美,营养丰富,是沿海居民重要的鲜食水产品[1-3]。近年来,由于过度捕捞等原因,棘头梅童鱼的天然资源呈现衰退趋势,价格上升,已无法满足市场需求[4]。目前国内相关科研单位利用野生棘头梅童鱼亲鱼已成功实现了人工育苗,并开展了有关饵料组成、摄食习性、繁殖特征和早期发育等方面的研究[5-9]。此外,陈仕煊等[10]报道了吕泗渔场棘头梅童鱼秋季脂肪酸组成,高学慧等[11]报道了棘头梅童鱼的肌肉营养成分组成。但总体而言,目前有关棘头梅童鱼营养学方面的研究仍然较少。
亲鱼脂肪及脂肪酸储备情况是影响其繁殖性能和后代发育的重要因素[12-14]。目前国内外尚未见有关棘头梅童鱼亲鱼脂肪及脂肪酸水平的研究报道。本研究对野生棘头梅童鱼亲鱼不同组织中的脂肪含量和脂肪酸组成进行定量检测和分析,以期了解棘头梅童鱼亲鱼在性腺发育后期脂类及脂肪酸的蓄积特点,为亲鱼培育和人工育苗技术提供基础资料和相关依据。
1 材料和方法
1.1 材料采集
雌性棘头梅童鱼亲鱼于2018年6月捕获于福建省闽东海域。挑选30尾鱼体健壮、无病害的个体作为测试分析样本。试验鱼的平均体长为(13.15±2.08)cm,平均体质量为(38.32±12.67)g,卵巢发育均为Ⅳ期。
1.2 样品处理
将捕捞后的试验鱼冷藏运回实验室,逐尾解剖样品,并分别取其卵巢、肝脏和背部肌肉组织,卵巢、肝脏和肌肉组织各为1组。将每组样品粉碎均匀并分成2份,自封袋封存,1份用于脂肪测定,另1份用于脂肪酸测定。
1.3 试验方法
1.3.1 脂肪含量测定
依照食品安全国家标准(GB 5009.6—2016),用索氏抽提法测定不同组织中的脂肪含量。
1.3.2 脂肪酸测定
(1)色谱条件
色谱柱:TG-5MS(30 m×0.25 mm×0.25 μm)。升温程序:80 ℃保持1 min,以10 ℃/min的速率升温至200 ℃,继续以5 ℃/min的速率升温至250 ℃,最后以2 ℃/min的速率升温至270 ℃,保持3 min。进样口温度:290 ℃。载气流速:1.2 mL/min。不分流进样,开阀时间为1 min。质谱条件:离子源温度为280 ℃,传输线温度为280 ℃,溶剂延迟时间为5.00 min,扫描范围为30~400 amu,离子源为EI源70 eV。
(2)样品处理
取80~100 mg混合均匀的样品加入到15 mL离心管中,继续加入2 mL 5%盐酸甲醇溶液、3 mL氯仿甲醇溶液(体积比1∶1)、100 μL十九烷酸甲酯内标。将上述离心管置于85 ℃水浴锅中水浴1 h。水浴完成后,待温度降到室温时,在离心管中加入1 mL正己烷,振荡萃取2 min后,静置1 h,等待分层。取上层清液100 μL,用正己烷定容到1 mL。最后用0.45 μm滤膜过膜后上机(ThermoFisher Trace 1310 ISQ气相色谱质谱联用仪,美国赛默飞世尔科技公司)测试。每组样品取样5次进行平行测定,以每种脂肪酸的质量浓度为基础计算其质量分数。
(3)计算公式
(1)
式(1)中:W为试样中各脂肪酸的含量,单位为mg/kg;C为试样测定液中脂肪酸甲酯的质量浓度,单位为mg/L;V为定容体积,单位为mL;k为各脂肪酸甲酯转化为脂肪酸的换算系数;N为稀释倍数;m为试样的称样质量,单位为g。
1.4 数据统计和分析
使用EXCEL 2017和SPSS 17.0统计软件分析处理试验数据。试验数据以“平均值±标准差”表示。利用单因素方差分析(One-Way ANOVA)检验不同组织中脂肪酸含量的差异性,并进行Duncan’s多重比较,设P<0.05为差异显著。
2 结果
2.1 不同组织中的脂肪含量
雌性棘头梅童鱼亲鱼不同组织中的脂肪含量如图1所示。卵巢、肝脏和肌肉中脂肪的质量分数分别为(4.84±0.05)%、(2.66±0.04)%和(0.56±0.05)%。3种组织间脂肪含量差异显著(P<0.05),其中卵巢中脂肪含量最高,约为肌肉组织中脂肪含量的8.6倍。
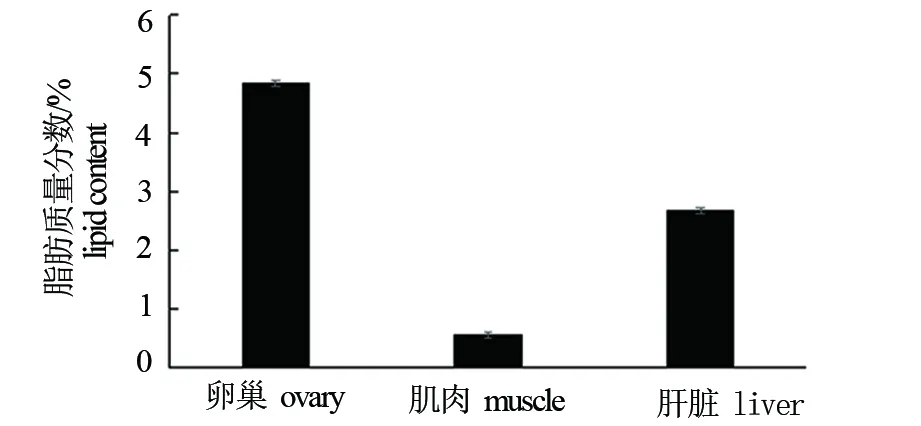
图1 雌性棘头梅童鱼亲鱼不同组织中的脂肪质量分数(鲜质量,n=5)Fig.1 Lipid content in different tissues of female Collichthys lucidus broodstocks(fresh weight,n=5)
在雌性棘头梅童鱼亲鱼的卵巢、肌肉和肝脏组织中分别检测出29种脂肪酸,包括12种饱和脂肪酸、7种单不饱和脂肪酸和10种多不饱和脂肪酸(见表1)。由表1可知,雌性棘头梅童鱼亲鱼卵巢、肌肉和肝脏中的饱和脂肪酸总含量分别为(3 831.38±37.18)、(1 430.84±14.47)和(4 235.14±37.83)mg/kg,其中含量较高的主要为C16∶0、C18∶0和C14∶0;单不饱和脂肪酸总含量分别为(2 501.69±8.53)、(396.82±1.82)和(867.07±2.99)mg/kg,其中含量较高的主要为C16∶1、C18∶1n9c和C20∶1;多不饱和脂肪酸总含量分别为(4 186.56±14.59)、(629.78±2.11)和(2 932.25±9.83)mg/kg,其中含量较高的主要为C22∶6n3(DHA)、C20∶5n3(EPA)和C20∶4n6(ARA)。肝脏中饱和脂肪酸的绝对含量高于卵巢和肌肉;卵巢中单不饱和脂肪酸和多不饱和脂肪酸的绝对含量均高于肌肉和肝脏。
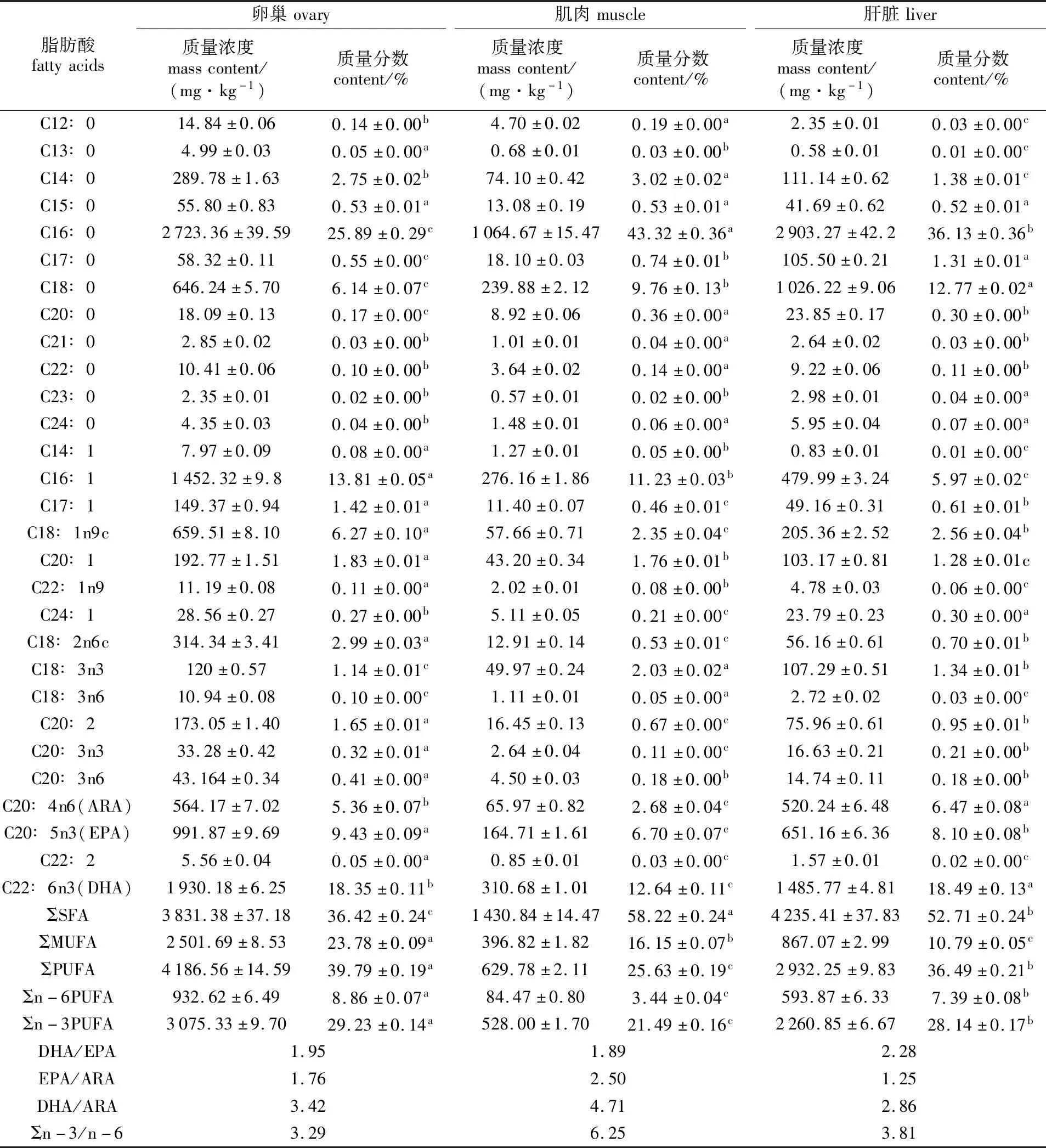
表1 雌性棘头梅童鱼亲鱼不同组织中的脂肪酸组成(n=5)Tab.1 Fatty acid composition in different tissues of female C. lucidus broodstocks(n=5)
2.2 不同组织中的脂肪酸组成
从相对含量来看,卵巢、肌肉和肝脏组织中的饱和脂肪酸均以C16∶0含量最高,质量分数分别为(25.89±0.29)%、(43.32±0.36)%和(36.13±0.36)%(P<0.05)。卵巢、肌肉和肝脏组织中单不饱和脂肪酸均以C16∶1含量最高,质量分数分别为(13.81±0.05)%、(11.23±0.03)%和(5.97±0.02)%(P<0.05)。卵巢、肌肉和肝脏组织中的多不饱和脂肪酸均以C22∶6n3(DHA)含量最高,质量分数分别为(18.35±0.11)%、(12.64±0.11)%和(18.49±0.13)%,其次为C20:5n3(EPA),质量分数分别为(9.43±0.09)%、(6.70±0.07)%和(8.10±0.08)%。卵巢中DHA+EPA的总量显著高于肌肉和肝脏(P<0.05)。
比较各组织中的脂肪酸总量,其饱和脂肪酸总量高低顺序为:肌肉>肝脏>卵巢,依次为(58.22±0.24)%、(52.71±0.24)%和(36.42±0.24)%(P<0.05)。单不饱和脂肪酸总量的高低顺序为:卵巢>肌肉>肝脏,依次为(23.78±0.09)%、(16.15±0.07)%和(10.79±0.05)%(P<0.05)。多不饱和脂肪酸总量高低顺序为:卵巢>肝脏>肌肉,依次为(39.79±0.19)%、(36.49±0.21)%和(25.63±0.19)%(P<0.05)。n-3系和n-6系多不饱和脂肪酸总量高低顺序均为:卵巢>肝脏>肌肉。DHA/EPA的值在肝脏中为最高(2.28),其次为卵巢(1.95),肌肉中最低(1.89),且具有明显差异(P<0.05)。不同组织中n-3系与n-6系多不饱和脂肪酸的比值具有明显差异(P<0.05),其中肌肉中最高,其次为肝脏,卵巢中最低。
3 讨论
3.1 繁殖期雌性棘头梅童鱼亲鱼不同组织间脂肪的分布
脂肪在亲鱼不同组织中的分布规律体现了其脂肪营养特点,对亲鱼生产性能和后代的体质有重要影响[15]。繁殖期雌性亲鱼脂肪的储存和积累一般会集中在卵巢组织[16]。本研究结果表明,雌性棘头梅童鱼亲鱼3种组织中的脂肪含量具有显著性差异,卵巢中脂肪质量分数最高,为(4.84±0.05)%,其次是肝脏,质量分数为(2.66±0.05)%,肌肉中脂肪质量分数最低,为(0.56±0.05)%,其脂肪含量呈现卵巢>肝脏>肌肉的规律。这与施兆鸿等[12]对灰鲳(Pampuscinereus)、宋超等[16]对纹缟虾虎鱼(Tridentigertrigonocephalus)的研究结果相一致,表明处于繁殖期的雌性棘头梅童鱼亲鱼,其脂肪营养会优先供给卵巢,保障卵巢发育的需求。Ⅳ期卵巢组织中的卵母细胞已经生长成熟,蓄积了大量脂肪等营养物质,使卵黄颗粒饱满,能够为以后受精卵和胚胎的发育提供物质基础和能量。在亲鱼卵巢发育的同时,大量脂肪也积累在肝脏中,肝脏作为脂肪合成和转化的主要场所,可将脂肪酸转化合成后转运到卵巢中进行蓄积和储存[17-18]。
3.2 繁殖期雌性棘头梅童鱼亲鱼不同组织间脂肪酸的组成
雌性棘头梅童鱼亲鱼不同组织间的脂肪酸组成存在明显差异,主要原因是各组织行使的生理功能不同。雌性棘头梅童鱼亲鱼卵巢中多不饱和脂肪酸含量最高,但其饱和脂肪酸含量低于肌肉和肝脏中的,表明雌性棘头梅童鱼亲鱼选择性地将多不饱和脂肪酸运往卵巢中进行积累。有研究证实,多种鱼类、贝类中也存在同样的规律[13,16-17]。卵巢中多不饱和脂肪酸的富集对细胞膜的形成及其离子通道的调节和激素调节等功能具有重要作用[14]。卵巢中大量积累的多不饱和脂肪酸可以作为卵子发育的营养物质,为后期卵子形成和胚胎发育等生理活动提供保障。
EPA和DHA在海水鱼类体内不能合成,必须由食物供给[19-20]。EPA和DHA直接影响冷水性鱼类的繁殖性能及其幼体的发育状况[21]。亲鱼食用经EPA和DHA营养强化的饲料后,其卵子和幼体质量大大提高[13]。如果DHA和EPA摄取不足,会阻碍鱼体色素沉积和视觉系统的发育,降低鱼苗的索饵能力,从而降低其成活率[22-25]。在雌性棘头梅童鱼亲鱼的肌肉、肝脏和卵巢等3种组织中均含有EPA和DHA。EPA含量在卵巢中是最高的,其次为肝脏;DHA含量在肝脏中最高,其次为卵巢。卵巢中较高含量的DHA和EPA可以为卵子及胚胎的发育提供营养保障。与其他肉食性海水鱼类基于归一化法测得的数据相比,雌性棘头梅童鱼亲鱼卵巢中的DHA质量分数为(18.35±0.11)%,与野生灰鲳(18.89%)[12]相近,高于渤海银鲳(Pampusargenteus)(14.35%)[24];EPA质量分数为(9.43±0.09)%,高于野生灰鲳(2.13%)[12]、渤海银鲳(3.94%)[24],而低于纹缟虾虎鱼(13.28%)[16]。这说明鱼体内的DHA和EPA含量与鱼的种类及其生活环境密切相关。
ARA对于海水鱼类正常发育也有着重要作用[16]。研究表明,饲料中添加ARA能增强黄鳝的肝功能,提高其脂肪代谢能力[25]。ARA能够改善鱼体繁殖和卵发育的性能,还能增强鱼苗抗胁迫的能力[13-14]。本研究结果显示,雌性棘头梅童鱼亲鱼的ARA在肝脏中含量最高,卵巢次之,肌肉中最低。此时期棘头梅童鱼亲鱼肝脏中较高的ARA含量可能有利于保持肝脏较高的脂肪代谢能力,有利于脂肪酸营养向卵巢中转移和积累。亲鱼的繁殖性能和所产卵子及其仔鱼的质量在很大程度上受亲鱼脂肪酸营养水平的影响,而亲鱼的脂肪酸组成与其摄食饵料的脂肪酸组成有关[15-26]。研究亲鱼不同组织中的脂肪酸组成,了解不同组织中脂肪酸营养的蓄积特点,能够帮助确定亲鱼强化饵料及仔鱼开口饵料中脂肪酸的营养水平。饵料中DHA∶EPA∶ARA的值是亲鱼或仔稚鱼饵料极为重要的营养指标[27]。不同品种的鱼类,其卵巢组织中DHA∶EPA∶ARA的值也存在差异。本研究中,雌性棘头梅童鱼亲鱼卵巢中DHA∶EPA∶ARA为1.51∶1∶0.52,与野生灰鲳(5.90∶1∶0.44)[12]相比,DHA含量相对较低,与纹缟虾虎鱼(1.59∶1∶0.20)[16]相比,ARA含量相对较高。
