黄连素逆转人结肠癌细胞奥沙利铂耐药性的作用及机制
2021-12-02黄国秀韦晓英罗珍玉蓝盈盈罗颖华
陈 琳, 李 卫, 黄国秀, 韦晓英, 刘 贺, 庞 羽, 罗珍玉, 蓝盈盈, 罗颖华
结肠癌是常见的消化道癌症之一,在全球癌症相关死亡原因中位列第三[1],目前化疗是中晚期结肠癌的主要治疗形式。奥沙利铂(oxaliplatin,OXA)是第三代铂类化疗药物,其毒副反应轻、疗效好,已广泛用于大肠癌和胃癌等治疗。然而,癌细胞耐药性的产生显著降低了OXA化疗的疗效[2]。黄连素(berberine,Ber)属于异喹啉类生物碱,可用于治疗癌症和消化、代谢、心血管和神经系统疾病[3]。近年研究发现,Ber既可逆转乳腺癌对多柔比星的耐药性[4],还可增强胃癌对5-氟尿嘧啶(5-fluorouracil,5-Fu)的敏感性[5],提示Ber在逆转肿瘤耐药方面具有重要的作用。本课题组既往研究发现,添加Ber可以显著降低OXA对THC-8307/OXA细胞的半数抑制浓度(half maximal inhibitory concentration,IC50),逆转了癌细胞对OXA的耐药性[6]。目前,关于Ber逆转结肠癌对OXA耐药性的机制研究报道较少,相关机制尚未明确。鉴此,本研究旨在探究Ber对人结肠癌耐OXA细胞(THC-8307/OXA细胞)耐药性的影响及其逆转机制,为Ber的临床应用提供实验室依据。
1 材料与方法
1.1材料 THC-8307/OXA细胞(批号:WG102808)由中国科学院细胞库提供。DMEM培养基和胎牛血清(fetal bovine serum,FBS)购自Thermo Fisher公司。ANNEXIN V-FITC/PI凋亡检测试剂盒、噻唑蓝(methyl thiazolyl tetrazolium,MTT)试剂盒购自北京Solarbio公司。OXA、Ber、鼠抗人P-gp(1∶1 000)抗体和鼠抗人GAPDH(1∶1 000)购自Sigma公司。兔单抗PI3K抗体(1∶1 000)、兔多抗p-AKT(1∶1 000)、兔单抗Akt抗体(1∶10 000)均购自Abcam公司。辣根过氧化物酶(horse radish peroxidase,HRP)标记羊抗鼠二抗和HRP标记羊抗兔二抗购于Santa Cruz公司。总RNA提取试剂盒购自天根公司。逆转录试剂盒和TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus)试剂盒购自Takara公司。
1.2方法
1.2.1 细胞培养与分组 THC-8307/OXA细胞用含10%FBS的DMEM培养液,于37 ℃、5% CO2条件下培养,同时细胞培养液中添加2.5 μg/ml OXA维持其耐药性。分别添加不同剂量浓度的Ber干预细胞,依次分为Ber(5 μg/ml)+OXA组、Ber(10 μg/ml)+OXA组、Ber(20 μg/ml)+OXA组和OXA组,各组OXA终浓度均为20 μg/ml,同时设立对照组(细胞培养液仅含2.5 μg/ml OXA)。各组均于干预36 h后收集样品进行检测分析。
1.2.2 细胞形态学变化观察 在干预结束后采用日本尼康公司Ti2倒置相差显微镜进行细胞形态学观察并采集图片。
1.2.3 MTT法检测 取对数生长期的细胞以3.0×105cells/ml接种于96孔培养板,每孔100 μl,于37 ℃、5% CO2条件下培养24 h。将10% FBS的DMEM培养液换成含Ber和OXA的培养液继续培养,按实验分组,每组设置3复孔,并设置空白对照孔,干预36 h后弃上清,加入90 μl含10% FBS的DMEM培养液和10 μl MTT溶液继续培养,4 h后弃上清,加入110 μl甲瓒(formazan)溶解液,于摇床上低速震荡10 min,使结晶充分溶解,酶标仪于490 nm测各孔吸光值(A值),结果取均值。细胞存活率=[(干预组A值-空白对照组A值)/(对照组A值-空白对照组A值)]×100%。
1.2.4 实时荧光定量逆转录聚合酶链反应(real-time quantitative reverse transcription-polymerase chain reaction,RT-qPCR)检测 各组细胞经Ber和OXA干预后弃上清,灭菌磷酸缓冲盐溶液(phosphate buffered saline,PBS)清洗2次,按总RNA提取试剂盒说明书进行总RNA提取,根据逆转录试剂盒操作说明书将RNA逆转录为cDNA,再进行RT-qPCR检测,各组均设置3个复孔。逆转录条件为:37 ℃ 15 min,85 ℃ 5 s。RT-qPCR反应体系为20 μl,反应程序为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,40个循环,以β-肌动蛋白(β-actin)为内参,引物序列见表1,实验重复3次,以2-△△Ct法计算其相对表达量。

表1 引物序列
1.2.5 Western blot检测 应用放射免疫沉淀法(radio immunoprecipitation assay,RIPA)裂解液提取细胞总蛋白,以二喹啉甲酸(bicinchoninic acid,BCA)法进行蛋白定量,以30 μg总蛋白上样量进行蛋白电泳,聚偏氟乙烯(polyvinylidene fluoride,PVDF)转膜后用5%脱脂奶室温封闭2 h,分别进行一抗孵育(4 ℃,过夜),Tris-HCl缓冲盐溶液和吐温20(tris-buffered saline and tween 20,TBST)洗膜5次,5 min/次,分别孵育相应种属的HRP标记的二抗,室温孵育1 h,TBST洗膜5次,增强化学发光(enhanced chemiluminescence,ECL)荧光显色。采用凝胶成像系统(上海天能,Tanon 5200)拍照,应用Image J软件分析条带灰度值。
1.2.6 细胞凋亡检测 消化细胞制备单细胞悬液,根据凋亡检测试剂盒说明,用4 ℃预冷的PBS洗涤细胞2次,用结合缓冲液重悬,调节浓度为1×106cells/ml,取100 μl细胞悬液于流式管中,加入5 μl Annexin V/FITC混匀,室温避光孵育10 min,再加入5 μl PI,室温避光孵育5 min,最后加入400 μl PBS混匀后应用流式细胞仪(美国BD Biosciences,BD FACSCantoTM Ⅱ)进行检测分析。

2 结果
2.1OXA联合Ber干预对THC-8307/OXA细胞形态的影响 显微镜观察结果显示,与对照组相比,OXA组细胞的生长状态和细胞形态无明显变化。Ber+OXA组细胞生长被抑制,细胞贴壁不牢,体积变小伴核固缩,胞质中黑色颗粒增加,培养基中细胞碎片增多,且随Ber浓度升高,抑制作用越明显。见图1。
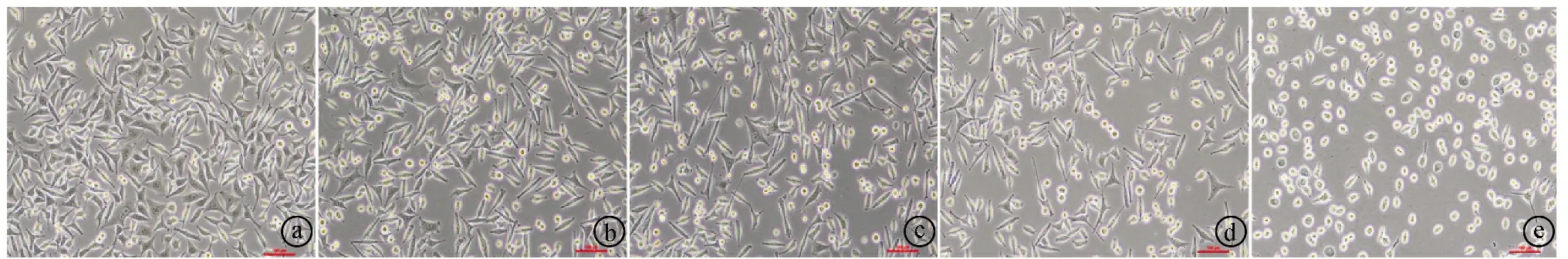
ⓐ对照组;ⓑOXA组;ⓒBer(5 μg/ml)+OXA组;ⓓBer(10 μg/ml)+OXA组;ⓔBer(20 μg/ml)+OXA组图1 显微镜观察各组细胞形态所见(×100)
2.2各组THC-8307/OXA细胞存活率比较 与对照组相比,Ber联合OXA干预可显著降低THC-8307/OXA细胞的存活率(P<0.05),但OXA组细胞存活率与之比较差异无统计学意义(P>0.05)。与OXA组相比,Ber+OXA组细胞存活率显著降低,其中Ber(10、20 μg/ml)+OXA组显著低于Ber(5 μg/ml)+OXA组,Ber(20 μg/ml)+OXA组显著低于Ber(10 μg/ml)+OXA组(P<0.05)。见表2。
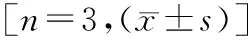
表2 各组THC-8307/OXA细胞存活率比较
2.3各组THC-8307/OXA细胞凋亡率比较 与对照组比较,Ber联合OXA干预细胞组的凋亡率均显著升高(P<0.05),但OXA组的细胞凋亡率与之比较差异无统计学意义(P>0.05)。与OXA组相比,各Ber+OXA组的细胞凋亡率显著升高,其中Ber(10、20 μg/ml)+OXA组显著高于Ber(5 μg/ml)+OXA组,Ber(20 μg/ml)+OXA组显著高于Ber(10 μg/ml)+OXA组(P<0.05)。见图2,表3。
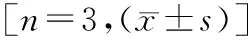
表3 各组THC-8307/OXA细胞凋亡率比较
2.4各组THC-8307/OXA细胞的MDR-1 mRNA和P-gp蛋白表达水平比较 与对照组相比,Ber联合OXA干预细胞组的MDR-1 mRNA和P-gp蛋白表达水平显著降低(P<0.05),但OXA组的MDR-1 mRNA和P-gp蛋白表达水平与之比较差异无统计学意义(P>0.05)。与OXA组相比,各Ber+OXA组的MDR-1 mRNA和P-gp蛋白表达水平显著降低,其中Ber(10、20 μg/ml)+OXA组显著低于Ber(5 μg/ml)+OXA组,Ber(20 μg/ml)+OXA组显著低于Ber(10 μg/ml)+OXA组(P<0.05)。见表4,图3。

图3 Western blot检测THC-8307/OXA细胞P-gp蛋白的表达结果图
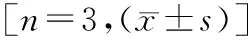
表4 各组THC-8307/OXA细胞的MDR-1 mRNA和P-gp蛋白表达水平比较
2.5OXA联合Ber对THC-8307/OXA细胞PI3K/Akt通路活化的影响 与对照组相比,Ber联合OXA干预细胞组的PI3K、p-Akt蛋白表达水平及p-Akt/Akt值显著降低(P<0.05),但OXA组与对照组比较差异无统计学意义(P>0.05)。与OXA组相比,各Ber+OXA组的PI3K、p-Akt蛋白表达水平及p-Akt/Akt值显著降低,其中Ber(10、20 μg/ml)+OXA组显著低于Ber(5 μg/ml)+OXA组,Ber(20 μg/ml)+OXA组显著低于Ber(10 μg/ml)+OXA组(P<0.05)。各组Akt蛋白水平比较差异无统计学意义(P>0.05)。见表5,图4。

图4 Western blot检测THC-8307/OXA细胞PI3K、p-Akt、Akt蛋白的表达结果图
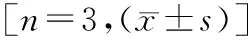
表5 各组THC-8307/OXA细胞的PI3K、p-Akt、Akt蛋白表达水平及p-Akt/Akt值比较
3 讨论
3.1OXA是继顺铂(cis-platinum,DDP)、卡铂(carboplatin,CBP)后第3代水溶性铂类化合物,通过铂原子与DNA共价结合损伤DNA,破坏DNA修复,导致肿瘤细胞凋亡,发挥抗肿瘤作用,目前广泛应用于胃癌、肝癌和结直肠癌等癌症的治疗[7]。肿瘤细胞耐药常导致化疗药物胞内浓度降低而不能有效致死癌细胞,增加化疗失败风险。因此,寻找耐药靶点和化疗药物的增敏剂,研究药物逆转机制对提高肿瘤细胞对化疗药物敏感性至关重要。
3.2Ber是一种异喹啉类生物碱,药理作用广泛,当与化疗药物联合应用时可辅助肿瘤治疗[8]。有研究证实,Ber与DDP联用,可通过激活caspase蛋白介导的凋亡通路诱导细胞凋亡,增强DDP对卵巢癌的化疗效果[9],还可增强乳腺癌细胞MCF-7对DDP的敏感性[10]。另外,Ber还可通过下调p-STAT3和生存素(survivin)表达水平,提高5-Fu对胃癌的疗效[5]。此外,本课题组的既往研究[6]发现,通过20 μg/ml Ber对THC-8307/OXA细胞进行干预后可使OXA对细胞的IC50从3.019 μg/ml降低至0.148 μg/ml,提示Ber可显著提高肿瘤细胞对化疗药物的敏感性,逆转耐药。本研究结果显示,经过不同浓度Ber(5、10、20 μg/ml)的处理后,THC-8307/OXA细胞的细胞存活率显著降低,凋亡率显著升高,且随着Ber的浓度升高效应增强,提示Ber能显著提高结肠癌细胞THC-8307/OXA对OXA的敏感性,增强化疗疗效。
3.3耐药机制的产生与膜转运蛋白介导的药物外排、凋亡异常和调节细胞增殖的信号通路相关。有研究发现,肿瘤的耐药机制与P-gp蛋白表达增高有关[11]。P-gp蛋白作为膜转运蛋白的成员,是腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)依赖的药物外排转运体,由MDR-1基因编码,可将多种化疗药物泵出胞外,增加药物外排,降低药物胞内浓度,诱导肿瘤细胞耐药性的发生。P-gp蛋白介导的MDR是导致肿瘤化疗失败率升高的重要原因之一,抑制P-gp蛋白表达或蛋白活性可以减弱肿瘤耐药效应[12]。有研究证实,下调P-gp蛋白表达可显著增强人胶质细胞瘤对替莫唑胺的敏感性[13]。伍奕等[14]的研究也显示,在结肠癌细胞HCT-8/VCR中添加Ber抑制P-gp蛋白表达,逆转了长春新碱(vincristine,VCR)的化疗效果,提示Ber逆转肿瘤耐药的机制与P-gp蛋白相关。本研究结果显示,不同浓度Ber(5、10、20 μg/ml)联合OXA处理THC-8307/OXA细胞后,MDR-1 mRNA和P-gp蛋白的表达均显著下调,且表现出剂量依赖性,表明Ber可通过下调P-gp的表达,进而增强结肠癌细胞对OXA的敏感性。
3.4PI3K/Akt信号通路在肿瘤发生中具有重要作用,Akt磷酸化促使靶基因激活,参与癌细胞增殖、存活、侵袭、转移和血管生成。而该通路异常激活也参与了卵巢癌、乳腺癌、肝癌以及结直肠癌等药物抵抗的发生[15]。另外,PI3K/Akt通路还可调控P-gp蛋白的表达,其下游核因子κB(nuclear factor kappa-B,NF-κB)可通过与MDR-1启动子结合,启动MDR-1基因转录。研究指出,抑制Akt磷酸化可以降低NF-κB磷酸化水平,进而抑制MDR-1基因转录,降低P-gp蛋白等ABC膜转运蛋白表达水平,最终抑制P-gp蛋白介导的肿瘤耐药机制[16]。Zhang等[17]的研究显示,下调激肽释放酶11(kallikrein 11,KLK11)可阻断PI3K/Akt信号通路,逆转HCT-8/OXA细胞对OXA的耐药性。Yu等[18]的研究也提示,在HCT116/OXA细胞中,抑制PI3K/Akt通路可导致MDR-1 mRNA和P-gp蛋白的表达水平下调,从而逆转HCT116/OXA细胞对OXA的耐药性,表明抑制PI3K/Akt信号通路可有效逆转肿瘤细胞对化疗药的耐药性。本研究结果显示,不同浓度Ber(5、10、20 μg/ml)联合OXA干预结肠癌细胞THC-8307/OXA后,PI3K、p-Akt蛋白表达水平和p-Akt/Akt值显著降低,且Ber浓度越高下降越显著,表明Ber可有效抑制结肠癌细胞中PI3K/Akt信号通路,进而逆转THC-8307/OXA细胞对OXA的耐药性。
综上所述,Ber具有显著的抗肿瘤活性,可逆转THC-8307/OXA细胞对OXA的耐药性,其机制可能与抑制PI3K/Akt信号通路,下调P-gp蛋白表达有关,进一步提示Ber可作为一种有效的化疗增敏剂以辅助结肠癌的化疗,值得深入研究。
