减菌技术在冷却肉关键安全控制点抑菌分子机制的研究进展
2021-12-02梁荣蓉朱立贤韩明山杨啸吟张一敏
杨 君,罗 欣,梁荣蓉,朱立贤,韩明山,杨啸吟,*,张一敏,*
(1.山东农业大学食品科学与工程学院,山东 泰安 271018;2.国家肉牛牦牛产业技术体系通辽站,内蒙古 通辽 028100)
冷却肉在屠宰、分割、贮藏销售过程中极易受到单核细胞增生李斯特菌(Listeria monocytogenes)、大肠杆菌O157:H7(Escherichia coliO157:H7)等致病菌以及假单胞菌(Pseudomonasspp.)、热杀环丝菌(Brochothrix thermosphacta)、乳酸菌(lactic acid bacteria,LAB)等腐败菌的污染[1]。为提高肉品安全性并延长其货架期,肉类工业生产者在各个环节采用了不同的栅栏因子以协同控制微生物的生长,比较常见的有在屠宰环节中使用有机酸喷淋胴体[2],在分割环节中利用电解水对加工接触面和设备工具进行清洗消毒[3],以及在贮藏销售环节中对冷却肉进行气调包装[4]等。通常情况下,采用单一的减菌措施并不足以完全杀灭微生物,而通过将各环节的杀菌措施进行科学组合,可实现对微生物的多靶位协同攻击,从而最大限度地抑制冷却肉中微生物的增殖。然而,目前关于各减菌技术抑菌机理的研究还相对独立,缺乏相互之间的内在联系,并且其中的很多分子减菌机制仍不明确,这已远不能满足企业实现微生物精确控制的生产需求。近年来,组学技术已逐渐成为在分子水平上阐释不同减菌技术诱发细菌衰亡及产生应激反应机制的有力工具,这为理解减菌过程中细菌的蛋白质调控机理以及代谢通路变化提供了可能。
因此,本文以冷却肉生产过程中的动物屠宰、胴体分割和冷却肉贮藏销售这3 个关键安全控制点为主线,针对各节点所采取的有机酸喷淋、电解水清洗和气调包装3 种重要栅栏因子减菌处理手段,通过总结、分析细菌胞内蛋白质和代谢物的变化水平来揭示这些减菌措施对细菌蛋白表达和代谢通路调控的影响,为全面理解上述减菌措施的减菌机制提供理论依据,并为企业科学设计配套栅栏技术提供便利,提高杀菌的针对性和有效性。
1 有机酸抑菌机理(动物屠宰环节)
在屠宰环节中,畜禽经去皮后,整个胴体完全暴露在外界环境中,此时胴体极易受皮毛污染物、肠道内容物和外界环境的污染[5],因此应尽快采取适宜的减菌措施。有机酸胴体喷淋作为现行屠宰环节中一个非常重要的栅栏因子,其使用已得到肉类工业的广泛认可。有研究表明,采用2%乳酸喷淋即可使肉牛胴体表面菌落总数减少1.6(lg(CFU/cm2))[2]。
目前关于有机酸抑菌机理的解释多为有机酸以未解离的形式自由扩散进入细菌细胞内部,并在其中解离产生H+导致细胞质酸化,进而干扰细菌的DNA表达和转录,以及蛋白的表达,引起细菌能量失衡[6]。但鉴于微生物体内所发生的生化反应的复杂性,传统有机酸抑菌理论并不适用于所有的微生物。经有机酸处理后,L. monocytogenes、E. coli、恶臭假单胞菌(Pseudomonas putida)等不同细菌的蛋白质表达和代谢物合成会发生不同的变化(表1),进而细菌结构会遭到破坏或其代谢发生紊乱,以达到抑菌的效果。

表1 有机酸对不同细菌蛋白表达和代谢途径的影响Table 1 Influence of organic acids on protein expression and metabolic pathways in different bacteria

续表1
1.1 影响细菌细胞结构相关的蛋白表达
有机酸对细菌的抑制主要体现在其对细胞膜蛋白的影响上,当参与细胞膜构建的蛋白发生改变时,会直接影响膜的完整性和通透性。Rodriguez-Moya等[7]对辛酸(15 mmol/L)处理的E. coliK12进行双向电泳(twodimensional electrophoresis,2-DE)分析,发现与未施加辛酸的对照组相比,辛酸能够调控运载碳水化合物进入细胞的外膜孔蛋白(outer membrane protin,Omp)F和OmpX下调表达(表1)。类似地,柠檬酸会抑制P. putida外膜孔蛋白OmpB的表达,并抑制该菌对葡萄糖的摄入,从而实现抑菌功效[11]。由此可见,一些有机酸会破坏膜上的通道蛋白使其产生孔洞,进而导致细胞内代谢物流失,并干扰细胞与外部环境的物质交换[12]。
除乳酸、乙酸、柠檬酸这些常见的有机酸外,石炭酸有时也被用于减菌处理中[13]。鞭毛作为附着在细菌外膜外侧的一类运动器官,具有运动和黏附、识别环境信号等功能;然而,鞭毛的装配和运动也会消耗细胞更多的能量[14]。研究表明,不同种类有机酸对鞭毛的调控机制并不完全相同。比如,乳酸和石炭酸分别抑制了编码E. coliO157:H7和荧光假单胞菌(Pseudomonas fluorescens)鞭毛蛋白合成fliC和fliA基因的表达,从而抑制了这些细菌鞭毛的生物合成[15-16]。然而,Rodriguez-Moya等[7]却发现控制E. coliK12鞭毛合成的鞭毛丝蛋白FliC在辛酸处理后表达量上调,促进了能量消耗,进而使该菌存活率降低[17]。造成上述辛酸和乳酸导致E. coli鞭毛蛋白差异表达的原因可能是不同种类的有机酸对不同菌种细菌的蛋白表达调控机制不同,因此若想全面揭示有机酸减菌技术的分子机制不能仅基于蛋白质组学的单一分析结果,还需在此基础上对上游关联基因的表达、转录、翻译水平进行靶向分析。
1.2 干扰细菌胞内代谢相关的蛋白表达
有机酸会破坏细菌的胞内pH值(pHi)和氧化还原平衡,影响细菌中某些调控糖代谢和氨基酸代谢等供能途径的关键蛋白的表达,进而干扰细菌生长所需的能量合成[18]。
研究表明,乳酸(23.6 mmol/L)和辛酸(15 mmol/L)会分别抑制L. monocytogenes和E. coliK12磷酸转移酶系统(phosphotransferase system,PTS)中磷酸载体蛋白的表达,进而抑制糖酵解途径中磷酸烯醇丙酮酸向丙酮酸的转化[7,19-20]。除此之外,乳酸还会抑制L. monocytogenes磷酸甘油酸激酶的表达[19],该酶可催化1,3-二磷酸甘油酸生成3-磷酸甘油酸和三磷酸腺苷(adenosine triphosphate,ATP);而石炭酸(800 mg/L)则会下调P. putida胞内葡萄糖-6-磷酸异构酶和果糖-1,6-二磷酸酶的表达[10]。在酸处理条件下,以上调控糖酵解进程的蛋白酶出现下调表达都能有效破坏细菌增殖所需要的能量供应。有机酸还能通过下调参与三羧酸(tricarboxylic acid,TCA)循环关键酶的表达对细菌能量代谢途径产生抑制作用。研究发现辛酸(15 mmol/L)会使E. coliK12丙酮酸脱氢酶下调表达[7],该酶可催化丙酮酸氧化脱羧成乙酰辅酶A,乙酰辅酶A是连接糖酵解与TCA循环两大供能体系的重要节点。另外,石炭酸则会抑制P. putida中诸如异柠檬酸脱氢酶、顺乌头酸酶、延胡索酸水合酶等一系列TCA循环关键酶的表达[10]。一旦TCA循环途径无法正常进行,也将对细菌的能量摄入产生不利影响,进而抑制其生长繁殖。但值得注意的是,在冷却肉实际生产中,工业化生产目前所使用的有机酸浓度要远低于实验研究设计的浓度,因此,对有机酸抑菌机理的探索还应与实际生产操作相结合。
有机酸还会影响细菌DNA的合成进而影响转录进程[21],然而目前关于有机酸究竟如何影响与DNA合成相关的酶的表达及其所调控的代谢通路仍不明确,亟待阐明。
1.3 有机酸诱导耐酸响应机制
值得注意的是,有机酸会激发某些细菌的诱导耐酸响应。面对酸处理,细菌通常会通过调控自身代谢途径和蛋白表达以提高适应性来应对有机酸胁迫,这种应激调控反应会减弱有机酸的抑菌效果,因此明确细菌耐酸性的形成机制也是研究有机酸抑菌原理的重要一环[18]。
1.3.1 调控蛋白表达和代谢物合成以维持细菌内环境稳态
谷氨酸脱羧酶(glutamate decarboxylase,GAD)系统是E. coli产生诱导耐酸响应的主要耐酸机制之一[22]。经乙酸(pH 3.2)或乳酸(pH 2.56)处理后,E. coliO26:H11会利用谷氨酸脱羧酶GadA和GadB催化谷氨酸转化为γ-氨基丁酸(γ-aminobutyric acid,GABA),而GABA含量的增加会消耗掉细胞内多余的H+,从而维持pHi稳定,防止细菌被有机酸杀死[8,23]。此外,采用乳酸(pH 5.0)处理或者乙酸和乳酸(pH 5.0)的协同处理都会促进L. monocytogenes中全局转录调控因子CodY和胞内抗氧化酶(过氧化氢酶和超氧化物歧化酶)的表达,进而清除活性氧自由基(reactive oxygen species,ROS),减少有机酸胁迫所带来的细菌氧化应激反应以维持其内环境的稳态[9,19]。但目前有关CodY在L. monocytogenes抗酸胁迫中的作用仍需进一步研究。
1.3.2 调控蛋白表达和代谢物合成以干扰细菌胞内代谢活动
为提高耐酸性,L. monocytogenes经乳酸(pH 5.0)处理后,具有修复蛋白质错误折叠功能的3 种伴侣蛋白(DnaKJ、GrpE、GroEL)表达量显著增加,这与乳酸菌在酸胁迫下的蛋白质表达类似[19,24]。其中GroEL可以促进顺乌头酸酶的折叠,有利于TCA循环途径的进行,并抑制了细胞凋亡[25],但关于GroEL是如何阻止蛋白错误聚集并显著提高其折叠速度的调控机制至今仍未有明确定论。He Lei等[9]利用2-DE技术发现乙酸和乳酸(pH 5.0)协同处理会促进L. monocytogenes中参与磷酸戊糖途径(pentose phosphate pathway,PPP)的6-磷酸葡萄糖酸内酯酶和核酮糖-5-磷酸-3-差向异构酶的表达,并且降低L-乳酸脱氢酶的表达,进而抑制了丙酮酸向乳酸的转化,而丙酮酸的积累有利于细菌维持其胞内糖代谢途径的进行,最终减少了有机酸对L. monocytogenes的损伤。此外,L. monocytogenes还会通过上调磷酸盐转乙酰酶和乙酸激酶的表达量来提高自身耐酸性[9,19],但由这些酶介导的底物磷酸化途径尚不清楚。
Chen Lin等[8]利用核磁共振氢谱(proton nuclear magnetic resonance,1H-NMR)代谢组学技术发现乳酸(体积分数2%、pH 2.56)酸激处理可使E. coliO26:H11胞内葡萄糖-1-磷酸和丙酮酸大量积累,从而加速了该菌的糖酵解进程;并且发现α-酮戊二酸、琥珀酸的含量也升高,这有利于TCA循环的进行,也从下游代谢物层面上验证了上文中关于有机酸会促进某些参与糖酵解和TCA循环代谢酶的表达来提高细菌耐酸性的研究结果。另外,乙酸则会抑制E. coliK12胞内蛋氨酸的合成,并促进半胱氨酸的积累,这会对细菌产生毒害作用[26]。
针对上述诱导耐酸响应的产生机制,为提高有机酸的抑菌效果,在实际生产中可以尝试与其他减菌技术相结合,靶向抑制这些与细菌耐酸作用相关的糖代谢或氧化应激调控酶的表达和代谢物的合成,以便降低细菌的耐酸性来更好地发挥有机酸的杀菌效果。
2 电解水抑菌机理(胴体分割环节)
冷却肉的初始微生物污染除来自屠宰环节中的胴体污染外,分割时所用的刀具以及操作接触面也是另一重要污染源[1]。有研究表明,肉牛屠宰线中案板上有高达5.09(lg(CFU/cm2))的细菌,每把刀具上的菌落总数也高达6.54((lg CFU))[5]。因此,对加工工具进行严格的清洗和消毒尤为重要。
电解水是一种具有消毒功能的溶液,其生产是利用电化学方法,将低浓度的电解质溶液(如NaCl溶液、稀盐酸溶液或两者的混合溶液)在电解槽内进行电解,使其pH值、氧化还原电势(oxidation reduction potential,ORP)、有效氯浓度(available chlorine concentration,ACC)、ROS等发生一系列变化[3]。电解水不仅制取方便、成本低廉、贮藏稳定、广谱高效[3],还能够有效降低次氯酸钠与食品中的有机物发生反应生成含氯副产物的风险[27]。根据加工工艺、电解质和pH值的不同,可将电解水分为酸性电解水(pH 2.5~3.5)、微酸性电解水(pH 5.0~6.5)、中性电解水(pH 7~8)和碱性电解水(pH 10~13)4大类[3]。在以上电解水中,酸性和微酸性电解水的杀菌应用比较广泛,可抑制E. coli、L. monocytogenes、副溶血性弧菌(Vibrio parahaemolyticus)等大多数有害微生物的生长,其中酸性电解水已被推荐成为新型食品接触面的优良消毒剂[3]。但酸性电解水和微酸性电解水的抑菌机理目前尚且处于探索阶段,通过了解其分子水平上的抑菌机制,可为这两种电解水在肉品工业中的应用以及新型电解质杀菌剂的开发提供理论基础。
2.1 影响细菌细胞结构
酸性电解水的杀菌效果主要取决于HClO和ClO-在微生物细胞膜上的扩散能力。由于细菌的某些细胞壁结构和质膜的磷脂双分子层结构使得离子化的ClO-无法穿透其细胞膜,ClO-只在细胞外起氧化作用,ClO-可先使细菌细胞壁和细胞膜出现破裂或解体,再使位于质膜的功能蛋白失活[32]。HClO则是以被动扩散的形式穿透质膜,Rahman等[3]指出这可能会抑制与细胞膜转运功能和细胞增殖功能相关的酶的活性,从而加速细菌失活速率,进一步增强酸性电解水的杀菌效果。另外,电解水电离过程中形成的ORP也会因影响细胞膜蛋白的表达而破坏其完整性,使细胞内成分释放,导致细菌凋亡[33]。
2.1.1 调控蛋白表达
蔡林林等[34]发现,P. fluorescens菌悬液经ACC为20、40、60 mg/L的酸性电解水处理后,菌落数均降低了7(lg(CFU/mL)),菌体膜完整性也分别降低至2.26%、1.87%、1.20%,而且该菌胞外聚合物中的总糖和蛋白含量也呈现降低趋势,但该研究并未指出具体哪些蛋白受到了影响。V. parahaemolyticus经微酸性电解水(pH 5.5,ACC 80 mg/L)处理后,外膜孔蛋白OmpK、OmpU出现上调表达[31],这可能是该菌为适应微酸性电解水环境而启动的一种自我保护机制,从而有助于细胞外膜完整性的恢复。虽然与前面提到的有机酸对Omp表达的影响不一致,但以上结果均说明细胞膜的孔蛋白是有机酸和电解水发挥作用的一个重要共同靶点。
2.1.2 调控代谢物合成
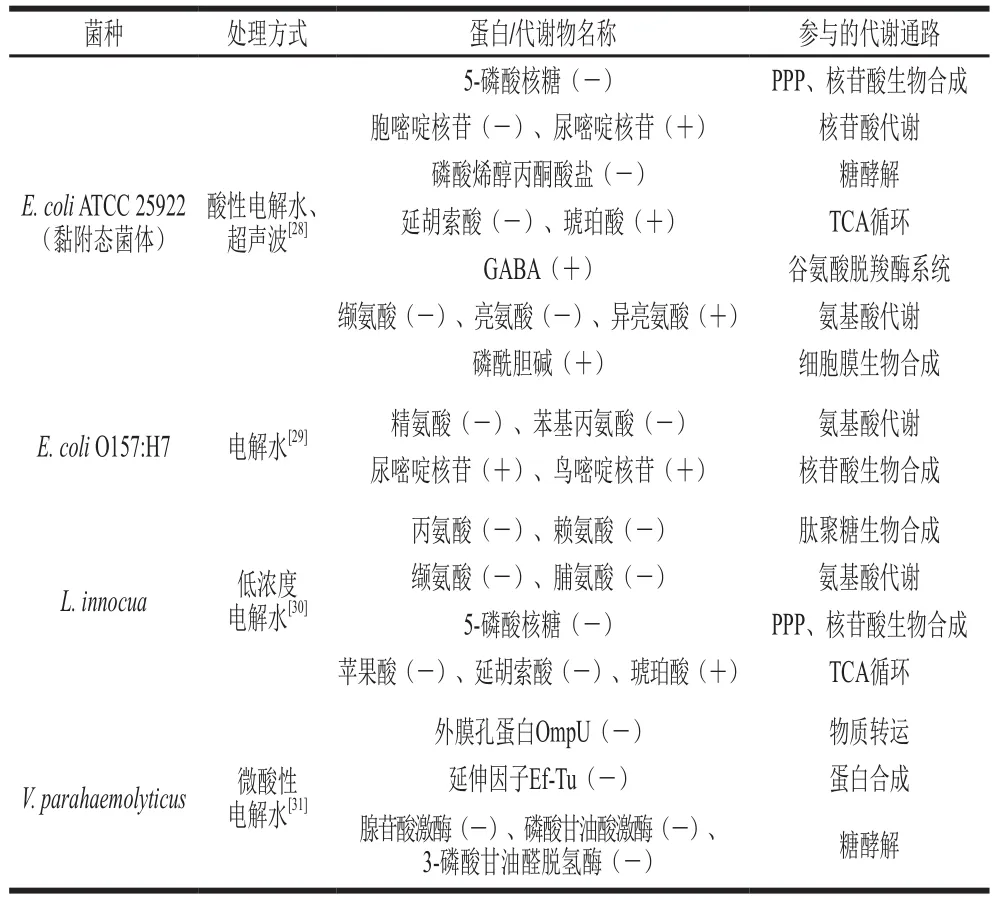
电解水(ACC 4 mg/L)会抑制E. coliO157:H7脂质Iva的生物合成[29],该化合物是合成细胞膜脂质A的前体物质,因此电解水会破坏细胞膜的通透性,进而抑制细菌生长[35]。英诺克李斯特菌(L. innocua)与L. monocytogenes在生化、血清学和形态学特性上具有高度相似性,但由于L. innocua的非致病性使其成为研究L. monocytogenes的重要替代菌种[36]。Liu Qin等[30]利用低浓度电解水(pH 3.6~4.4、ORP 910~1 014 mV、ACC 4 mg/L)对L. innocua进行处理,通过1H NMR代谢组学技术分析发现电解水处理使得该菌胞内的丙氨酸、赖氨酸、缬氨酸、脯氨酸等氨基酸含量下降。关于E. coliATCC25922的类似研究也有相似的发现[28](表2)。由于丙氨酸和赖氨酸是肽聚糖生物合成所需乙酰胞壁酰五肽的前体物,这也侧面印证了电解水会干扰细菌细胞壁的合成。另外,一定量的氨基酸是细胞维持渗透压平衡,并防止亚细胞结构崩溃的必要条件[37]。上述氨基酸的减少意味着电解水会破坏细胞质渗透压平衡和亚细胞结构,不利于细菌的生长繁殖。
2.2 干扰细菌胞内代谢活动
2.2.1 调控蛋白表达
Chen Taiyuan等[31]利用2-DE蛋白组学研究微酸性电解水(pH 5.5,ACC 80 mg/L)对V. parahaemolyticus的抑制作用,发现与未处理的对照组相比,电解水处理同石炭酸处理相似[10],也会抑制细菌胞内与转录和翻译调节相关的延伸因子EF-Tu的表达(表2);另外,负责能量代谢的磷酸甘油酸激酶、腺苷酸激酶、3-磷酸甘油醛脱氢酶和烯醇酶的表达量也出现了下降。其中,磷酸甘油酸激酶的表达变化与其在L. monocytogenes面对乳酸(pH 5.0)处理时的表达情况相近[19]。该酶在维持细胞能量代谢过程中起着重要作用,它能催化单磷酸腺苷(adenosine monophosphate,AMP)磷酸化成二磷酸腺苷(adenosine diphosphate,ADP),生成的ADP则会通过氧化磷酸化生成ATP来为机体供能[38]。此外,在糖酵解中3-磷酸甘油醛脱氢酶催化3-磷酸甘油醛生成1,3-二磷酸甘油酸,而烯醇酶则负责催化2-磷酸甘油酸生成磷酸烯醇丙酮酸。因此,电解水会直接干扰糖酵解途径的进行并减少ATP的合成,从而抑制细菌的生长。
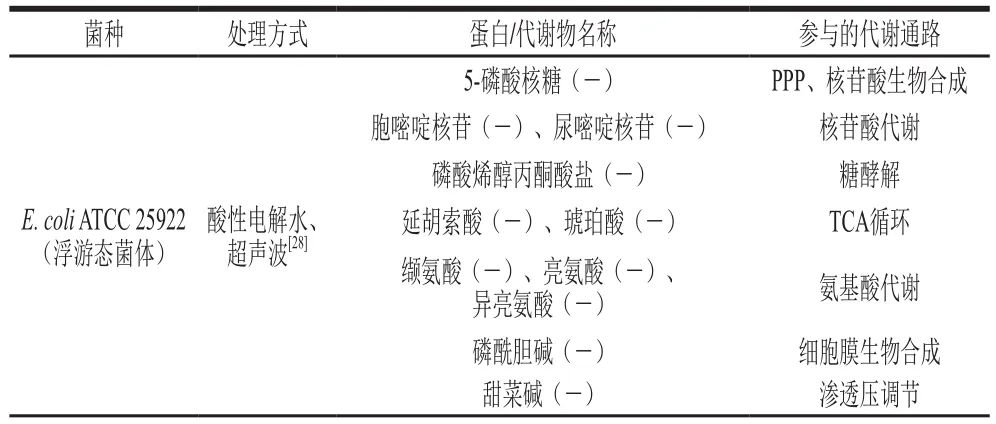
表2 电解水对不同细菌的蛋白表达和代谢调控的影响Table 2 Influence of electrolyzed water on protein expression and metabolic pathways in different bacteria
续表2
2.2.2 调控代谢物合成
参考国外机构知识库建设的经验和建库技术,再加上一些课题及文献的出谋划策,所以国内机构知识库的建设虽然起步比较晚,但是发展势头强劲。根据文献资料可知,截至2010年5月9日,在OpenDOAR上注册的中国大陆及港、澳、台地区的机构库总数为30个,而截至2018年9月该数目增加至106个。可见,8年内注册的中国机构库数目增长了近4倍,还不包括一些目前在建的没有注册的机构库。但是,这已注册的106个机构库中,大陆及港、澳地区仅有45个,其中属于高校建设的机构库不足10个。
电解水制备过程中,次氯酸和过氧化氢的存在会促使微生物体内ROS的产生,引起DNA结构和功能的损伤,进而加速细胞坏死和凋亡[3]。L. innocua和E. coli经过电解水处理后,核苷酸生物合成所需的关键前体物:5-磷酸核糖以及尿嘧啶核苷酸和胞嘧啶核苷酸均出现相应减少,因此电解水通过影响细菌的核苷酸代谢来抑制其DNA复制,对细胞增殖造成了明显不良影响。值得注意的是,电解水还会减少L. innocua和E. coli细胞内延胡索酸这种参与TCA循环的关键代谢物含量(表2),致使这两种细菌的能量代谢活动紊乱。
酸性电解水不仅能抑制L. innocua和E. coli悬浮细胞和贴壁细胞的糖代谢进程,还能抑制L. innocua和E. coli悬浮细胞丙氨酸、脯氨酸、天冬氨酸、谷氨酸、精氨酸、甘氨酸、丝氨酸、苏氨酸等氨基酸的代谢,但其对E. coli贴壁细胞的氨基酸代谢则没有明显的抑制作用(表2)。另外,贴壁细胞还会促进GABA的合成以增强其耐酸性,增加琥珀酸含量来促进TCA循环途径的正常运行[28],因此,贴壁细胞可能正是通过调节以上代谢途径降低了电解水对其抑菌效果。Mikš-Krajnik等[39]指出单独使用电解水这一种栅栏因子并不足以完全灭活微生物,因此探寻电解水与其他技术的组合应用或将成为下一步研究的重点。Mansur等[40]发现微酸性电解水和体积分数0.5%延胡索酸对E. coliO157:H7、L. monocytogenes的协同抑菌作用要优于微酸性电解水的单独使用。这可能是由于不同栅栏因子针对细菌胞内的不同靶点从多个方向共同打破了细菌的内平衡,而在相同靶点上则发挥了它们抑菌的叠加功效,实现了栅栏交互作用。因此在喷淋胴体或清洗工具杀菌时,可将电解水与有机酸复配从而更加有效地减少细菌污染,如何实现不同种类有机酸和电解水的优化配比值得下一步深入探究。
3 气调包装抑菌机理(冷却肉贮藏销售环节)
作为肉制品供应流通体系的重要栅栏因子,气调包装通常被用于冷却肉贮藏销售环节以减少微生物的污染。该包装系统可影响微生物群落的演替过程并抑制优势腐败菌群的生长,并有效抑制微生物的代谢活动来降低醇、醛、酮、酯等异味代谢物的生成,最终实现冷却肉货架期的有效延长[4]。气调包装中的常用气体成分主要有O2、N2、CO2,其中CO2是气调包装中的关键抑菌气体,可延长微生物生长的迟滞期并降低对数期的生长速率,使微生物的生长速率降低25%~30%[41]。但CO2对不同微生物的抑制效果并不相同,比如对革兰氏阴性菌的抑制效果要大于革兰氏阳性菌[41]。这可能是由于革兰氏阳性菌的细胞壁更加致密,且肽聚糖含量更高[42],所以导致细菌对CO2不敏感,也可能是CO2对两种类型细菌蛋白表达和代谢通路的影响机制不同造成的。因此,了解气调包装的分子抑菌机制以及该系统下的微生物耐受机制,可为将来更好地发挥其抑菌作用提供理论指导,同时还有助于加强气调包装与其他减菌技术(如有机酸喷淋、电解水减菌)的联合应用研究,以此通过设计更合理的多重减菌技术来显著增强原有单一减菌措施的抑菌效果。
3.1 干扰细菌胞内代谢相关的蛋白表达
相较于其他优势腐败菌,包装内CO2对假单胞菌的抑制效果较为明显[43]。研究显示,类似于石炭酸对P. putida关键代谢酶的抑制作用[40],CO2也可以抑制P. fluorescensTCA循环中异柠檬酸脱氢酶、苹果酸脱氢酶、顺乌头酸酶、琥珀酸脱羧酶和延胡索酸水合酶的活性,进而降低细菌对碳源的利用率,造成细菌能量代谢紊乱[44-45]。有研究发现气调包装(30% CO2/70% N2)会抑制莓实假单胞菌(Pseudomonasfragi)胞内负责调控DNA复制的相关酶的表达(表3),从而影响细胞的增殖;同时电子传递链复合体I中的NuoA和NuoB亚基也出现了下调表达,这会降低NADH-辅酶Q氧化还原酶的表达量,进而降低细菌的跨膜质子梯度和ATP合成能力,抑制其增殖[46]。还有研究指出30% CO2/70% N2包装环境能够抑制广布肉食杆菌(Carnobacterium divergens)胞内血红素氧化酶的表达,降低了该菌对血红素的吸收和降解,促使C. divergens呼吸作用被抑制[47-48]。
3.2 影响细菌细胞结构相关的蛋白表达
CO2会作用于细胞膜脂质来影响细胞膜通透性,也可能会抑制某些转运酶的表达来降低细胞吸收离子的能力[41]。Kolbeck等[47]发现70% O2/30% CO2气调包装下,冷生明串珠菌(Leuconostoc gelidum)细胞膜上参与锰离子和钴离子转运的ATP结合盒式(ATP-binding cassette,ABC)转运蛋白表达量发生下调(表3),这破坏了该菌金属离子跨膜转运的动态平衡,该研究为上述理论提供了依据。然而,Wang Guangyu等[49]却发现气调包装(30% CO2/70% N2)虽会增大P. fragi细胞膜的通透性,但并不能破坏其完整性,因此气调包装对细胞膜结构的作用靶点可能与有机酸和电解水并不相同。除此之外,该包装体系还显著抑制了负责调控P. fragi鞭毛(flgB、fliF、fliJ、fliO、fliP和motA)和菌毛(flimA)组装及运动的基因表达,进而抑制了相关鞭毛结构蛋白的表达[46]。
3.3 包装体系内的菌群拮抗作用
有些气调包装系统能够诱导菌群结构朝向有利于冷却肉货架期延长的方向发展,例如,低氧包装贮藏后期的优势菌群乳酸菌能分泌乳酸、过氧化氢和细菌素等抑菌代谢物,拮抗抑制其他细菌的生长[50-51]。然而,Nilsson等[52]却发现某些麦芽糖C. divergens并不会产生细菌素等抑菌物质,而主要是通过竞争葡萄糖来降低L. monocytogenes的生长速率,并导致其嘌呤和嘧啶代谢被抑制。Orihuel等[53]也发现在与其他细菌共同培养时,E. coli生长受限并非乳酸菌分泌的乳酸或细菌素所致,更有可能缘于其他菌群的竞争性抑制;该研究还将蒙氏肠球菌(Enterococcus mundtii)和E. coliO157:H7进行共同培养,并对Ent. mundtii进行2-DE蛋白质组学分析,发现Ent. mundtii的磷酸烯醇丙酮酸盐磷酸转移酶上调表达,这加剧了该菌与E. coliO157:H7对葡萄糖的竞争。另外,与E. coliO157:H7相比,Ent. mundtii的肽酶、氨肽酶、6-磷酸葡萄糖酸脱氢酶和酮糖转移酶也都表达上调,说明Ent. mundtii的肽分解代谢和糖代谢更为旺盛。综上,Ent. mundtii会与E. coliO157:H7直接竞争营养物质,从而抑制E. coliO157:H7的生长。乳酸菌作为传统的肉制品生物保护菌,以后的研究如果能在蛋白表达和代谢层面上充分阐释其对其他菌群的抑制作用,从营养竞争等方面全面揭示该菌的抑菌机制,将能进一步帮助企业更好地使用乳酸菌等有益优势菌群作为栅栏因子以提高冷却肉的感官品质和安全性。
3.4 细菌对气调包装的耐受机制

表3 气调包装对不同细菌的蛋白表达和代谢途径的影响Table 3 Influence of modified atmosphere packaging on protein expression and metabolic pathways in different bacteria
3.4.1 调控蛋白表达以维持细菌内环境稳态
通常认为CO2的抑菌效果的实现主要依赖于其溶于水后形成H2CO3,解离出H+从而降低pHi[57]。然而,高浓度CO2无氧环境会促进C. divergens和C. maltaromaticum胞内精氨酸脱亚胺酶、丙氨酸脱氢酶、酪氨酸脱氢酶的表达,催化产生氨气和生物胺等碱性产物以维持pHi稳定,减弱CO2的抑菌效果[47]。另外,CO2还会促进B. thermosphacta中用于降解乙醇胺所需的酶(如乙醛脱氢酶、乙醇脱氢酶、磷酸丙酰基转移酶等)的表达来加剧乙醇胺的降解,从而导致氨气和乙酰辅酶A的产生[47,54]。这种氨气诱导合成途径可能会中和B. thermosphacta胞内的H+而使pHi维持稳定,进而减弱CO2的抑制效果,然而关于该解释还有待进一步验证。
Kolbeck等[47]对从牛肉糜中分离出的B. thermosphacta、Leu. gasicomitatum在密封的玻璃瓶中进行不同气体处理(空气、100% N2、70% O2/30%CO2、30% CO2/70% N2),通过非标记定量蛋白质组学发现不同种类细菌为适应高氧的气体环境,均能通过调控不同酶的表达来降低氧化应激造成的损伤。比如B. thermosphacta在有氧条件下会上调对氧敏感的丙酮酸甲酸裂合酶、硫氧还蛋白和过氧化氢酶的表达,而Leu.gasicomitatum胞内硫氧还蛋白还原酶和过氧化物酶的表达量也会出现增加,这与上文提到的当L. monocytogenes面对有机酸处理时会上调与氧化应激相关酶的表达来维持细菌胞内环境稳态的报道[9]具有相似性(表1)。
3.4.2 调控蛋白表达和代谢物合成以维持细胞结构稳定
在逆性生长环境下,细菌为维持细胞膜的稳定性及正常生理功能,通常会通过改变细胞膜的脂肪酸种类和组成来调节其流动性[58]。与100% N2气体环境相比,30%CO2/70% N2无氧条件会促进C. maltaromaticum中与细胞膜脂肪酸合成相关的关键酶(乙酰辅酶A羧化酶、S-丙二酰转移酶、3-酮脂酰ACP还原酶)的表达,以使该菌在CO2环境下维持细胞结构稳定[47]。30% CO2/70% N2气调包装虽然会影响P. fragi的生命活动,抑制其致腐能力,但也会促进丝氨酸的积累,进而有利于S-腺苷甲硫氨酸的合成,此代谢物属于甲硫氨酸代谢途径中的关键节点物质[59],尽管气调包装对该代谢途径的调控机理尚不清楚,但S-腺苷甲硫氨酸甲基化后可与不饱和脂肪酸结合生成环丙烷脂肪酸(cyclopropane fatty acids,CFAs)[60],CFAs已被证实可以降低盐酸对E. coli造成的膜损伤,对维持细胞存活起重要作用[61],因此推测CO2也可能会诱导P. fragi通过上述途径调节细胞膜结构来提高其对逆性环境的抗性,而相关方面的探索至今仍鲜有报道,值得深入研究。
4 3 种减菌技术的协同减菌机制
食源性致病菌和腐败菌的生长是影响冷却肉安全性与货架期的关键因素,因此如何对二者实施全链条的有效控制一直是肉类企业实际生产中的迫切需求。对于有机酸胴体喷淋、电解水清洗减菌以及气调包装技术这3 种常用栅栏因子,除已知的传统抑菌机制外,了解其对细菌蛋白表达和代谢物合成的分子调节机制将直接决定着未来实施这些措施的最终抑菌效果。
综上所述,基于冷却肉生产的屠宰、分割、贮藏销售3 个关键环节的有机酸胴体喷淋、电解水清洗以及气调包装技术均主要通过干扰细菌的糖代谢(糖酵解和TCA循环)、氨基酸代谢进程从而抑制食源性致病菌和腐败菌的增殖。这3 种减菌技术虽然在各个生产环节上相互独立,但在抑菌机制上却又互相关联,存在共通之处。如图1所示,有机酸和电解水会抑制磷酸甘油酸激酶的表达,进而不利于糖酵解途径的进行[19,31];有机酸和气调包装会抑制异柠檬酸脱氢酶、顺乌头酸酶、胡索酸水合酶的表达从而抑制TCA循环[10,44];电解水和气调包装则对细菌缬氨酸、亮氨酸、异亮氨酸的分解代谢具有一定的抑制作用[10,26,44,47,54]。此外,有机酸和电解水还会调控细菌外膜孔蛋白的表达,从而造成细菌的细胞膜损伤[7,31];而有机酸和气调包装会通过影响细菌鞭毛蛋白的表达来影响细菌的运动和黏附[7,46];电解水会抑制细菌5-磷酸核糖、胞嘧啶核苷酸等代谢物的合成,而气调包装则会抑制细菌DNA聚合酶III、核糖核酸酶HI、脱氧核糖核酸外切酶I的表达,进而干扰细菌DNA的合成[28,46]。因此,这3 种减菌技术在冷却肉生产的不同环节从不同的抑菌角度协同发挥抑菌作用,从而降低冷却肉的终端污染水平。
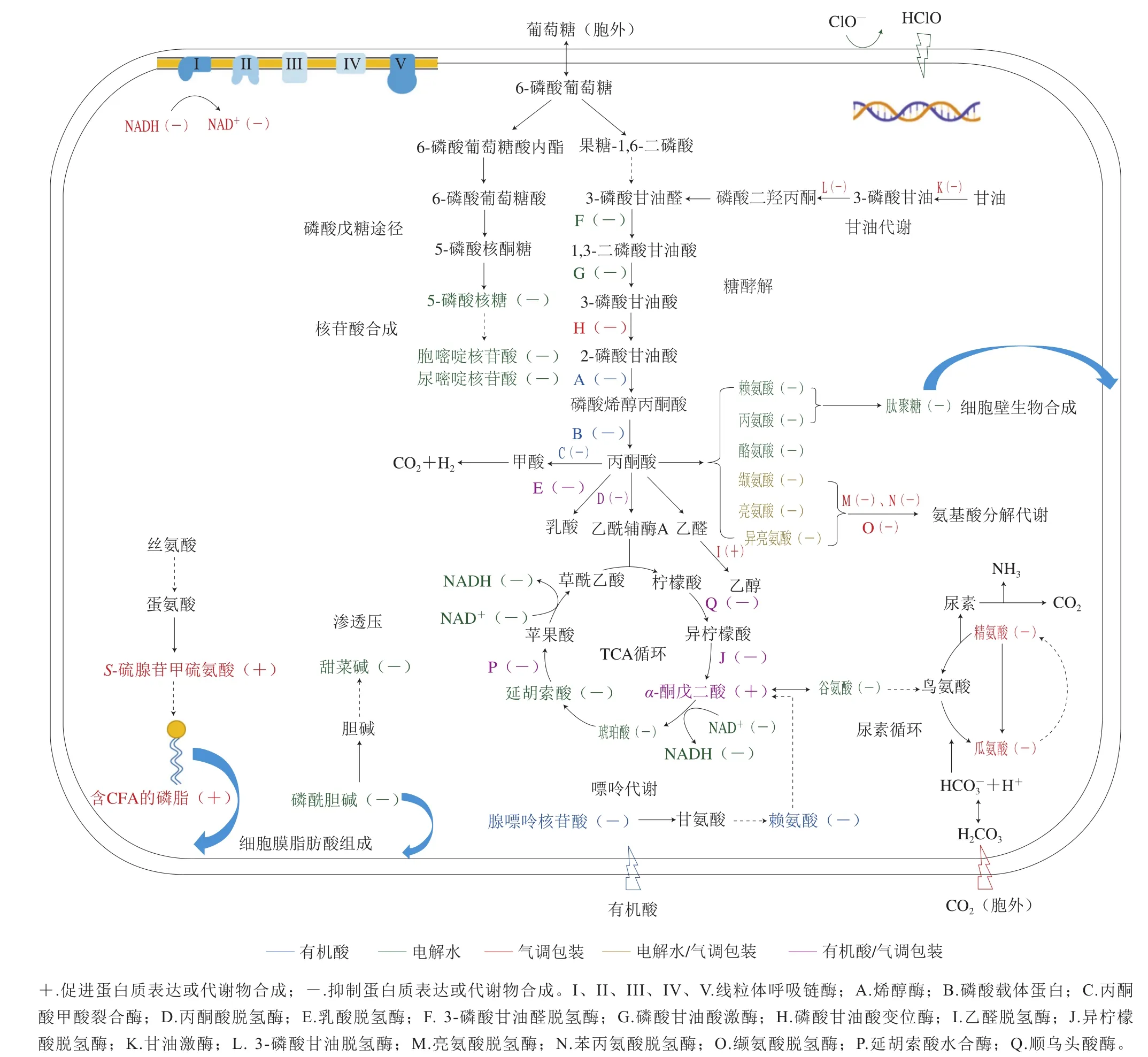
图1 3 种减菌措施对细菌代谢途径的抑制作用[3,7-10,19,28-31,46-47,54]Fig. 1 Inhibitory effects of three decontamination technologies on bacterial metabolic pathways[3,7-10,19,28-31,46-47,54]
但是,某些细菌在不同的减菌处理后也能够表现出一定的耐受性。例如,在有机酸或酸性电解水处理过程中,L. monocytogenes和E. coli等细菌为适应逆性环境会促进参与自身PPP、糖酵解、TCA循环这些代谢途径关键酶的表达或代谢物的合成,而B. thermosphacta、Leu. gelidum和C. divergens会促进调控氧化应激和细胞膜脂肪酸合成相关酶的表达来维持自身细胞结构稳定及内环境稳态,进而减弱相应的减菌效果。因此,在应用单一减菌技术时,应充分考虑细菌的诱导性应激反应对该措施抑菌效果所产生的不利影响。而多重减菌技术的联合应用能够从一定程度上避免上述弊端,因此,减菌技术的选择要结合多种栅栏因子,发挥其协同作用,通过靶向激活或抑制相关的信号通路来提高细菌对栅栏因子的敏感性,从而增强冷却肉生产企业对有害微生物的靶向控制。
5 结 语
虽然有机酸胴体喷淋、电解水清洗减菌以及气调包装技术3 种减菌技术的分子机制正在逐渐完善,但目前对有机酸分子抑菌机理的研究还大多停留在致病菌的蛋白表达层面上,对其代谢层面上的抑菌机制还有待进一步探索,并且当前对有机酸抑制腐败菌的作用机理也所知甚少。在细菌产生应激反应时,分子伴侣蛋白对调控其转录和细胞凋亡等复杂通路至关重要,因此可从蛋白互作图谱入手,找寻有意义的应激网络调控通路,从而为阐明细菌适应环境胁迫的分子机制提供研究新思路。
另外,目前关于有机酸、电解水、气调包装对微生物胞内蛋白和代谢物的研究仍多为实验室体外培养,这可能与细菌在肉中或在屠宰场实际环境下的代谢调控存在差异,且这些实验室研究多为在蛋白或代谢物水平上的单一分析,若将蛋白表达和代谢调控相结合,以代谢通路为载体,探寻出差异蛋白和差异代谢物所参与的共同通路,再施以转录组学进行上游靶向验证,则能够建立起一套自上而下系统的抑菌理论体系。
